MENU
硫黄の単体と化合物の性質・製法
はじめに
【プロ講師解説】このページでは『硫黄の単体と化合物の性質・製法』について解説しています。
硫黄の単体
- 硫黄の単体には斜方硫黄・単斜硫黄・ゴム状硫黄などの同素体が存在する。
- これらの性質について、次の表にまとめる。
| 名称 | ❶ 斜方硫黄 | ❷ 単斜硫黄 | ❸ ゴム状硫黄 |
|---|---|---|---|
| 化学式 | S8 | S8 | S |
| 構造 | 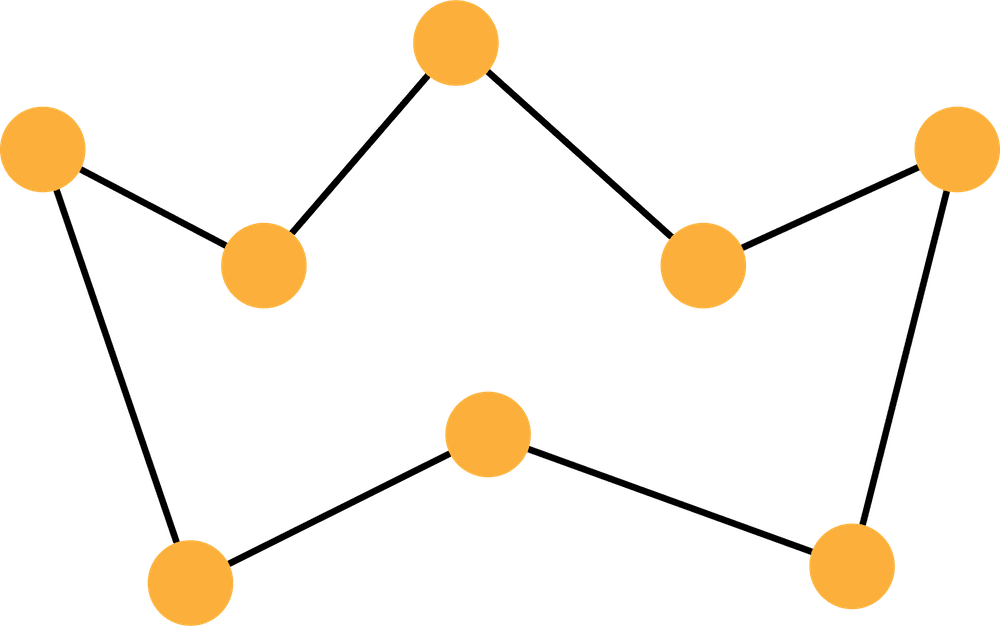 環状 環状 |  環状 |  高分子 高分子 |
| 特徴 | 黄色 八面体状結晶 安定 | 黄色 針状結晶 常温で放置すると斜方硫黄になる | 暗褐色 長鎖状分子 弾性あり 常温で放置すると斜方硫黄になる |
❶ 斜方硫黄
- 黄色で八面体構造をもつ硫黄の結晶を斜方硫黄という。
- 斜方硫黄は硫黄の同素体の中で最も安定している。
- 斜方硫黄は粉末状の硫黄を二硫化炭素CS2に溶かし、放置すると析出する。
- 斜方硫黄の化学式はS8である。8個の硫黄S原子が結合してできた環状分子であり、これが分子間力により積み重なってできている。
❷ 単斜硫黄
- 加熱により融解した硫黄を、空気中で放冷することで析出する硫黄の結晶を単斜硫黄という。
- 単斜硫黄は斜方硫黄に比べて不安定であり、常温で放置すると斜方硫黄に変化する。
- 単斜硫黄の化学式はS8である。斜方硫黄同様、環状分子が分子間力により積み重なっているが、斜方硫黄より高温であり分子の動きが激しいため、密度は斜方硫黄よりも小さい。
❸ ゴム状硫黄
- 硫黄の融解液(黄色)をさらに加熱すると、色が濃く、粘度が高くなる。これを水中に流し込んで急冷すると得られる暗褐色で弾性をもつ物質をゴム状硫黄という。
- 高温下では、硫黄の環状分子の結合が切れ、それが別の分子と繋がることで長鎖状分子になっている。これを急冷すると安定した環状分子に戻ることができず、そのまま固まってゴム状硫黄となる。
- ゴム状硫黄は不安定であり、常温で放置すると斜方硫黄に変化する。
斜方硫黄・単斜硫黄・ゴム状硫黄の関係まとめ
- 先述の❶ 斜方硫黄 ❷ 単斜硫黄 ❸ ゴム状硫黄の関係をまとめる。

硫化水素H2S
- 硫黄の水素化物を硫化水素H2Sという。
- H2Sの特徴は、次の通りである。
● 硫化水素H2Sの特徴
- 無色/腐卵臭/有毒
- 2価の弱酸
- 還元剤
- 重金属イオンと反応し、硫化物の沈殿を形成する
- 【実験室的製法】硫化鉄(Ⅱ)FeSに塩酸HClまたは希硫酸H2SO4を加える
❶ 無色/腐卵臭/有毒
- H2Sは無色/腐卵臭/有毒の気体である。
❷ 2価の弱酸
- H2Sは酸・塩基反応において、2価の弱酸としてはたらく。
\[
\mathrm{H_{2}S → 2H^{+} + S^{2-}}
\]
❸ 還元剤
- H2Sは酸化・還元反応において、還元剤としてはたらく。
\[
\mathrm{H_{2}S → S + 2H^{+} + 2e^{-}}
\]
H2Sは強い還元作用をもつにもかかわらず漂白には用いられません。これは、上式の通り、反応後に硫黄S(黄色)が遊離し、繊維が汚れてしまうからです。
❹ 重金属イオンと反応し、硫化物の沈殿を形成する
- H2Sは金属イオンと反応し、硫化物の沈殿を形成する。
- 液性により沈殿を形成する金属イオンが異なることを利用し、金属イオンの分離や分析の試薬として用いられる。
| イオン | 沈殿生成反応 |
|---|---|
| Li+ , K+ , Ca2+ , Na+ , Mg2+ , Ba2+,Al3+ | ほぼ沈殿しない |
| Mn2+ , Zn2+ , Fe2+ , Co2+ , Ni2+ | 中性・塩基性下で硫化物の沈殿が生成 |
| Cd2+ , Sn2+ , Pb2+ , Cu2+ , Hg2+ , Ag+ | 液性に関わらず硫化物の沈殿が生成 |
- アルカリ金属元素・アルカリ土類金属元素の水酸化物は全て沈殿しにくい。また、イオン化傾向がZn以下のものは中性・塩基性下の条件で沈殿を形成し、Sn以下のもの+Cdは全液性下で沈殿を形成する。
液性により沈澱の形成しやすさが異なる理由
- 硫化水素H2Sの実験室的製法では、次のような器具を用いる。
- 硫化物イオンは、水溶液中で次のような平衡状態になっている。
\[ \begin{align}
&\mathrm{H_{2}S⇄HS^{-}+H^{+}}\\
&\mathrm{HS^{-}⇄S^{2-}+H^{+}}
\end{align}\]
- 溶液が酸性の場合、周りにH+の量が豊富に存在するため、ルシャトリエの原理により、H+の量が少なくなる方向、つまり左方向に平衡が移動する。
- その結果、硫化物イオンS2ーの量も同時に減るため、沈殿ができにくい環境となり、イオン化傾向が大きく簡単には沈殿になりにくいZn2+,Fe2+,Ni2+などの金属イオンは沈殿にはならず、そのまま溶液中にイオンの状態で存在する。
- 一方、イオン化傾向が小さく沈殿になりやすいPb2+,Cu2+,Ag+などの金属イオンは、たとえ溶液が酸性でS2ーの量が少なくても積極的にこれとくっつくため、沈殿を形成しやすい。
❺ 【実験室的製法】硫化鉄(Ⅱ)FeSに塩酸HClまたは希硫酸H2SO4を加える
- H2Sは硫化鉄(Ⅱ)FeSに塩酸HClまたは希硫酸H2SO4を加えることで得られる。
\[ \begin{align}
&\mathrm{FeS + 2HCl → FeCl_{2} + H_{2}S}\\
&\mathrm{FeS+H_{2}SO_{4}→FeSO_{4}+H_{2}S}
\end{align}\]
- 弱酸を含む塩のFeSに、強酸のHCl(H2SO4)を加えることで、弱酸のH2Sが遊離している。
- この反応は弱酸遊離反応の一種である。
参考:【弱酸・弱塩基遊離反応】原理や公式、反応式の作り方など
参考:気体の製法(反応式・原理・注意事項など)
ふたまた試験管
- 硫化水素H2Sの実験室的製法では、ふたまた試験管とよばれる器具を用いることがある。
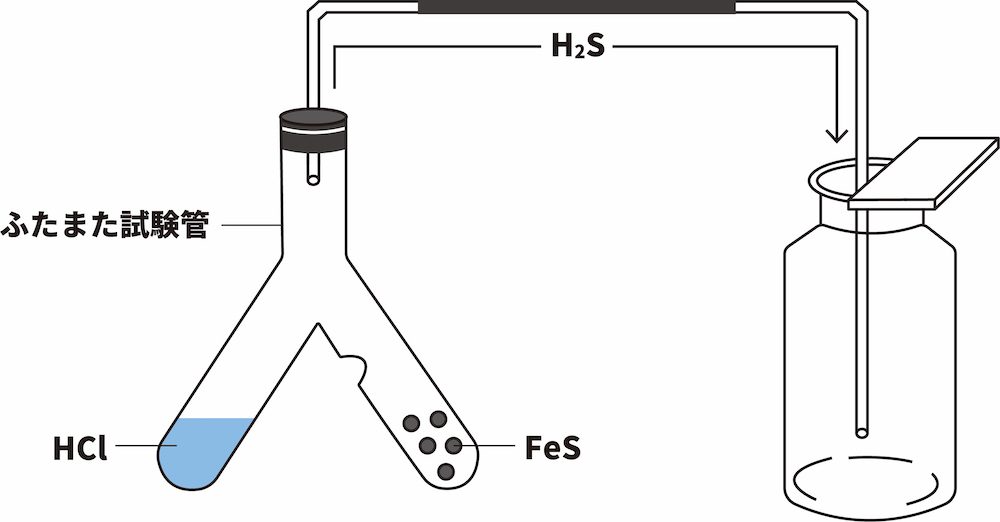
- ふたまた試験管を使う際は、突起のない方に液体の試薬を、突起のある方に固体の試薬を入れる。
- H2Sの実験室的製法では、塩酸HClが液体、硫化鉄(Ⅱ)FeSが固体のため、突起のない方にHCl、突起のある方にFeSを入れる。
- H2Sは酸性気体であり、空気より重く水に溶けやすいため、下方置換法で捕集する。
二酸化硫黄SO2
- 硫黄の酸化物を二酸化硫黄SO2という。
- SO2の特徴は、次の通りである。
● 二酸化硫黄SO2の特徴
- 無色/刺激臭/有毒
- 弱酸
- 酸化剤/還元剤の両方になる
- 【実験室的製法①】銅Cuに濃硫酸H2SO4を加えて加熱する
- 【実験室的製法②】亜硫酸ナトリウムNa2SO3に希硫酸H2SO4を加える
❶ 無色/刺激臭/有毒
- SO2は無色/刺激臭/有毒の気体である。
二酸化硫黄SO2は石炭などを燃焼したときに生じる有毒のガスです。大気汚染の原因物質の一つであり、酸化されてできる三酸化硫黄SO3は雨水に溶けて酸性雨の原因になります。
参考:酸性雨(ソックス/ノックス)
❷ 弱酸
- SO2は水に非常によく溶けて、弱酸性を示す。
\[ \begin{align}
&\mathrm{SO_{2}+H_{2}O→H_{2}SO_{3}}\\
&\mathrm{H_{2}SO_{3}→H^{+}+HSO_{3}^{-}}\\
&\mathrm{HSO_{3}^{-}→H^{+}+SO_{3}^{2-}}
\end{align}
\]
- SO2は水と反応しH2SO3となり、これが二段階で電離する。
❸ 酸化剤/還元剤の両方になる
- SO2は、酸化剤と還元剤のどちらにもなりうる。
| 酸化剤 | \[\mathrm{SO_{2} + 4H^{+} + 4e^{-} → S + 2H_{2}O}\] |
| 還元剤 | \[\mathrm{SO_{2} + 2H_{2}O → SO_{4}^{2-} + 4H^{+} + 2e^{-}}\] |
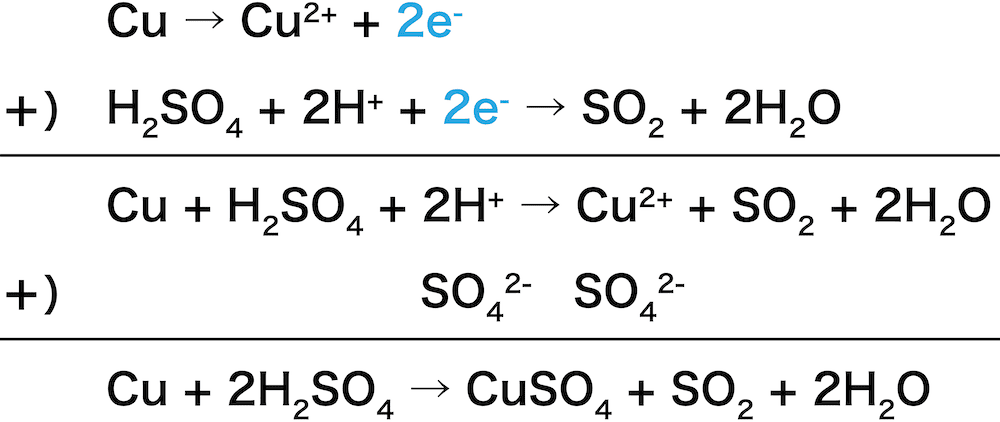
❹【実験室的製法①】銅Cuに濃硫酸H2SO4を加えて加熱する
- 銅Cuに濃硫酸H2SO4を加えて加熱することでSO2が得られる。
❺【実験室的製法②】亜硫酸ナトリウムNa2SO3に希硫酸H2SO4を加える
- SO2は亜硫酸ナトリウムNa2SO3に希硫酸H2SO4を加えることでも得られる。
\[
\mathrm{Na_{2}SO_{3}+H_{2}SO_{4}→Na_{2}SO_{4}+\underbrace{ SO_{2}+H_{2}O }_{ H_{2}SO_{3} }}
\]
- この反応は弱酸遊離反応の一種である。
参考:【弱酸・弱塩基遊離反応】原理や公式、反応式の作り方など
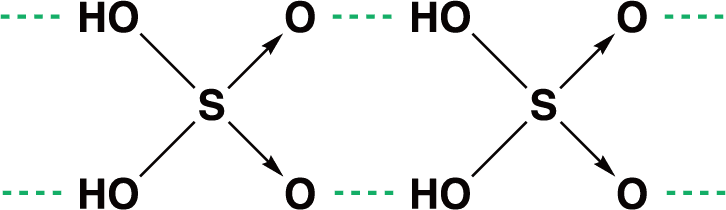
二酸化硫黄SO2の構造
- 二酸化硫黄SO2の分子は、次のような折れ線形構造をしている。

- 硫黄S原子は、 2つの酸素O原子と共有結合(二重結合)、配位結合を形成している。
- ①と②の構造は共鳴しており、平均して1.5重結合をしていると考えることができる(有機化学のベンゼンのようなかたち)。
チオ硫酸ナトリウムNa2S2O3
- 亜硫酸ナトリウムNa2SO3に硫黄を加えて加熱した溶液を冷却すると、チオ硫酸ナトリウム五水和物Na2S2O3・5H2Oが得られる。
\[
\mathrm{Na_{2}SO_{3} + S → Na_{2}S_{2}O_{3}}
\]
- Na2S2O3の特徴は、次の通りである。
● チオ硫酸ナトリウムNa2S2O3の特徴
- 無色透明
- カルキ抜きに用いる
- ヨウ素滴定の標準液として用いる
❶ 無色透明
- Na2S2O3・5H2Oの結晶は、無色透明である。
❷ カルキ抜きに用いる
- Na2S2O3は別名ハイポとよばれ、水道水から塩素Cl2を取り除く”カルキ抜き”として用いる。
\[
\mathrm{Na_{2}S_{2}O_{3}+H_{2}O+Cl_{2}→Na_{2}SO_{4}+S+2HCl}
\]
❸ ヨウ素滴定の標準液として用いる
- Na2S2O3はヨウ素滴定の標準液として用いる。
\[
\mathrm{2Na_{2}S_{2}O_{3}+I_{2}→Na_{2}S_{4}O_{6}+2NaI}
\]
参考:ヨウ素滴定(ヨードメトリー・ヨージメトリー)とは?原理から色、計算問題の解法などを解説!
カルキ抜きの原理
- カルキ抜きの全体の反応式は次の通りである。
\[ \mathrm{Na_{2}S_{2}O_{3}+H_{2}O+Cl_{2}→Na_{2}SO_{4}+S+2HCl} \]
- この反応は二段階で起こる。
第一段階
- 第一段階では、チオ硫酸ナトリウムNa2S2O3が分解し、亜硫酸ナトリウムNa2SO3を得る。
\[ \mathrm{Na_{2}S_{2}O_{3}→ Na_{2}SO_{3} + S}\]
第二段階
- 第二段階では、Na2SO3(還元剤)により、塩素Cl2(酸化剤)を還元する。
\[\begin{align}
&\mathrm{SO_{3}^{2-} + H_{2}O → SO_{4}^{2-} + 2e^{-} + 2H^{+}}\\
&\mathrm{Cl_{2} +2e^{-} → 2Cl^{-}}
\end{align}\]
硫酸H2SO4
- 硫黄を含むオキソ酸を硫酸H2SO4という。
- 高校化学では質量パーセント濃度(リンク)が約98%の濃硫酸が頻出であり、このペーでは濃硫酸の性質を中心に紹介する。
● 硫酸H2SO4の特徴
- 無色/粘性/油状
- 2価の強酸
- 酸化剤
- 溶解熱が大きい
- 吸湿性
- 不揮発性
- 脱水作用
- 【工業的製法】接触法
❶ 無色/粘性/油状
- 濃硫酸は無色で粘性が大きい油状の液体である。
- 濃硫酸の粘性の高さは水素結合(分子間力)に起因する。
参考:分子間力(水素結合・ファンデルワールス力・沸点のグラフなど)
❷ 2価の強酸
- 濃硫酸は2価の強酸である。
\[
\mathrm{H_{2}SO_{4} → 2H^{+} + SO_{4}^{2-}}
\]
❸ 酸化剤
- 濃硫酸は酸化剤としてはたらく。
\[
\mathrm{H_{2}SO_{4} + 2H^{+} + 2e^{-} → SO_{2} + 2H_{2}O}
\]
❹ 溶解熱が大きい
- 濃硫酸は溶解熱が非常に大きい。
- したがって、濃硫酸を希釈するときは、水の中に少量ずつ濃硫酸を加えていく必要がある。
参考:【一覧】反応熱(燃焼熱・融解熱・解離エネルギーなど)総まとめ
❺ 吸湿性
- 濃硫酸は吸湿性が高く、乾燥剤として用いられる。
参考:【乾燥剤】酸性・中性・塩基性の乾燥剤一覧や分類・仕組みなど
❻ 不揮発性
- 濃硫酸は非常に沸点が高く、不揮発性(蒸発しにくい)である。
- したがって、揮発性酸遊離反応などに用いる。
❼ 脱水作用
- 濃硫酸は脱水作用をもつ。
- 次の反応は、エタノールの脱水によるエチレンの生成反応である。
\[
\mathrm{C_{2}H_{5}OH → C_{2}H_{4} + H_{2}O}
\]
参考:アルコール・エーテル(一覧・違い・命名法・製法・反応・性質など)
❽【工業的製法】接触法
- 硫酸の工業的製法を接触法という。
- 接触法については次のページを参照のこと。
参考:接触法(濃硫酸の工業的製法・仕組み・反応式・触媒など)
濃硫酸の希釈方法
- 濃硫酸を希釈するときは、大量の水の中に、少量ずつ濃硫酸を加える。
- これは濃硫酸に水を加えると、(濃硫酸の溶解熱が非常に大きいため、)加えた水が急激に沸騰し、濃硫酸が周囲に飛び散る可能性があるためである。














