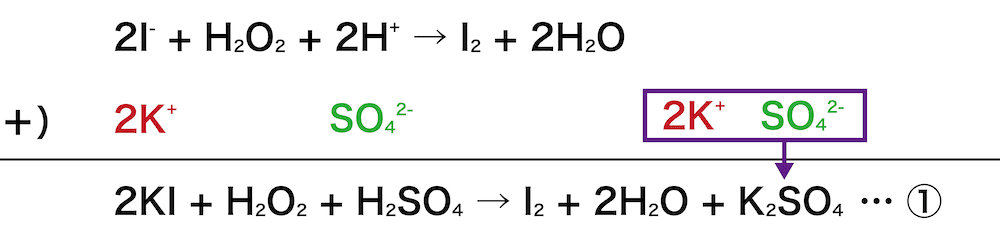MENU
ヨウ素滴定(ヨードメトリー・ヨージメトリー)とは?原理から色、計算問題の解法などを解説!
はじめに
【プロ講師解説】このページでは『ヨウ素滴定(ヨードメトリー・ヨージメトリー)とは?原理から色、計算問題の解法などを解説!』について解説しています。
ヨウ素滴定とは
- 酸化剤であるヨウ素I2や、還元剤であるヨウ化物イオンIーを使った酸化還元滴定をヨウ素滴定という。
- ヨウ素滴定にはヨードメトリー(ヨウ素還元滴定)とヨージメトリー(ヨウ素酸化滴定)の2種類が存在する。
ヨードメトリー
- 還元剤として作用するヨウ化物イオンIーに対して、酸化剤を作用させるとヨウ素I2が遊離する。
\[ \mathrm{2I^{-}→I_{2}+2e^{-} }\]
- このときI2を、デンプンを指示薬として用い、還元剤であるチオ硫酸ナトリウムNa2S2O3の標準溶液で測定すると、濃度不明の酸化剤を間接的に定量することができる。この方法をヨードメトリー(ヨウ素還元滴定)という。
ヨードメトリーの原理
- ここに、還元剤であるヨウ化カリウムKIが入った容器がある。

- この容器に、濃度未知の酸化剤である過酸化水素H2O2を加える。
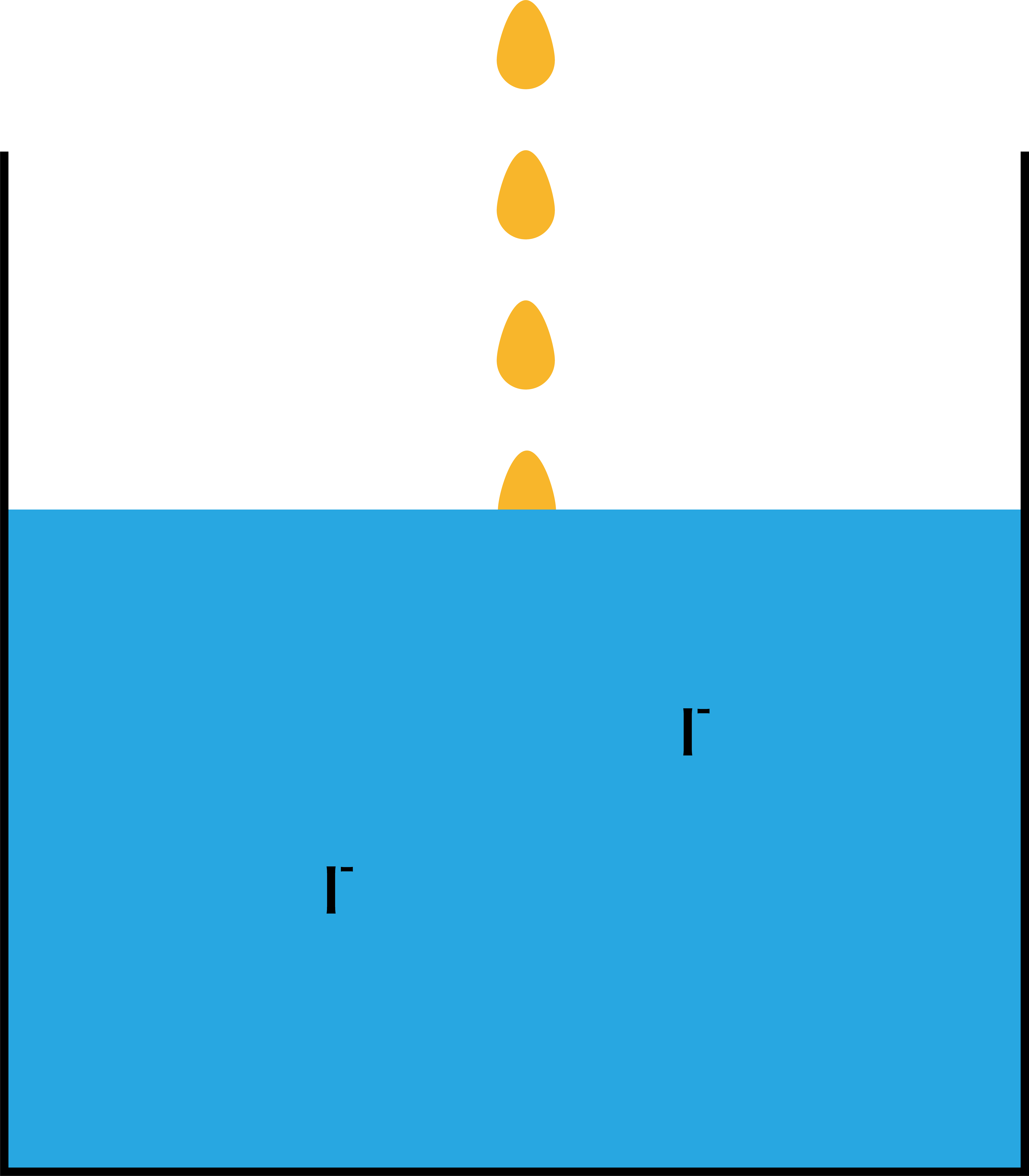
- すると、酸化還元反応が起き、H2O2と反応したIーが酸化されてI2となる。

- ここに指示薬としてデンプンを加える。デンプンはI2と反応して青紫色となる(ヨウ素デンプン反応)ため、この時点で容器内は青紫色となる。

- 最後に、還元剤であるチオ硫酸ナトリウムNa2S2O3水溶液を加えていく。
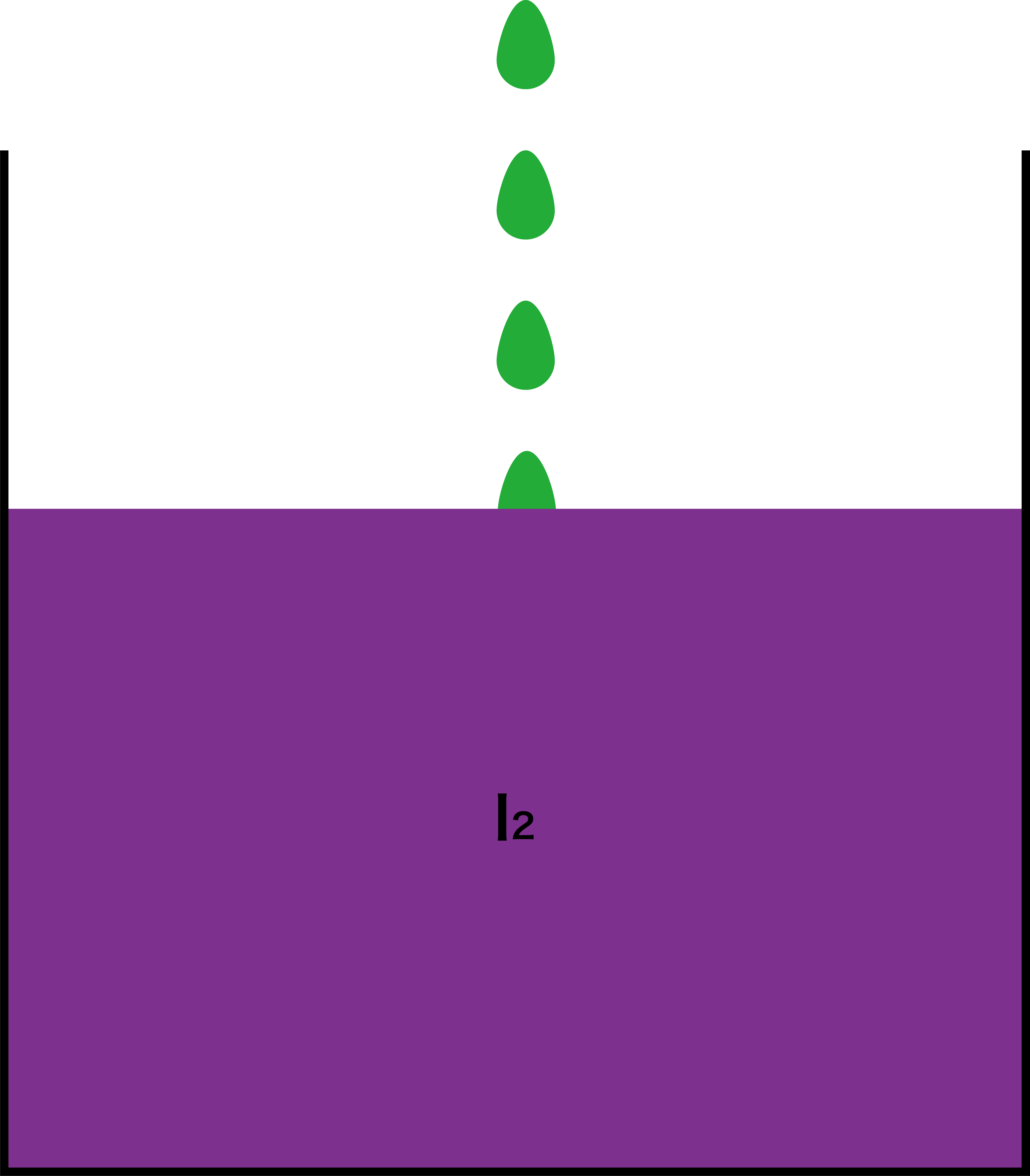
- I2が還元されて再びIーとなる。

- I2が無くなったため、溶液の青紫色は消える。
- 以上がヨードメトリーの流れである。ヨードメトリーでは、滴下したチオ硫酸ナトリウムNa2S2O3水溶液の量を使って、濃度未知の酸化剤(過酸化水素H2O2等)の濃度を求める。
- それでは、ヨードメトリーに関連した計算問題の解き方を解説する。
ヨードメトリーの計算問題の解き方
- 例題を用いて、ヨードメトリーに関連した計算問題の解き方について解説する。
硫酸酸性の1.0(mol/L)のヨウ化カリウムKI500(ml)に、濃度不明の過酸化水素H2O2200(ml)を加える。これに、指示薬としてデンプンを加えた後、1.0(mol/L)のチオ硫酸ナトリウムNa2S2O3水溶液で滴定していった。すると、100(ml)加えたとき青紫色が消え、無色となった。このときのH2O2の濃度を求めよ。
●STEP1
ヨウ化カリウムKIと酸化剤(濃度未知)の半反応式から1つの反応式をつくる。
●STEP2
ヨウ素I2とチオ硫酸ナトリウムNa2S2O3の半反応式から、1つの反応式をつくる。
●STEP3
STEP1とSTEP2で作成した式の係数比を利用し、一気に解く。
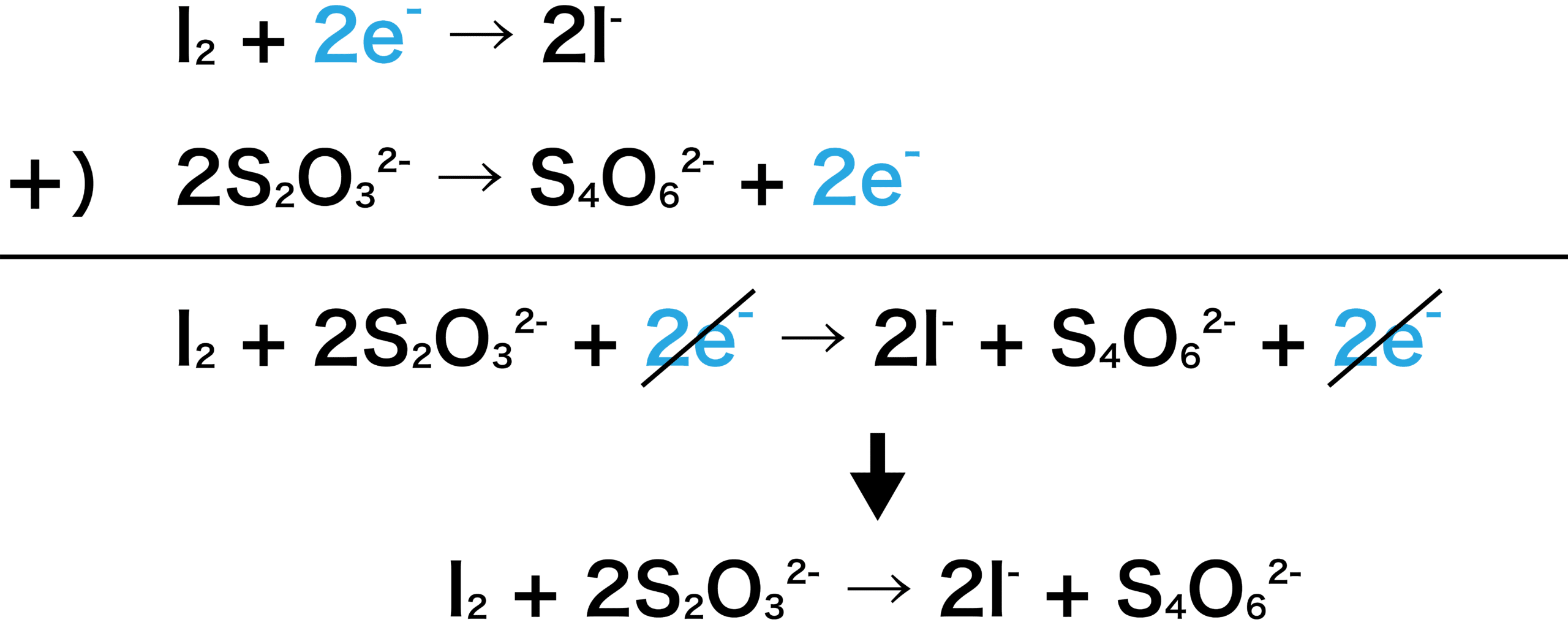
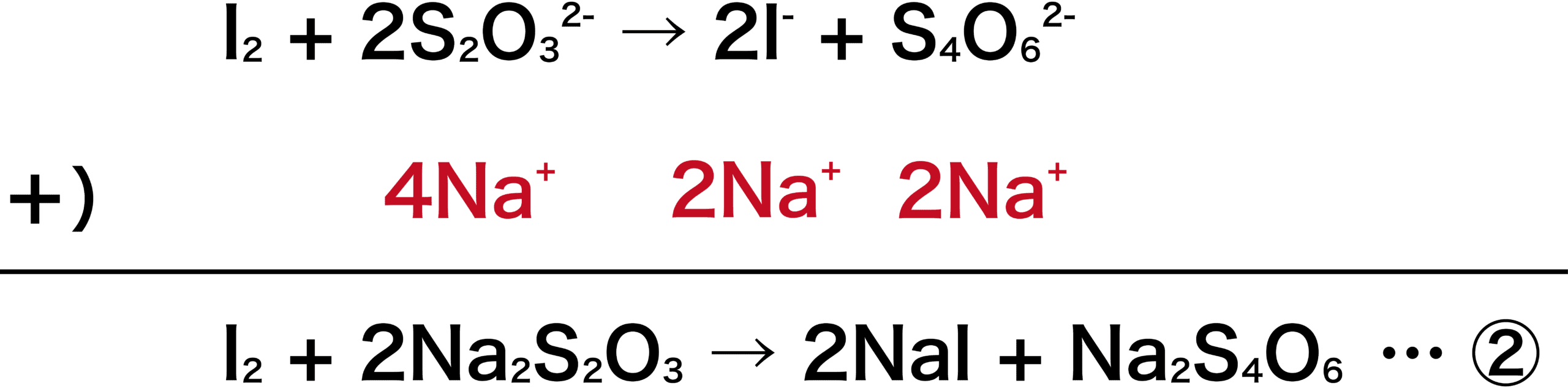
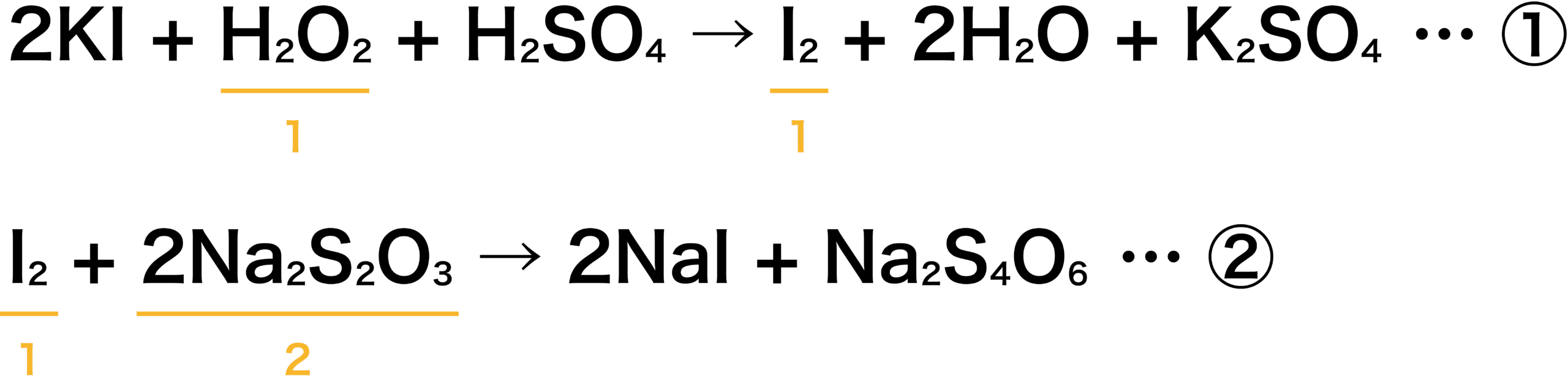
①式よりH2O2とI2は1:1で反応する。また、②式よりI2とNa2S2O3は1:2で反応する。
よって、H2O2とNa2S2O3は1:2の関係になっている。
ここで、問題文で与えられている数値を用いると、Na2S2O3のmolは次のように求めることができる。
\[ \begin{align} \mathrm{Na_{2}S_{2}O_{3} }&=\mathrm{ 1.0(mol/L)×\frac{ 100 }{ 1000 }(L)} \\
&\mathrm{=0.10(mol) }\end{align} \]
したがって、
\[ \begin{align}
&\mathrm{H_{2}O_{2}:Na_{2}S_{2}O_{3}=1:2} \\
&↔︎ x:0.10=1:2 \\
&↔︎ x=0.050(\mathrm{mol})
\end{align}\]
問題文より、H2O2は200(mL)あるため、モル濃度は…
\[ \begin{align} &\mathrm{\frac{ 0.050(mol) }{ \frac{ 200 }{ 1000 }(L) }}\\
\\
&=0.25(\mathrm{mol/L}) \end{align} \]
ヨージメトリー
- 温和な酸化剤であるヨウ素I2の酸化力を利用して、濃度未知の還元剤を直接滴定する方法をヨージメトリー(ヨウ素酸化滴定)という。
- 以降、ヨージメトリーの原理(流れ)・ヨージメトリー絡みの計算問題の解法を図付きで解説していく。
ヨージメトリーの原理
- ここに、酸化剤であるヨウ素I2が入った容器があるとする。

- この容器に、還元剤である硫化水素H2Sを吸収させる。
- H2Sにより還元されたI2はIーとなる。

- 全てのI2がIーとなるわけではないので、溶液内にはI2とIーが混在している。
- ここに、指示薬としてデンプンを加える。デンプンはI2と反応して青紫色になる(ヨウ素デンプン反応)ため、この時点で容器内は青紫色となる。

- 最後に、還元剤であるチオ硫酸ナトリウムNa2S2O3を加えていく。

- 残っていたI2がNa2S2O3により還元され、Iーとなる。

- I2が無くなったので、溶液の青紫色は消える。
- 以上がヨージメトリーの実験の流れである。ヨージメトリーでは、滴下したチオ硫酸ナトリウムNa2S2O3水溶液の量を使って、濃度未知の還元剤(硫化水素H2S等)の濃度を求めていく。
ヨージメトリーの計算問題の解き方
- 例題を用いて、ヨージメトリーに関連した計算問題の解き方について解説する。
1.0(mol/L)のヨウ素液500(ml)に、硫化水素H2S をゆっくりと通して完全に吸収させた。ここにデンプンを加えた後、2.0(mol/L)のチオ硫酸ナトリウムNa2S2O3水溶液をたらして滴定した。すると、200(ml)加えたところで溶液が青紫色から無色へと変化した。吸収させたH2Sの物質量(mol)を求めよ。
●STEP1
各物質について半反応式を書く。
●STEP2
係数に注意しながら線分図を使って解く。
まずは、各物質の半反応式を書く。
今回使われているのは、I2とH2SとNa2S2O3の3つなので、それらの半反応式を書いていく。
\[ \begin{align}&\mathrm{I_{2} + 2e^{-} → 2I^{-} }\\
&\mathrm{H_{2}S → S + 2H^{+} + 2e^{-} }\\
&\mathrm{2S_{2}O_{3}^{2-} → S_{4}O_{6}^{2-} + 2e^{-}} \end{align}\]
今回の問題では、I2という1つの酸化剤をH2S、Na2S2O3という2つの還元剤と反応させている。
それぞれの物質の情報を線分図にすると次のようになる。
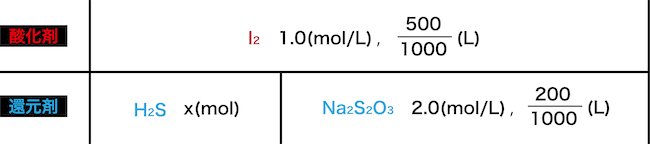
酸化剤の放出するeーの合計と還元剤の放出するeーの合計の(mol)が等しいことから次のような式をつくる。

これを解いて…
\[ x=\mathrm{0.30(mol)} \]
※この式について詳しくは酸化還元滴定(実験・計算問題・指示薬・硫酸酸性にする理由など)を参照