MENU
半反応式・酸化還元反応式(作り方・覚え方・問題演習など)
はじめに
【プロ講師解説】このページでは『半反応式・酸化還元反応式(作り方・覚え方・問題演習など)』について解説しています。
半反応式・酸化還元反応式とは
- フッ素F2と硫化水素H2Sの酸化還元反応は、次の式で表すことができる。
\[ \mathrm{F_{2} + H_{2}S → S + 2HF} \]
- この反応において、H2SはF2にHを与えて還元させているので還元剤、反対にF2はH2SからHを奪い取って酸化させているので酸化剤である。
- このように、酸化剤と還元剤を用いて酸化還元反応を表した式を酸化還元反応式という。
- 酸化還元反応式は、酸化剤に関する(仮の)反応式と、還元剤に関する(仮の)反応式を組み合わせることによってつくられる。
| 酸化剤 | F2 + 2eー → 2Fー |
| 還元剤 | H2S → S + 2H+ + 2eー |
- この酸化還元反応式をつくる際に必要な酸化剤・還元剤に関する仮の反応式を半反応式という。
半反応式の作り方
- 半反応式は次の5STEPで作成する。
●STEP1
酸化剤(還元剤)が「何から何になるのか」を書く。
●STEP2
両辺について、OとH以外の原子の数を合わせる。
●STEP3
両辺について、O原子の数をH2Oを用いて合わせる。
●STEP4
両辺について、H原子の数をH+を用いて合わせる。
●STEP5
両辺について、電荷をeーを用いて合わせる。
二クロム酸カリウム
まずは、酸化剤(還元剤)が「何から何になるのか」を書く。
\[ \mathrm{Cr_{2}O_{7}^{ \,2-} → Cr^{3+}} \]
ここは、暗記しておかなければいけない箇所である。まだ覚えていない場合は次のページを参照のこと。
参考:半反応式一覧
次に、両辺について、OとH以外の原子の数を合わせる。
\[ \mathrm{Cr_{2}O_{7}^{ \,2-} → 2Cr^{3+}} \]
次に、両辺について、O原子の数をH2Oを用いて合わせる。
\[ \mathrm{Cr_{2}O_{7}^{ \,2-} → 2Cr^{3+} + 7H_{2}O} \]
次に、両辺について、H原子の数をH+を用いて合わせる。
\[ \mathrm{Cr_{2}O_{7}^{ \,2-} + 14H^{+} → 2Cr^{3+} + 7H_{2}O} \]
最後に、両辺について、電荷をeーを用いて合わせる。
\[ \mathrm{Cr_{2}O_{7}^{ \,2-} + 14H^{+} + 6e^{-} → 2Cr^{3+} + 7H_{2}O} \]
シュウ酸ナトリウム
まずは、酸化剤(還元剤)が「何から何になるのか」を書く。
\[ \mathrm{C_{2}O_{4}^{ \,2-} → CO_{2} }\]
ここは、暗記しておかなければいけない箇所である。まだ覚えていない場合は次のページを参照のこと。
参考:半反応式一覧
次に、両辺について、OとH以外の原子の数を合わせる。
\[ \mathrm{C_{2}O_{4}^{ \,2-} → 2CO_{2}} \]
両辺について、O原子の数をH2Oを用いて合わせる。
\[ \mathrm{C_{2}O_{4}^{ \,2-} → 2CO_{2}} \]
今回は、既に両辺のO原子の数が揃っているので特に何もしなくてOK。
次に、両辺について、H原子の数をH+を用いて合わせる。
\[ \mathrm{C_{2}O_{4}^{ \,2-} → 2CO_{2} }\]
今回は、反応式中にH原子が存在しないので何もしなくてOK。
最後に、両辺について、電荷をeーを用いて合わせる。
\[ \mathrm{C_{2}O_{4}^{ \,2-} → 2CO_{2} + 2e^{-}} \]
酸化還元反応式の作り方
- 酸化還元反応式の作り方は次の通りである。
●STEP1
2つの半反応式の電子(eー)の数が揃うように調節する。
●STEP2
2つの式を足し合わせる。
●STEP3
反応物であるイオンの対となるイオンを加えて、式からイオンを消す。(イオン式から通常の反応式へ)
硫酸酸性の二クロム酸カリウム水溶液にシュウ酸ナトリウム水溶液を加えたときの反応式を書け。
今回は、シュウ酸ナトリウムの式に3をかけると2つの式の電子の数が揃う。
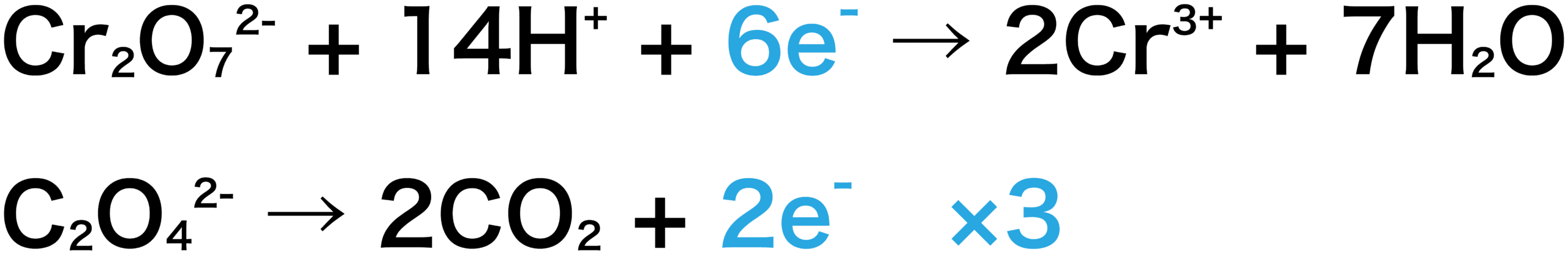
次に、2つの式を足し合わせよう。両辺にある6eーは打ち消される。
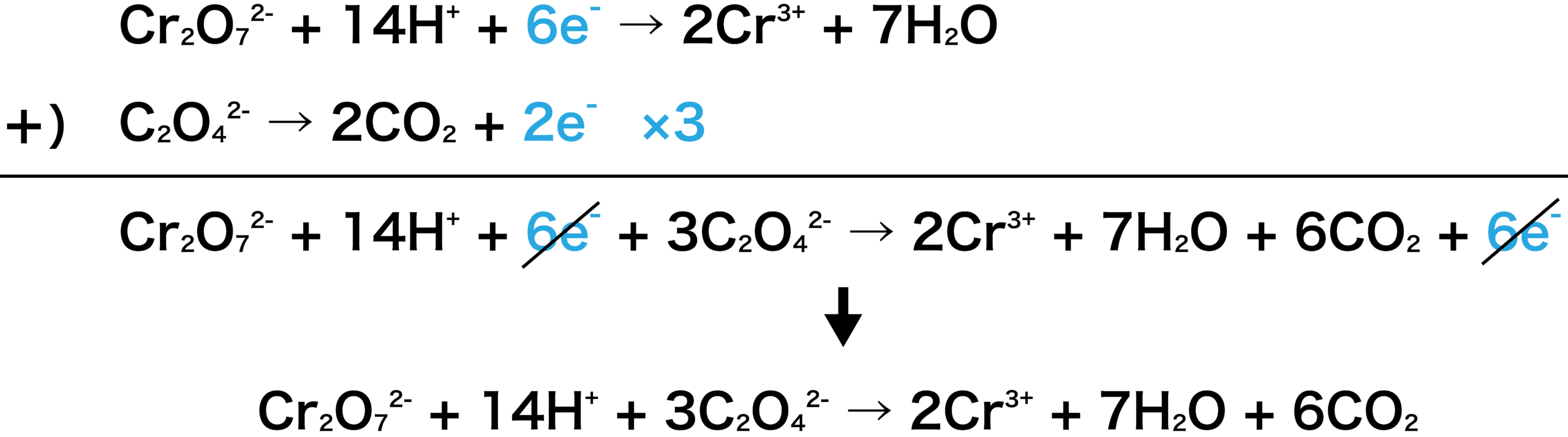
この反応は、二クロム酸カリウム水溶液とシュウ酸ナトリウム水溶液の反応なので、この2つが左側(スタートの物質=反応物)にいなければならない。
したがって、左辺に2K+と6Na+を加える。(2K+はCr2O72ーとくっついてK2Cr2O7に、6Na+は3C2O42ーとくっついて3Na2C2O4になる。)
しかし、勝手に左に加えて終わりにしてしまったら式は成り立たなくなってしまう。そこで、右辺にも2K+と6Na+を加える。その結果以下のようになる。
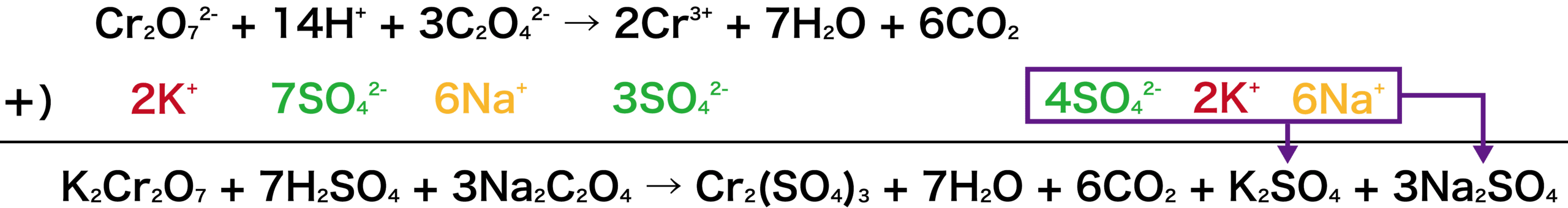
※今回は硫酸酸性の水溶液なので、H+の出所はH2SO4となる。したがって、式中のH+にはSO42ーをくっつける。紫で囲んだところはまとめてK2SO4と3Na2SO4にする。














