MENU
共有結合(例・イオン結合や配位結合との違いなど)
目次
はじめに
【プロ講師解説】このページでは『共有結合(例・イオン結合や配位結合との違いなど)』について解説しています。
共有結合とは
- 非金属元素と非金属元素の間に形成される結合を共有結合という。
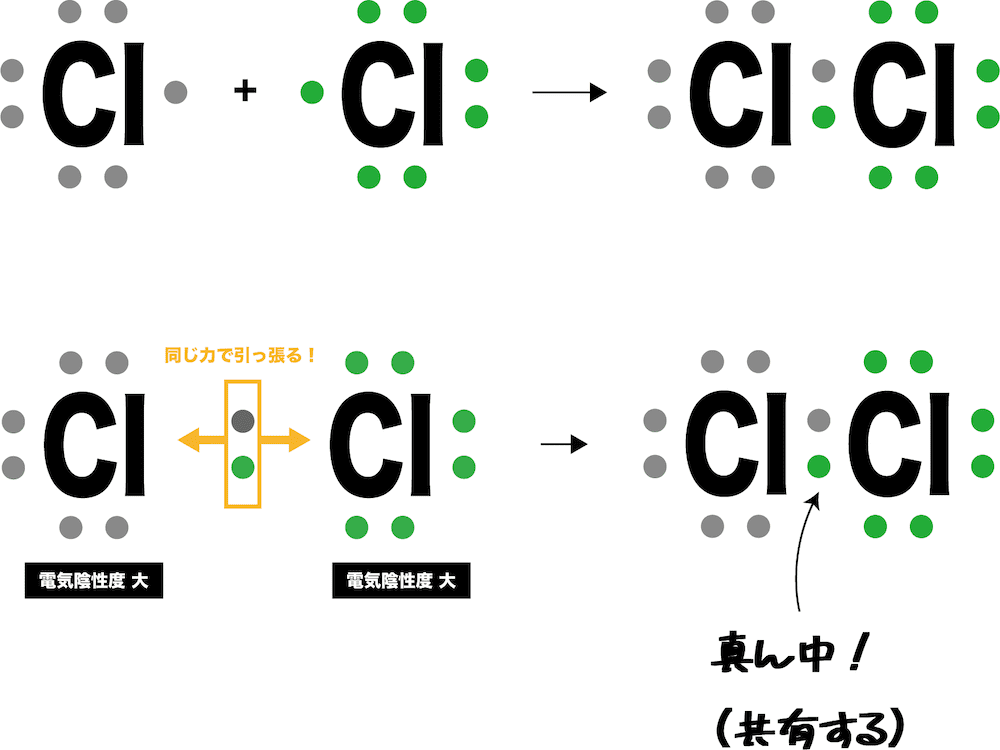
- どんな結合も不対電子の共有で始まる。この例の場合、Cl原子同士が同じ力で引っ張り合うため、電子対がどちらかに偏ることはない。
- また、Cl原子は非金属元素で電気陰性度が大きく、互いに電子対を譲らない。したがって、電子対は2つのCl原子間で共有することになる。
- その結果、2つのCl原子はともに最外殻がオクテットになり、安定する。
- ちなみに、電気陰性度の大きい原子同士がどちらも電子対を譲らないため、共有結合は非常に強い結合である。
共有結合結晶
- 非金属元素の原子同士が共有結合して結晶になるまでの過程には2パターンある。
パターン1(分子結晶)
- まず、上で共有結合の例として取り上げたCl原子同士は、共有結合により原子がともにオクテットになるため、これ以上結合する必要がない。よって、ここで共有結合は終了し、Cl2という小さな集まりとなる。
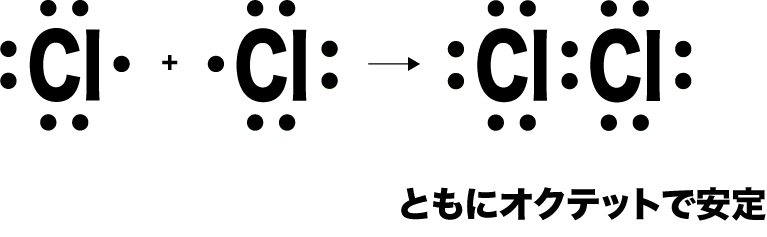
- このように、いくつかの原子が共有結合してできる小さな集まりを分子という。この分子が集まって分子結晶をつくる。
参考:分子結晶(例・特徴・融点・電気伝導性・柔らかい理由など)
パターン2(共有結合結晶)
- 炭素C原子同士の結合を考える。C原子は価電子を4個もっているため、2個のC原子が共有結合しただけではオクテットになることができない。共有結合を繰り返して巨大な分子を形成する。
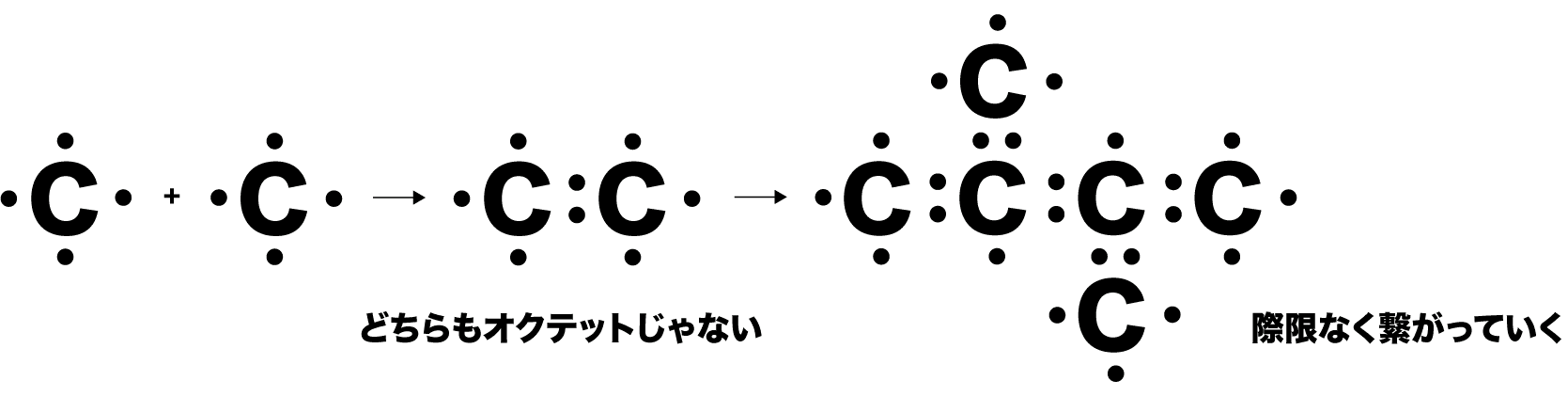
- このように多数の共有結合のみでできている結晶を共有結合結晶という。
- 入試でよく出る共有結合結晶はダイヤモンドC・黒鉛C・ケイ素Si・二酸化ケイ素SiO2・炭化ケイ素SiCの5種類なので覚えておこう。
共有結合結晶の特徴
- 共有結合は非常に強い結合のため、この結合からできている共有結合結晶は次のような性質をもつ。
●共有結合結晶の特徴
- 電気伝導性がない ※黒鉛は例外
- 融点が高い
- 非常に硬い
- 水に溶けにくい
分子と共有結合
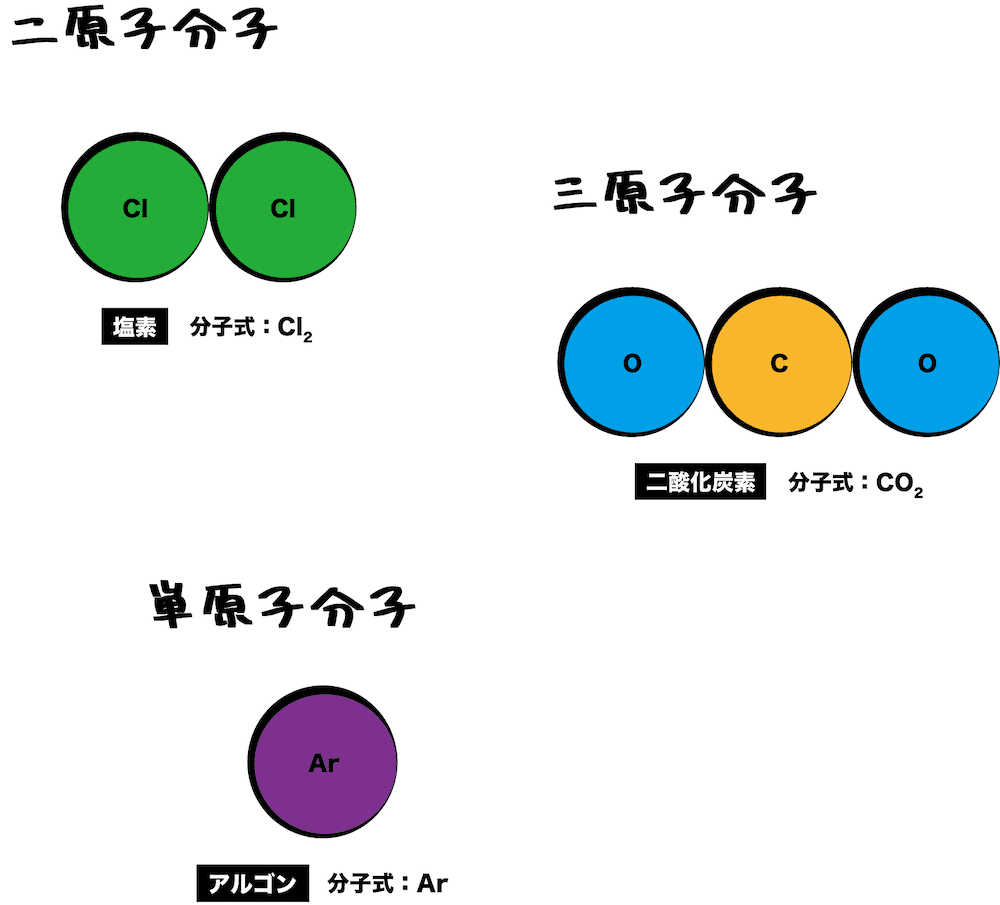
- 共有結合によってできる小さい集まりを分子という。
- 分子のうち、塩素Cl2のように2個の原子からなる分子を二原子分子、二酸化炭素CO2のように3個以上の原子からなる分子を多原子分子という。希ガスは安定した電子配置をもち他の原子と結合しないため1つの原子のままで分子として扱い、これを単原子分子という。
- 分子を構成する原子の数と種類を表した式を分子式という。
分子の構造式
- 塩素Cl2のように共有電子対1組による共有結合を単結合、酸素O2のように共有電子対2組による共有結合を二重結合、窒素N2のように共有電子対3組による共有結合を三重結合という。
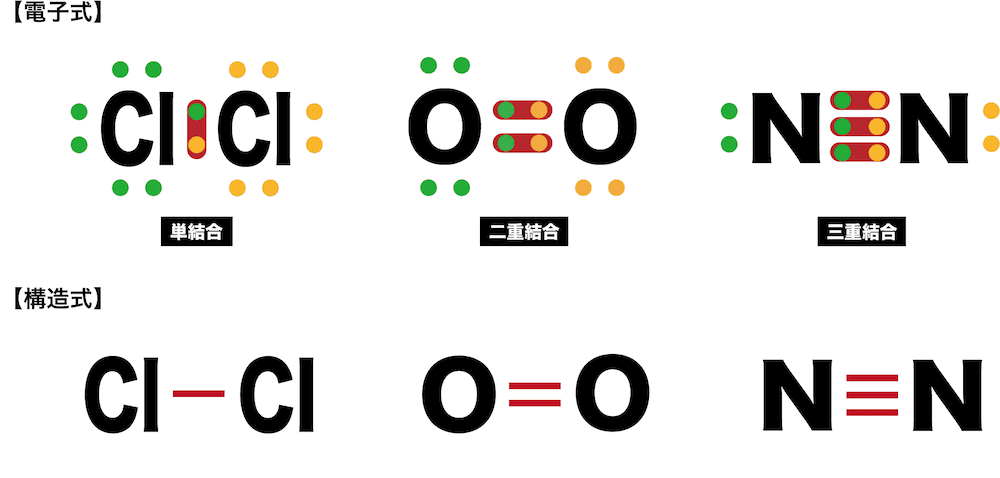
- 分子の共有電子対1組を1本の線で表したものを価標、価標を用いて分子を表した式を構造式という。
- 1個の原子から出る価標の数は、その原子の不対電子の数(原子価)と一致する。例えば、酸素O原子の場合、不対電子が2個なので原子価は2となる。
共有結合まとめ
この『共有結合(例・イオン結合や配位結合)』のページで解説した内容をまとめる。
- 非金属元素と非金属元素の間に形成される結合を共有結合という。
- 多数の共有結合からできている結晶を共有結合結晶という。
- 入試頻出の共有結合結晶は、ダイヤモンドC・黒鉛C・ケイ素Si・二酸化ケイ素SiO2・炭化ケイ素SiCの5つである。
- 共有結合結晶には次のような特徴がある。
❶ 電気伝導性がない ※黒鉛は例外
❷ 融点が高い
❸ 非常に硬い
❹ 水に溶けにくい - 配位結合は共有結合の仲間である。
- 共有結合によってできる小さい集まりを分子という。
- 分子のうち、塩素Cl2のように2個の原子からなる分子を二原子分子、二酸化炭素CO2のように3個以上の原子からなる分子を多原子分子という。希ガスは安定した電子配置をもち他の原子と結合しないため1つの原子のままで分子として扱い、これを単原子分子という。
- 分子を構成する原子の数と種類を表した式を分子式という。
- 塩素Cl2のように共有電子対1組による共有結合を単結合、酸素O2のように共有電子対2組による共有結合を二重結合、窒素N2のように共有電子対3組による共有結合を三重結合という。
- 分子の共有電子対1組を1本の線で表したものを価標、価標を用いて分子を表した式を構造式という。
- 1個の原子から出る価標の数は、その原子の不対電子の数(原子価)と一致する。例えば、酸素O原子の場合、不対電子が2個なので原子価は2となる。
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
問1
非金属元素同士が不対電子を出し合い共有電子対をつくることでできる結合を【1】という。
解答/解説:タップで表示
問2
不対電子を1個ずつ出し合いできる共有結合を【1】という。
解答/解説:タップで表示
問3
不対電子を2個ずつ出し合いできる共有結合を【1】という。
解答/解説:タップで表示
問4
不対電子を3個ずつ出し合いできる共有結合 を【1】という。
解答/解説:タップで表示
問5
共有結合では、各原子の電子配置が【1】の電子配置と同じになる。
解答/解説:タップで表示
問6
構造式中の共有結合は”線”を使って表すことができ、この線を【1】という。
解答/解説:タップで表示
問7
元素の価標の数を【1】という。














