MENU
配位結合(例・強さ・共有結合との違い・錯イオンとの関係など)
目次
はじめに
【プロ講師解説】このページでは『配位結合(例・強さ・共有結合との違い・錯イオンとの関係など)』について解説しています。
共有結合とは
- 非金属元素と非金属元素の間に形成される結合を共有結合という。
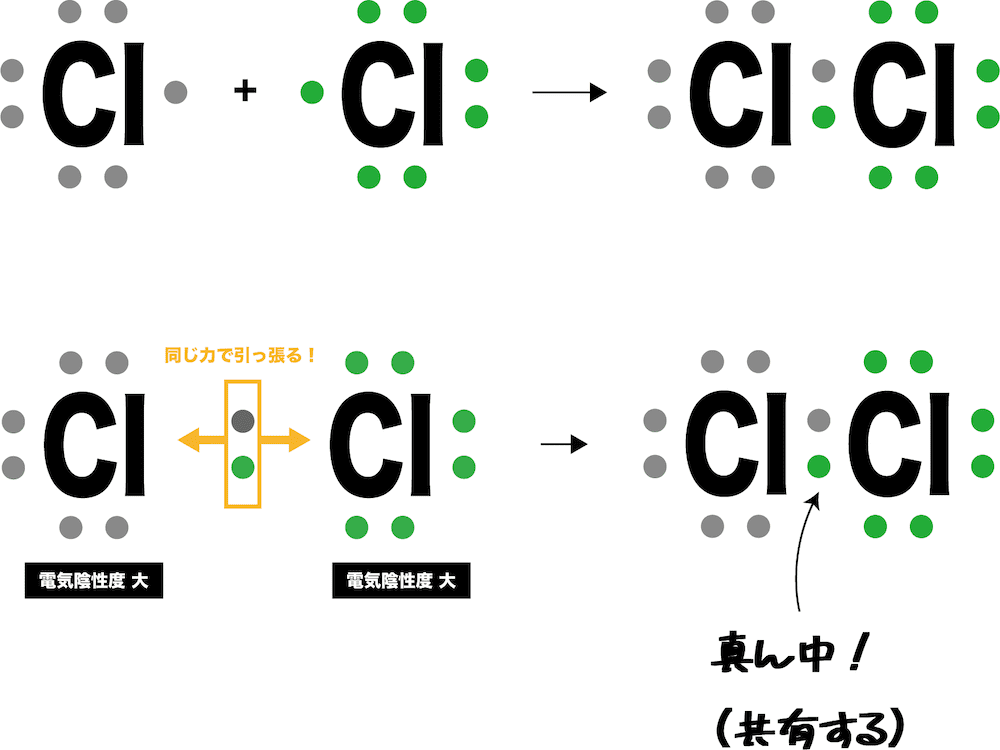
- どんな結合も不対電子の共有で始まる。この例の場合、Cl原子同士が同じ力で引っ張り合うため、電子対がどちらかに偏ることはない。
- また、Cl原子は非金属元素で電気陰性度が大きく、互いに電子対を譲らない。したがって、電子対は2つのCl原子間で共有することになる。
- その結果、2つのCl原子はともに最外殻がオクテットになり、安定する。
- ちなみに、電気陰性度の大きい原子同士がどちらも電子対を譲らないため、共有結合は非常に強い結合である。
配位結合とは
- 一方が非共有電子対を提供し、それを共有することで生じる結合を配位結合という。
- 例えば、アンモニウムイオンNH4+では、窒素N原子の非共有電子対を水素イオンH+に一方的に供与することで結合が形成されている。
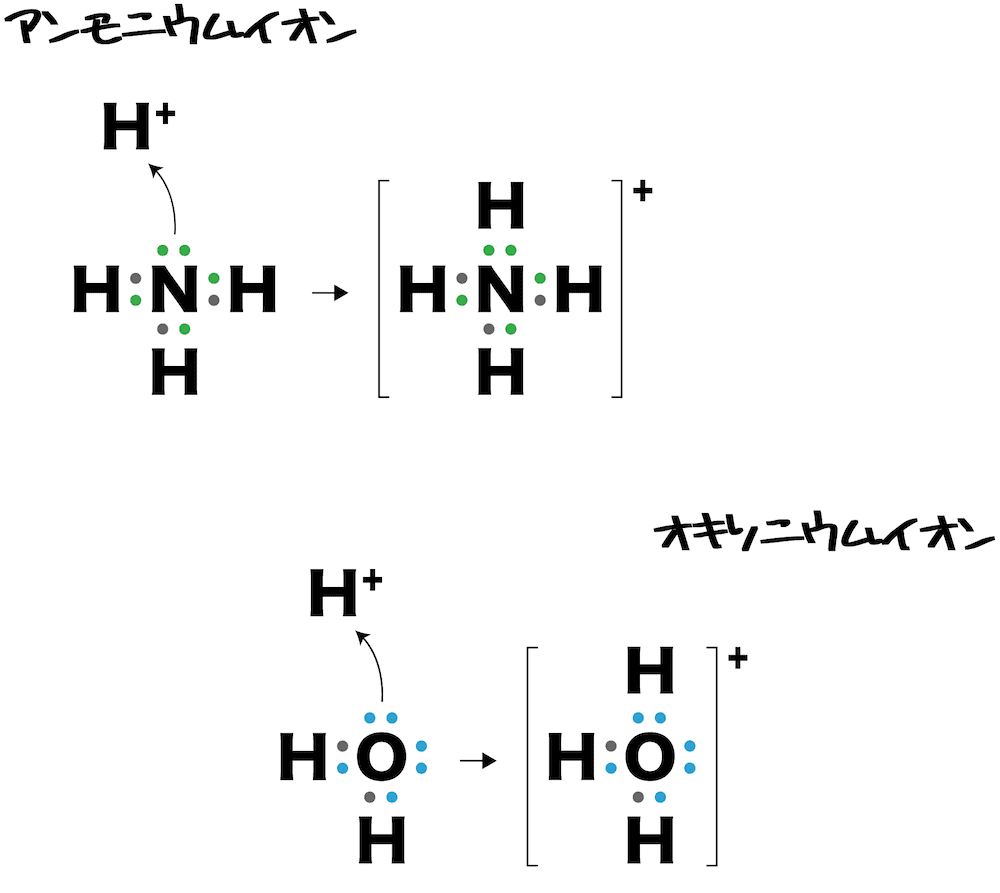
- アンモニウムイオン及びオキソニウムイオンでは「プラマイ0」の分子と「プラス」のイオンが結合するため全体としては「プラス」の電荷をもつ。
- 配位結合は一度できてしまえば共有結合と見分けがつかない。
配位結合の表記法
- 配位結合は共有結合と見分けがつかないため、共有結合のように価標とよばれる線を使って表すことができる。
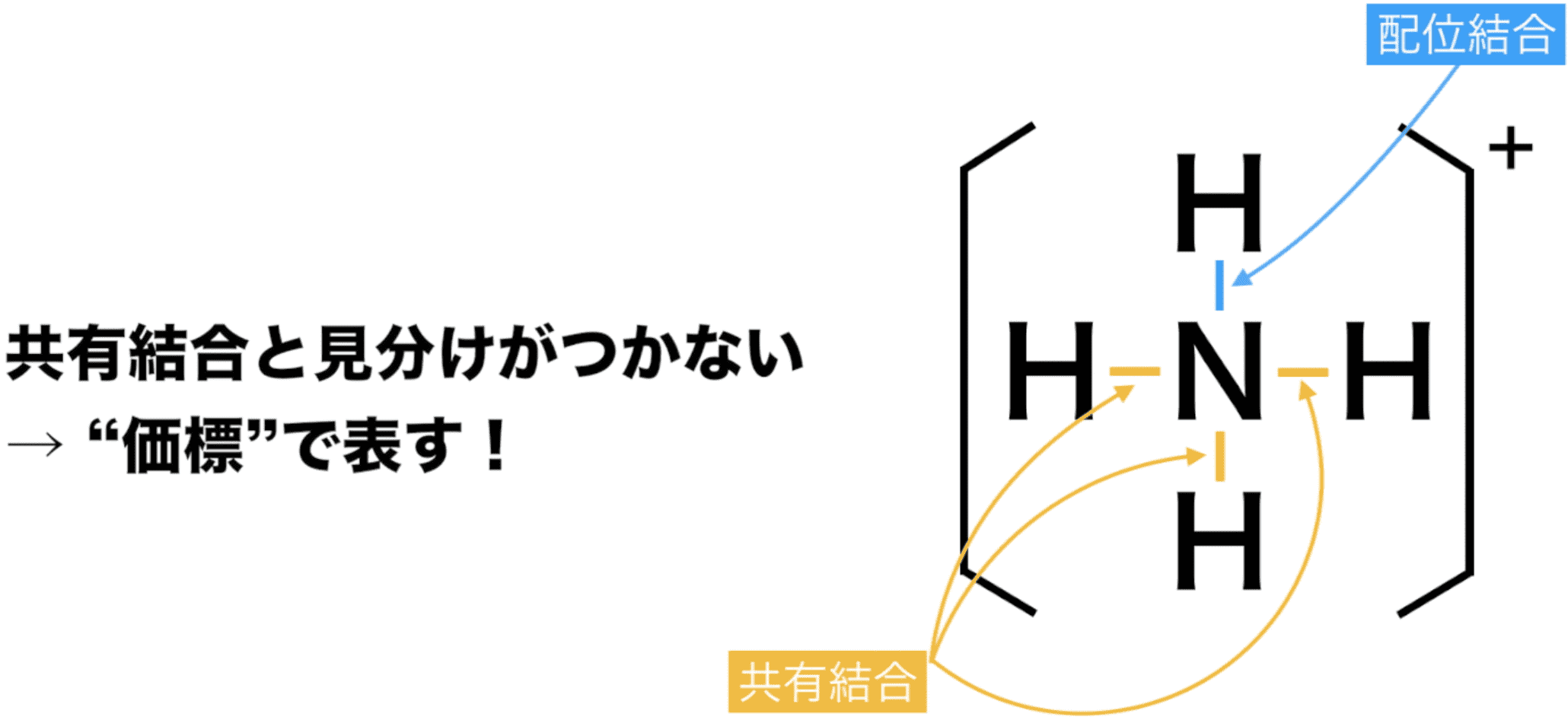
- 配位結合を共有結合と区別して(電子対を一方的に供与していることを示す)矢印で表すこともある。

配位結合とオキソ酸の関係
- 酸素O原子を含む酸をオキソ酸という。
- 硫酸・硝酸・リン酸・塩素酸など高校化学で頻出のオキソ酸の多くは、配位結合により形成されている。
- 代表的なオキソ酸とその構造を一覧で示す。(オキソ酸中の配位結合は矢印で表記)
| 化合物 | 化学式 | 構造 |
|---|---|---|
| 硫酸 | H2SO4 | 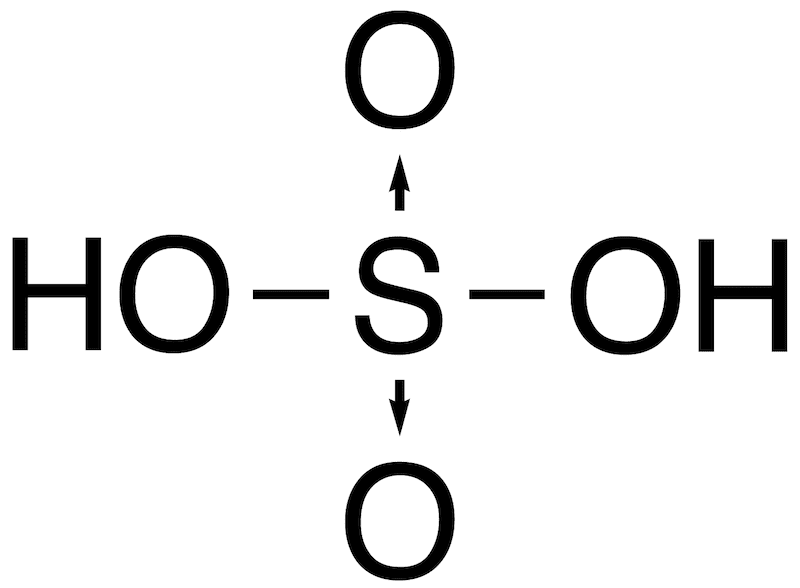 |
| 硝酸 | HNO3 | 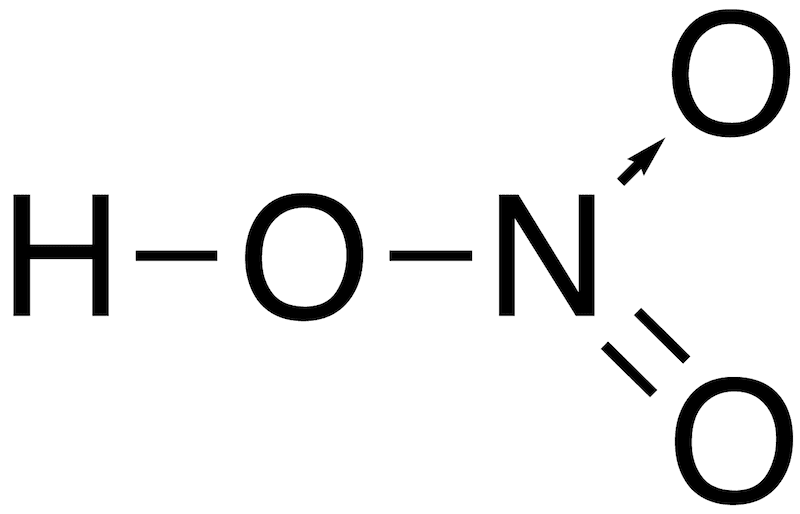 |
| リン酸 | H3PO4 | 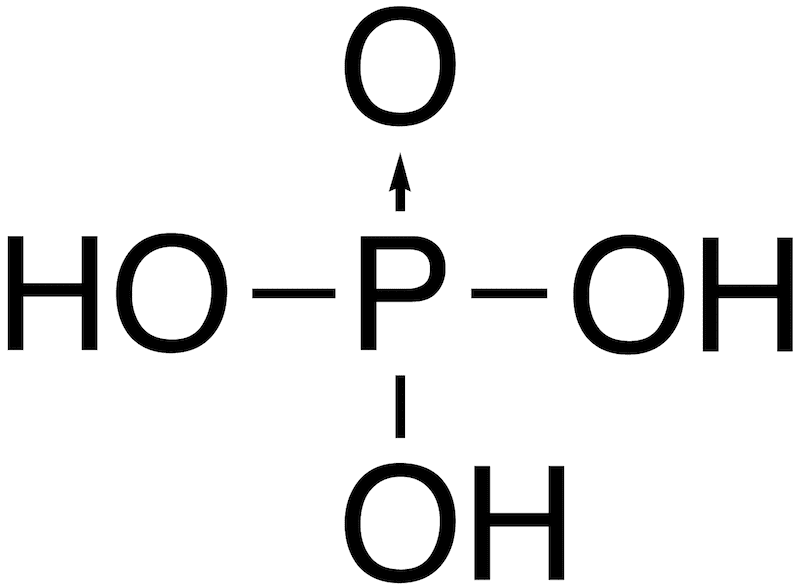 |
| 塩素酸 | HClO3 | 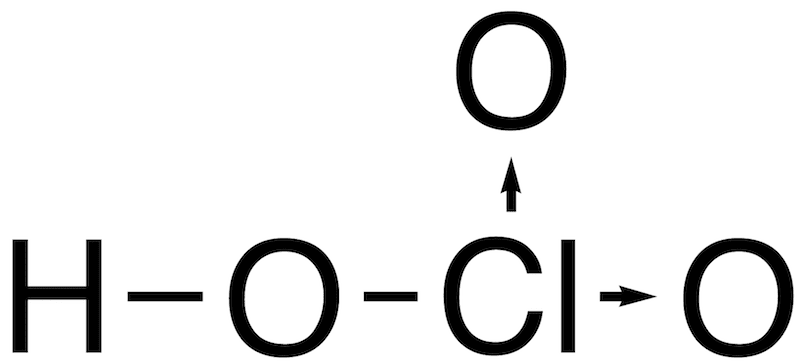 |
配位結合まとめ
この『配位結合(例・強さ・共有結合との違い・錯イオンとの関係など)』のページで解説した内容をまとめる。
- 非金属元素と非金属元素の間に形成される結合を共有結合という。
- 一方が非共有電子対を提供し、それを共有することで生じる結合を配位結合という。
- 配位結合は一度できてしまえば共有結合と見分けがつかない。
- 配位結合は共有結合と見分けがつかないため、共有結合のように価標とよばれる線を使って表すことができる。
- 配位結合を共有結合と区別して(電子対を一方的に供与していることを示す)矢印で表すこともある。
- 金属の陽イオンに分子や陰イオンが配位結合することによってできるイオンを錯イオンという。
- 酸素O原子を含む酸をオキソ酸という。硫酸・硝酸・リン酸・塩素酸など高校化学で頻出のオキソ酸の多くは、配位結合により形成されている。
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
問1
一方の原子(分子)が非共有電子対を提供し、それを共有することで生じる結合を【1】という。
解答/解説:タップで表示
解答:【1】配位結合
一方の原子(分子)が非共有電子対を提供し、それを共有することで生じる結合を配位結合という。
問2
配位結合は一度できると【1】と見分けがつかない。
解答/解説:タップで表示
解答:【1】共有結合
配位結合は一度できると共有結合と見分けがつかない。
問3
配位結合は共有結合のように【1】という線を使って表すことができる。
解答/解説:タップで表示
解答:【1】価標
配位結合は共有結合のように価標という線を使って表すことができる。















