MENU
オキソ酸(例・酸化力・一覧・強さ・構造・酸化数など)
目次
はじめに
【プロ講師解説】このページでは『オキソ酸(例・酸化力・一覧・強さ・構造・酸化数など)』について解説しています。
オキソ酸とは
- 金属元素の酸化物の化学式に水の化学式を形式的に加えると対応する水酸化物の化学式になる。
- 非金属元素の酸化物は、酸素との共有結合により生じる。
参考:酸性酸化物・塩基性酸化物・両性酸化物(違い・見分け方・一覧・反応など)
- その酸化物の多くは水と反応して酸を生じて酸性を示すので酸性酸化物である。
- この場合、酸は分子内に酸素O原子を含んでおり、このような酸をオキソ酸(酸素酸)という。
硫黄
非金属酸化物の産生
\[ \mathrm{S+O_{2}→SO_{2}} \]
オキソ酸の生成
\[ \mathrm{SO_{2}+H_{2}O}
→
\underbrace{ \mathrm{H_{2}SO_{3}} }
_{ \text{ オキソ酸 }} \]
オキソ酸一覧
- 金属元素の酸化物における水酸化物がそうであったように、非金属元素の酸化物にも対応する水酸化物のようなものがあって、それがオキソ酸である。
- 非金属元素の酸化物とオキソ酸の対応関係も金属元素の酸化物と水酸化物の対応関係と同様にとても重要なので、代表的なものを確認しておこう。
| 非金属元素の酸化物 | オキソ酸 |
|---|---|
| CO2 | H2CO3 |
| SiO2 | H2SiO3 |
| NO2 | HNO3 |
| P4O10 | H3PO4 |
| SO2 | H2SO3 |
| SO3 | H2SO4 |
| Cl2O7 | HClO4 |
オキソ酸の強さ
- オキソ酸の酸としての強さは含まれる酸素O原子の数が増えるほど強くなる。
- 例えばClを含むオキソ酸を強い順に並べると次のようになる。
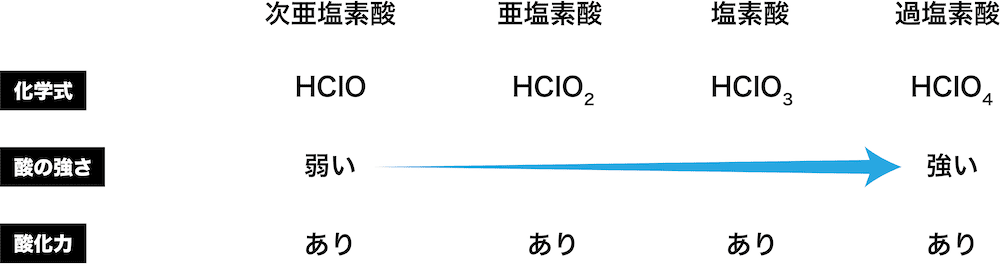
- ちなみに、O原子が増えるということは「中心元素の酸化数が(正の方向に)大きくなる」ということも理解しておこう。
オキソ酸の構造
- オキソ酸は中心元素に酸素O原子が配位結合することにより形成されている。
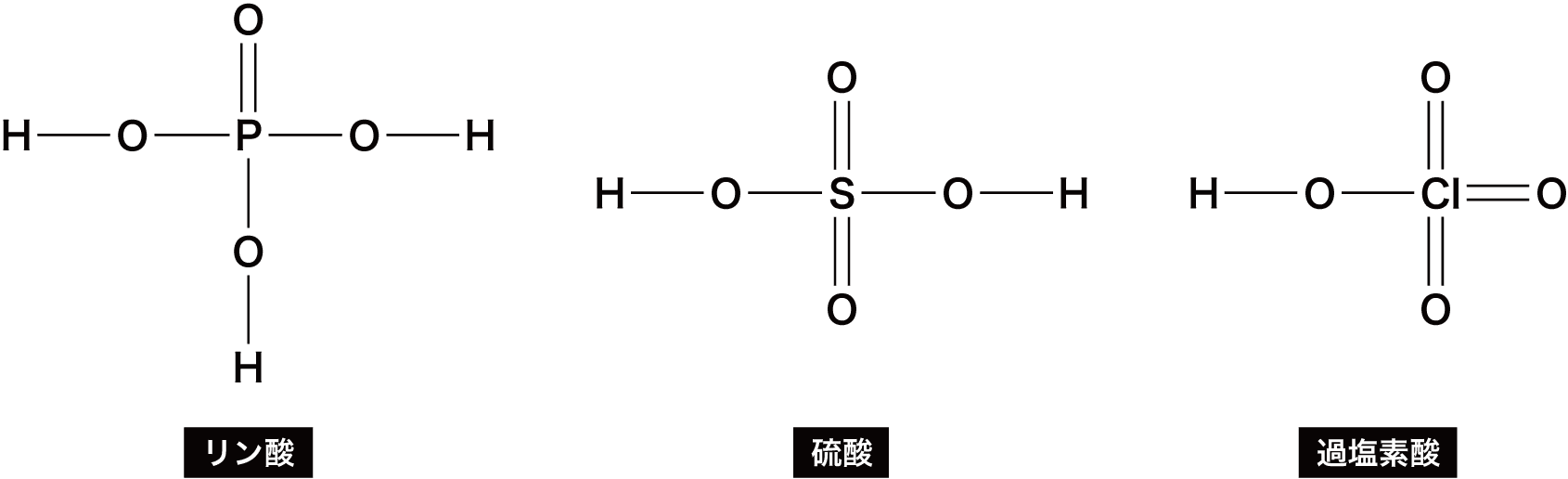
- 先ほどオキソ酸一覧のところに挙げたオキソ酸の中でも特に構造が問われやすいものを確認しておこう。
| 名称 | 化学式 | 構造 |
|---|---|---|
| 炭酸 | H2CO3 | 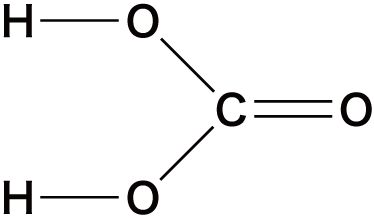 |
| リン酸 | H3PO4 | 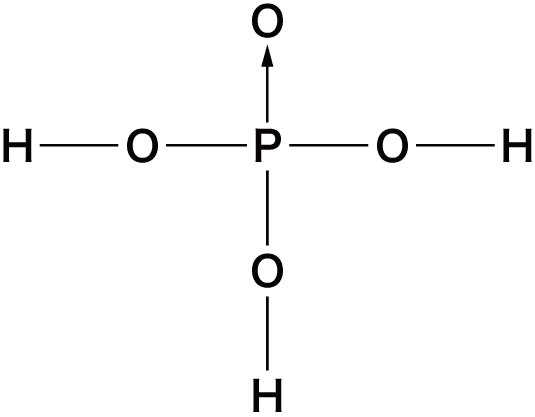 |
| ケイ酸 | H2SiO3 | 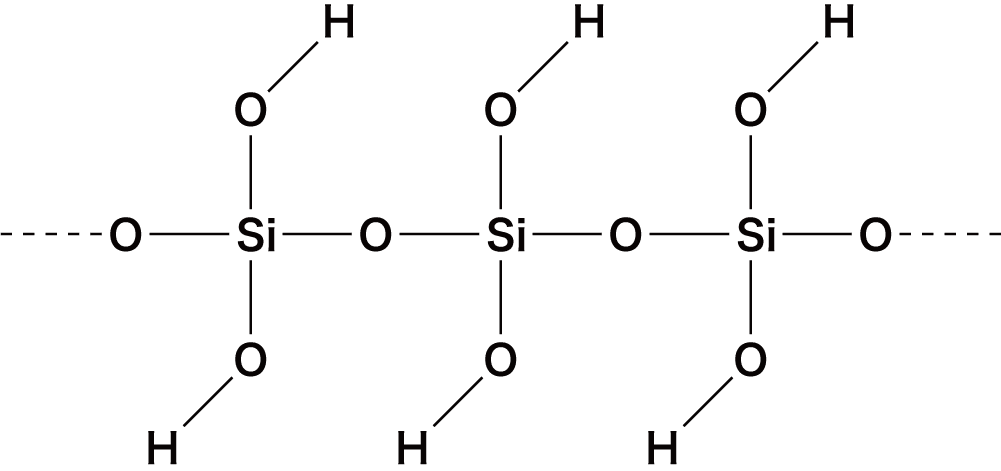 |
| 亜硝酸 | HNO2 | |
| 硝酸 | HNO3 | 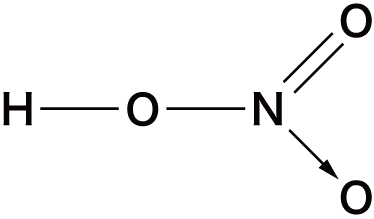 |
| 亜硫酸 | H2SO3 | 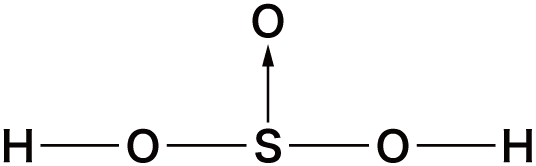 |
| 硫酸 | H2SO4 | 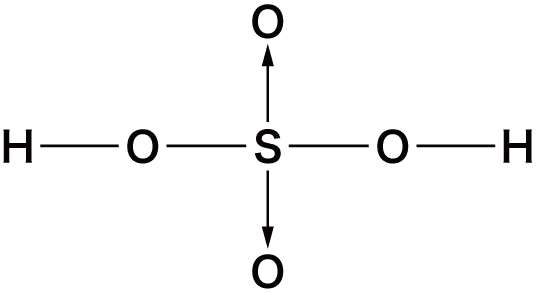 |
| 次亜塩素酸 | HClO | |
| 亜塩素酸 | HClO2 | |
| 塩素酸 | HClO3 | 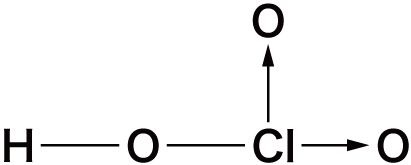 |
| 過塩素酸 | HClO4 | 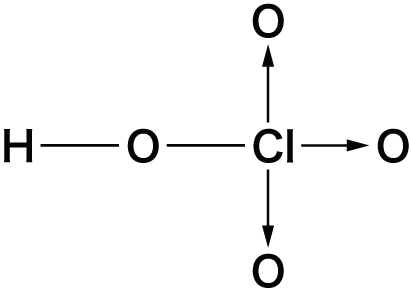 |
- これらの構造式は全て書けるようにしておく必要がある。→は配位結合だが、リン酸・硫酸・過塩素酸のような、第3周期以降の元素のオキソ酸の構造式は、次のように配位結合ではなく二重結合を用いることもできる。