MENU
酸性酸化物・塩基性酸化物・両性酸化物(違い・見分け方・一覧・反応など)
目次
はじめに
【プロ講師解説】このページでは『酸性酸化物・塩基性酸化物・両性酸化物(違い・見分け方・一覧・反応など)』について解説しています。
酸化物とは
- 酸化された化合物を酸化物という。
- 酸化物はその反応性によって3つのタイプに分類されており,酸と反応する塩基性酸化物,塩基と反応する酸性酸化物,酸・塩基両方と反応する両性酸化物がある。
酸化物の分類
- 金属元素の酸化物→塩基性酸化物,両性酸化物
- 非金属元素の酸化物→酸性酸化物
- 上述のように,酸化物は塩基性酸化物・酸性酸化物・両性酸化物の3種類存在するが,一般に,金属元素の酸化物は塩基性酸化物で,非金属元素の酸化物は酸性酸化物である。
- なお,周期表上で金属元素と非金属元素の境目付近に属する両性金属(アルミニウムAl,亜鉛Zn,スズSn,鉛Pb)の酸化物は両性酸化物とよばれる。
金属元素の酸化物
- 金属元素の酸化物である塩基性酸化物の構造や特徴,化学式のつくり方を紹介する。
金属元素の酸化物の構造
- 金属原子と酸素原子の結合は金属と非金属の結合のため,イオン結合である。
- 例えば,酸化マグネシウムの場合,Mg2+とO2ーが規則正しく配列してイオン結晶を構成している。
金属元素の酸化物の特徴
- 金属元素の酸化物には,必ず酸化物イオンO2ーが含まれているという特徴がある。
- この特徴は,金属元素の酸化物が塩基性酸化物として共通の反応性を示すことにつながっている。
金属元素の酸化物の反応
- 金属元素の酸化物の反応については酸化物の反応(金属元素・非金属元素)を参考にしよう。
非金属元素の酸化物
- 非金属元素の酸化物である酸性酸化物の構造や特徴,化学式のつくり方を紹介する。
非金属元素の酸化物の構造
- 非金属原子と酸素原子の結合は非金属と非金属の結合のため,共有結合である。
- さらに,共有結合をすると分子を形成するため,非金属元素の酸化物は分子性物質である。
非金属元素の酸化物の特徴
- 非金属元素の酸化物は必ずXO(Xは非金属原子)の共有結合をもつという特徴がある。
- 代表的な非金属の酸化物の構造式は次の通り。構造を見ると,いずれもXOの共有結合をもっていることが確認できる。
| 酸化物名 | 化学式 | 構造 |
|---|---|---|
| 一酸化炭素 | CO | 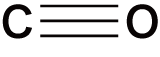 |
| 二酸化炭素 | CO2 | |
| 一酸化窒素 | NO | |
| 二酸化窒素 | NO2 | 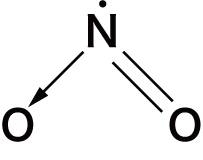 |
| 二酸化硫黄 | SO2 | 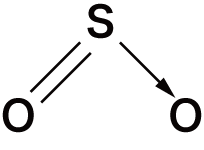 |
| 三酸化硫黄 | SO3 |  |
| 二酸化ケイ素 | SiO2 | 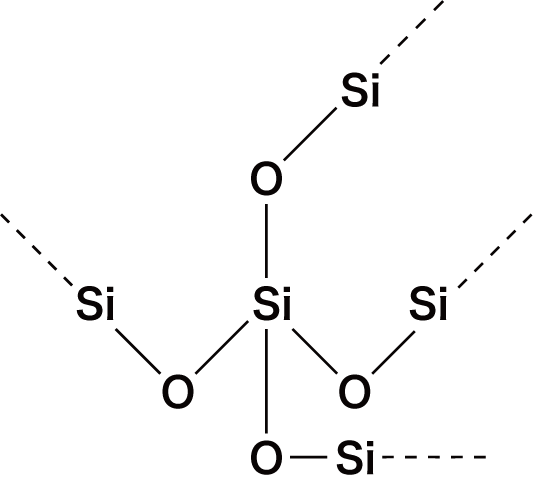 |
| 十酸化四リン | P4O10 | 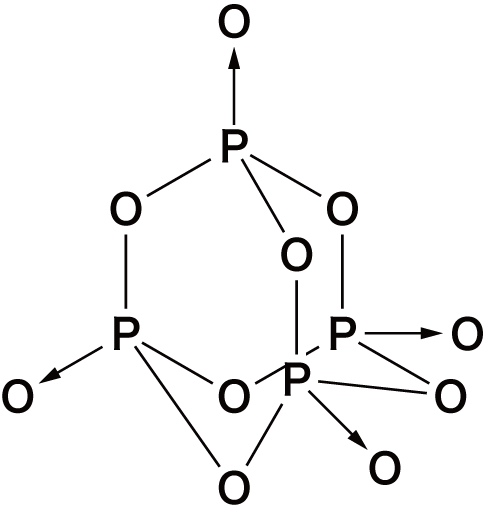 |
| 七酸化二塩素 | Cl2O7 | 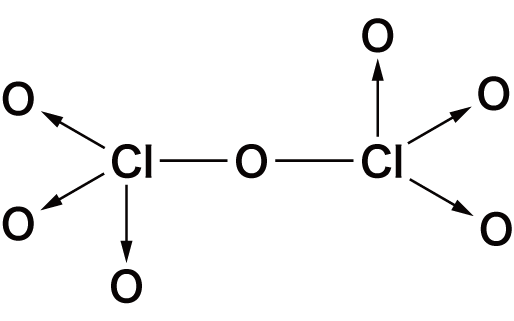 |
- 共通構造であるXOの結合の極性を考えると,酸素はフッ素に次いで2番目に電気陰性度が大きいため,電子対を引き付ける力が非常に大きく,XOの共有電子対は酸素の側に大きく偏っている場合が多い。
- その結果,XOの結合は次のように大きく分極している。
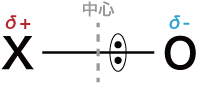
- このように,非金属元素の酸化物には,大きく分極したXOの共有結合が含まれているという特徴があり,この特徴が非金属元素の酸化物が酸性酸化物としての反応性を示す理由である。
非金属元素の酸化物の反応
- 非金属元素の酸化物の反応については酸化物の反応(金属元素・非金属元素)を参考にしよう。
演習問題
化学のグルメでは,高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
問1
酸化された化合物を【1】という。
解答/解説:タップで表示
解答:【1】酸化物
酸化された化合物を酸化物という。
問2
酸化物には【1】・【2】・【3】の3種類が存在する。
解答/解説:タップで表示
解答:【1】塩基性酸化物【2】酸性酸化物【3】両性酸化物(順不同)
酸化物には酸性酸化物・塩基性酸化物・両性酸化物の3種類が存在する。
問3
非金属元素の酸化物を【1】という。
解答/解説:タップで表示
解答:【1】酸性酸化物
非金属元素の酸化物を酸性酸化物という。
問4
金属元素の酸化物を【1】という。
解答/解説:タップで表示
解答:【1】塩基性酸化物
金属元素の酸化物を塩基性酸化物という(ただし,両性金属の酸化物は両性酸化物という)。
問5
両性金属の酸化物を【1】という。
解答/解説:タップで表示
解答:【1】両性酸化物
両性金属の酸化物を両性酸化物という。
問6
酸性酸化物と水を反応させると【1】が生じる。
解答/解説:タップで表示
問7
塩基性酸化物と水を反応させると【1】が生じる。














