MENU
【定義】水に溶ける(溶解する)とは一体どういう現象なのか図を用いて解説!
目次
はじめに
【プロ講師解説】このページでは『【定義】水に溶ける(溶解する)とは一体どういう現象なのか図を用いて解説!』について解説しています。
「水に溶ける」とは
- 「水に溶ける」とはどういった現象なのか、いくつか例を用いて解説する。
塩化ナトリウムの場合
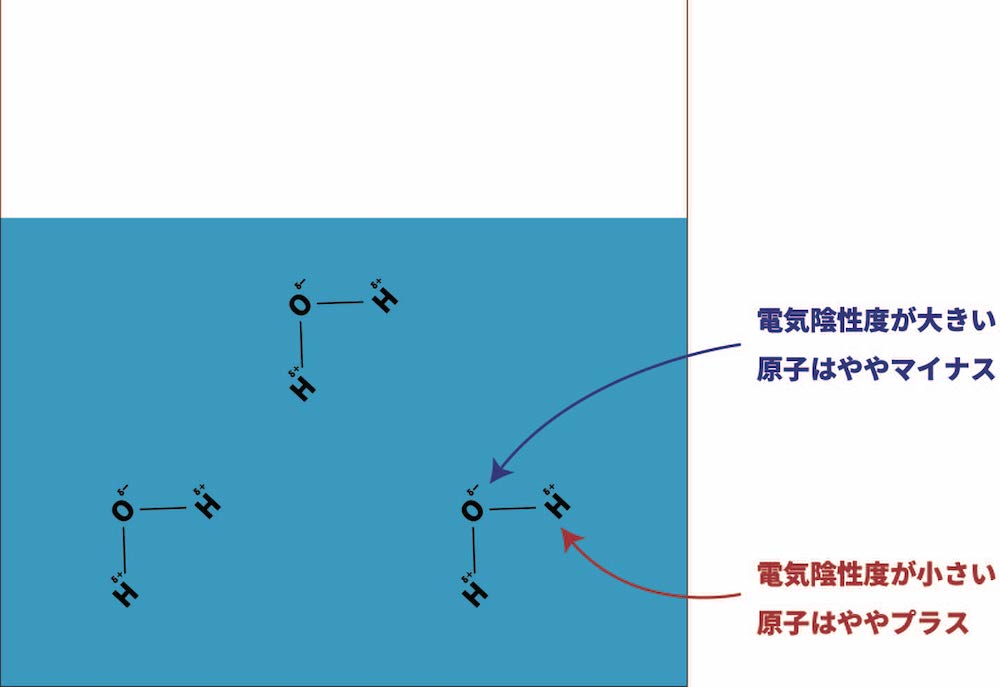
- 水分子は極性分子(分子内に極性が生じている分子)であり、分子内の一部はややプラスに、一部はややマイナスに電荷が偏っている。
- また、NaClは水の中で次のように電離している。
\[ \mathrm{NaCl → Na^{+}+Cl^{-} }\]
- 電離の結果できたNa+とClーの周りには、それぞれ水分子のδー部分とδ+部分が近づいてくる。
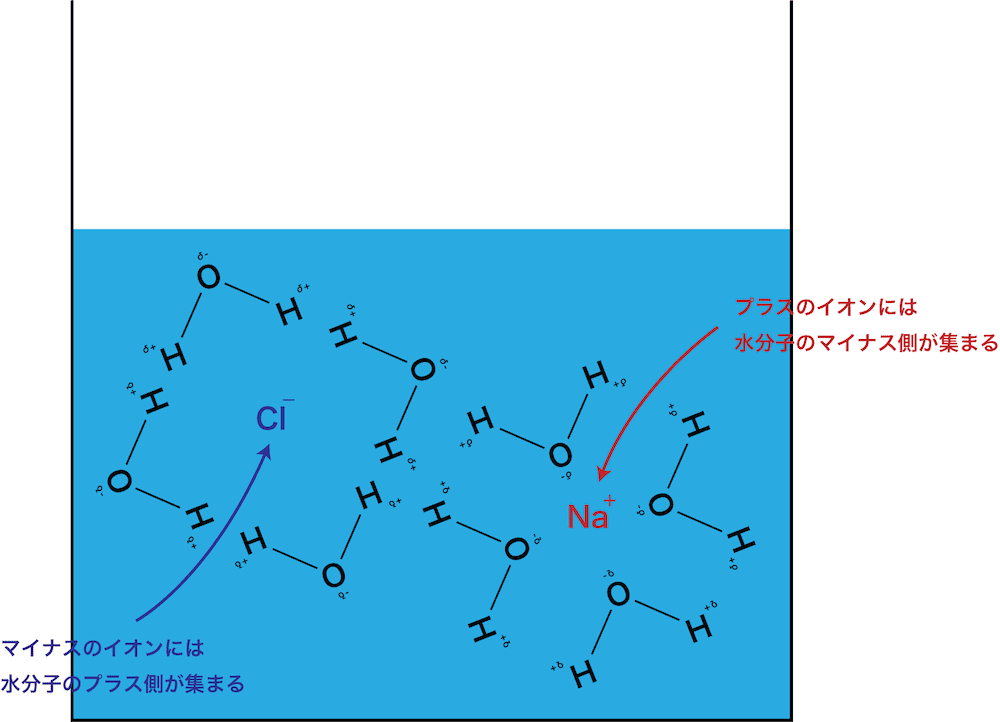
- 結果、いわゆる”水和”した状態となり、Na+とClーは引き離される。
エタノールの場合
- アルコール(ex:エタノール)の場合でも同様に考えることができる。
- 上述の通り、水分子は極性分子であり、分子内の一部はややプラスに、一部はややマイナスに電荷が偏っている。

- ここに、極性分子であるエタノールを加えると、お互いの電荷がプラスの所とマイナスの所が引き合って緩い結合(今回はたまたま水素結合を形成する原子の組み合わせなので水素結合)が形成される。
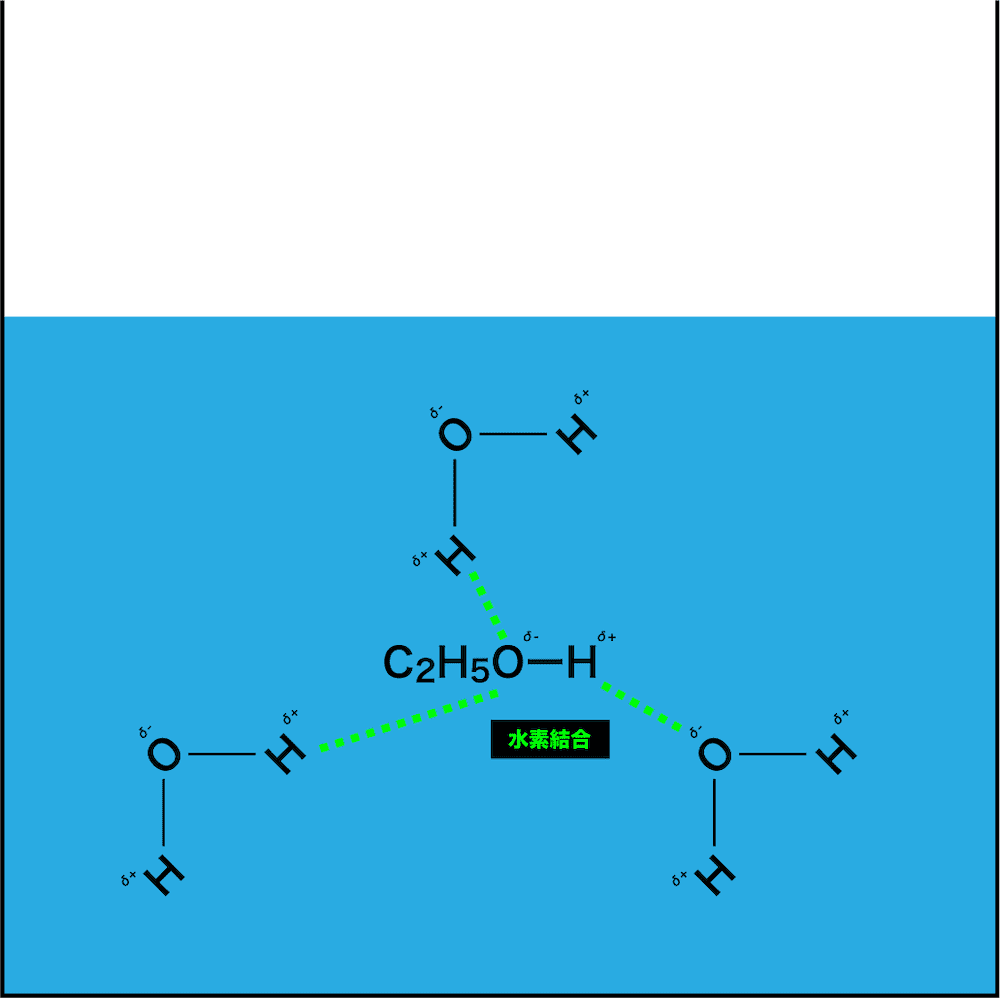
- その結果、エタノール分子が水分子に囲まれて他のエタノール分子と引き離されることになるので、いわゆる“水和した(=溶けた)”状態になる。
水に溶ける(=溶解する)の本質まとめ
- 溶質(イオンや分子)の周りを溶媒分子が囲む
- 溶質同士が引き離されてバラバラになる(=溶けた!)
- 上で説明してきたように、溶質(イオンや分子)の周りを溶媒分子が囲み、それによって溶質同士が引き離されバラバラになる現象を溶ける(=溶解する)という。
- また、溶け”やすさ”については溶媒と溶質の極性を考慮する必要があり、極性溶媒には極性分子が溶けやすく、無極性溶媒には無極性分子が溶けやすい。
| 極性分子(溶質) | 無極性分子(溶質) | |
|---|---|---|
| 極性溶媒 | 溶ける | 溶けない |
| 無極性溶媒 | 溶けない | 溶ける |
参考:極性溶媒と無極性溶媒
「水に溶ける」と「電離する」の違い
- ここまで説明してきた「水に溶ける(溶解する)」という現象と「電離する」という現象は何が違うのかについて解説する。
- 「水に溶ける(溶解する)」という現象と「電離する」という現象の違いをまとめると、次のようになる。
●イオンがバラバラになるのが「電離する」
●イオンだけでなく、電離しないエタノールのような分子同士がバラバラになるのも含めて考えたのが「水に溶ける」
- 水に溶けるという現象は「溶質(イオンや分子)の周りを溶媒分子が囲み、それによって溶質同士が引き離されバラバラになる現象」である。
- 一方、電離するという現象は「塩を構成する陽イオンと陰イオンが引き離されてバラバラになる現象」である。
「水に溶ける(溶解)」という大枠の中に「電離」があるイメージです。
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
問1
塩を構成しているイオンが溶媒分子によって引き離される現象を【1】という。
問2
水分子が溶質の分子やイオンと強く引き合うことを【1】という。
解答/解説:タップで表示
問3
水和しているイオンを【1】、水和している分子を【2】という。
解答/解説:タップで表示
問4
水分子は【1(極性 or 無極性)】分子であり、塩化ナトリウムNaClを入れると水分子のH原子が【2】イオンを、O原子が【3】イオンを取り囲み、いわゆる溶けた状態になる。
解答/解説:タップで表示
問5
水和水が分子にくっついた状態になったものを【1】といい、代表的な【1】である硫酸銅五水和物の化学式は【2】である。














