MENU
【原子の構造】陽子・中性子・電子・原子核・質量数・原子番号の数と関係
目次
はじめに
【プロ講師解説】このページでは『【原子の構造】陽子・中性子・電子・原子核・質量数・原子番号の数と関係』について解説しています。
原子とは
- 我々の身の周りの物すべてを構成している”小さくて丸いツブ”を原子という。ボクたち人間も、飼っているペットも、いまいじっているパソコンやスマホも、全部この原子からできている。
- 現在確認されてる原子の種類は118種類で、そのうち自然界を構成しているのは92種類である。
- 原子にはそれぞれ番号がつけられていて、その番号を原子番号という。
原子核・電子
- 原子の中身を詳しく解説する。下の図全体が原子を表している。
- 原子の中心にいる赤いマルを原子核、原子核の周りをグルグルまわっている青いマルを電子という。
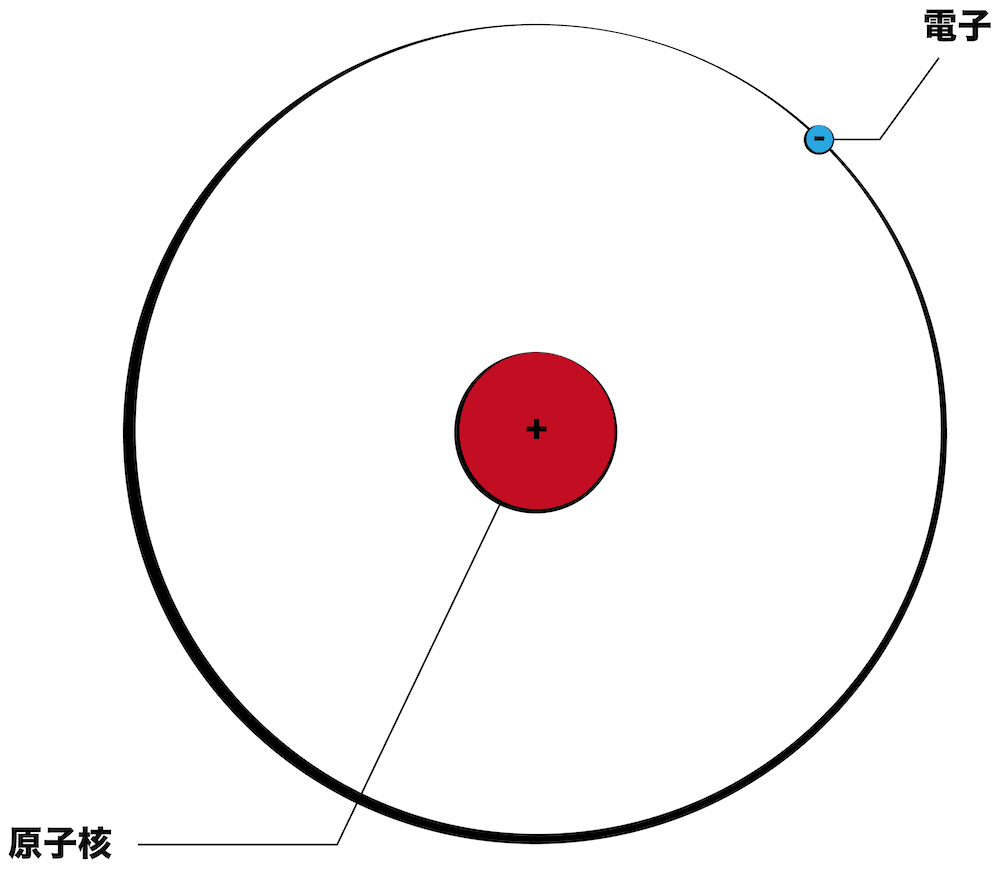
- 原子核はプラスの電荷を、電子はマイナスの電荷を帯びている。
陽子・中性子
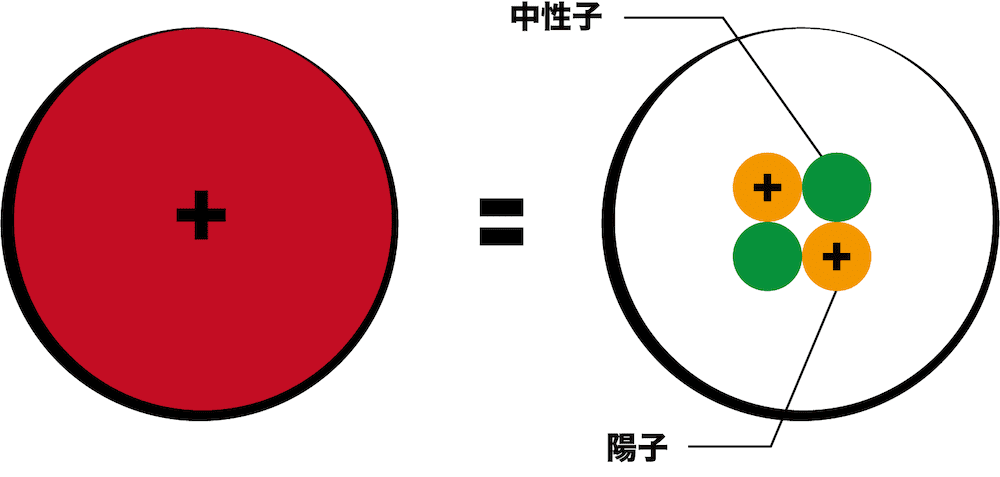
- 次に、原子核の中身を詳しく解説する。
- まず覚えてほしいのは、“原子核は陽子と中性子から成り立っている”ということである。次図では、オレンジ色のマルが陽子、緑色のマルが中性子を表している。
- 陽子はプラスの電荷を帯びており中性子は電荷を帯びていない。これが、先ほど”原子核(陽子+中性子)はプラスの電荷を帯びている”と述べた理由である。
原子のサイズ
- 原子の直径は約10-8cm(1cmの1億分の1)である。
- 一方、原子核の大きさは、約10-13〜10-12cmなので、原子の大きさの10万分の1〜1万分の1しかない。
- これは、1円玉(原子核)と甲子園球場(原子)の大きさの関係に相当する。

陽子/中性子/電子の重さ
- 陽子・中性子・電子の重さは次の通り。陽子・中性子と比較して電子は極めて軽いことがわかる。
| 質量(g) | 質量比 | |
|---|---|---|
| 陽子 | 1.673×10-24 | 1 |
| 中性子 | 1.675×10-24 | 1 |
| 電子 | 9.109×10-28 | 1/1840 |
原子番号(原子の化学的性質)
- 原子の化学的な性質(反応性など)を決める要素について検討する。
- 化学では”電子”に注目することが多い(化学結合や酸化還元など)ため、”電子”と答えたくなるかもしれないが、実はその電子の数を決めているのは”陽子”である。
- 次図原子の場合、陽子(プラス)が2個あるので、電子(マイナス)が2個引き寄せられる。
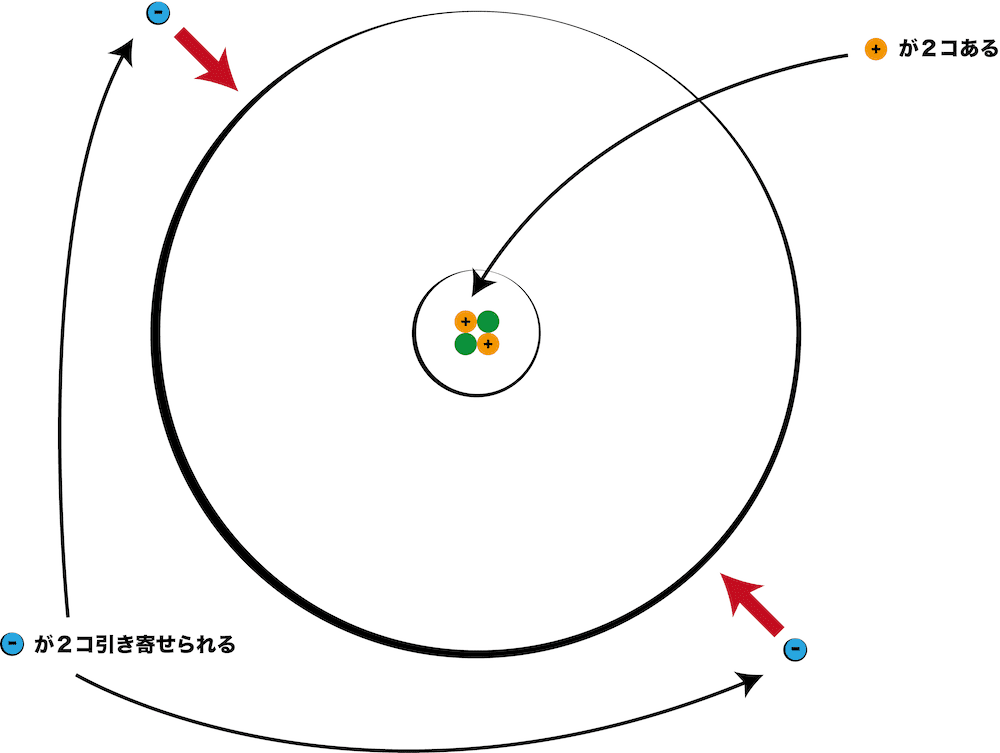
- このように、原子の化学的な性質を決めるのは陽子なので、陽子の数をその原子の番号(原子番号)という。
質量数(原子の物理的性質)
- 原子の物理的な性質(運動性など)を決める要素は「重さ」である。
- 上に表で示したように、原子を構成する3つのパーツの質量比は次のようになっている。
\[ \mathrm{陽子:中性子:電子=1:1: \frac{ 1 }{ 1840 }} \]
- 電子の質量は陽子、中性子と比較して極めて小さい。したがって、原子の重さ≒陽子の重さ+中性子の重さと考えることができる。では、次の原子の重さは一体どのくらいになるだろうか。

- (上の表より)陽子1個の重さが1.673×10ー24、中性子1個の重さが1.675×10ー24のため…
\[ \mathrm{(1.673×10^{-24}×2 + 1.675×10^{-24}×2) g} \]
- この数字はとても小さいのでイメージしにくい。そこで、原子の重さを、本当の質量ではなく「陽子と中性子の合計粒子数」で表す。
- この”陽子と中性子の合計粒子数”は原子の質量の代わりになる数値のため、質量数という。
\[ \underbrace{ 2 }_{ 陽子} +\underbrace{ 2 }_{ 中性子 } = 4\]
原子に関する公式
- これまで扱った重要な関係を公式としてまとめる。
●公式1
原子番号=陽子の数
●公式2
陽子の数=電子の数
●公式3
陽子の数+中性子の数=質量数
- 陽子が原子の化学的な性質を決定するため、原子番号は陽子の数と等しい。
- 1個の陽子が1個の電子を引き寄せるため、原子に含まれる陽子の数と電子の数は等しい。
- 原子の重さを表す質量数は(極端に軽い電子は省くため)陽子の数と中性子の数を足した値となる。
原子の表記法
- 原子は元素記号という1〜2文字のアルファベットで表される。
- 元素記号の左上に質量数、左下に原子番号を書く。
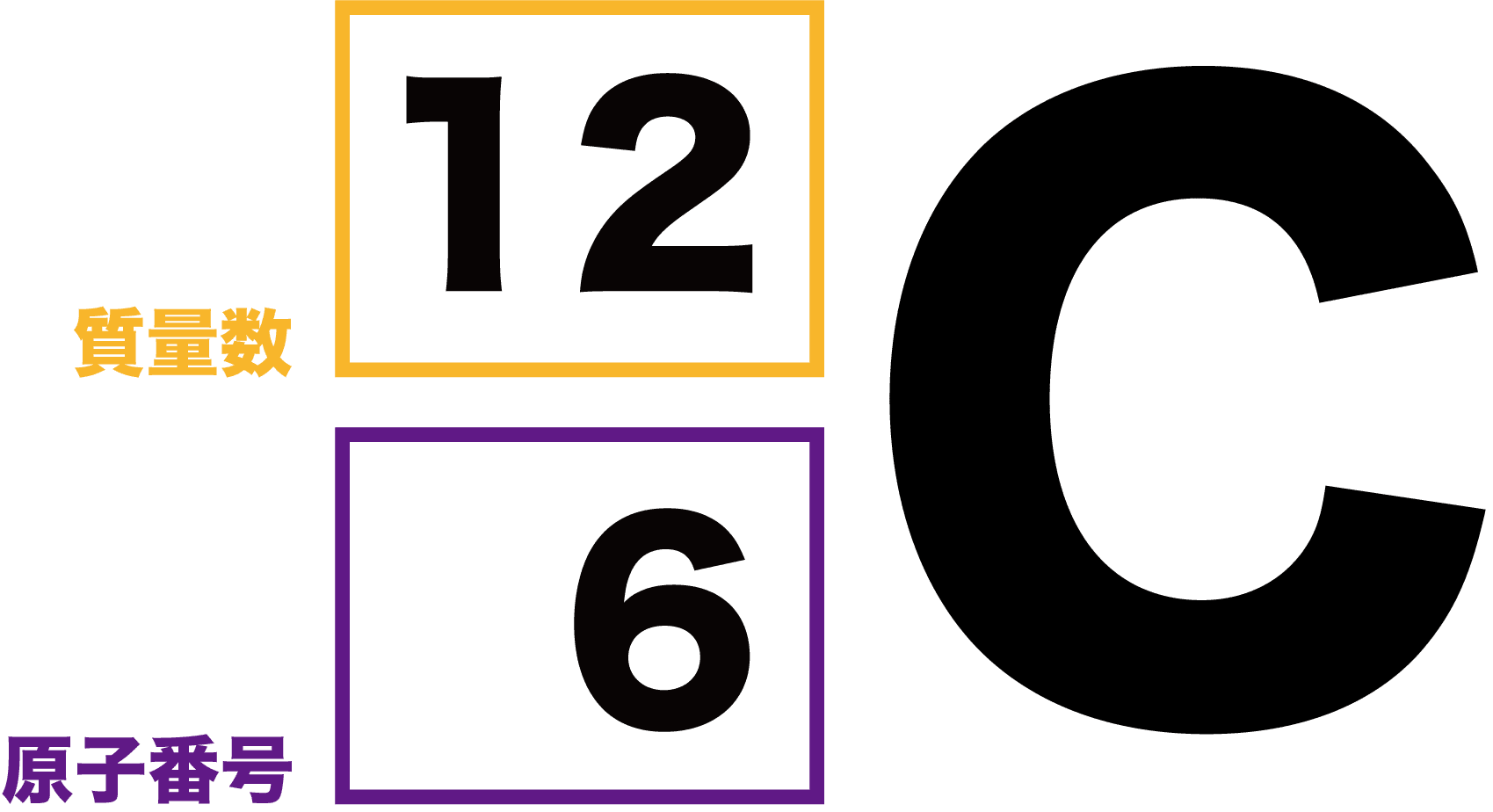
この表記を見て陽子の数・電子の数・中性子の数を言えるようにしておこう。
—–
原子番号=陽子の数のため、陽子の数は6個
陽子の数=電子の数のため、電子の数も6個
陽子の数+中性子の数=質量数のため、中性子の数も6個
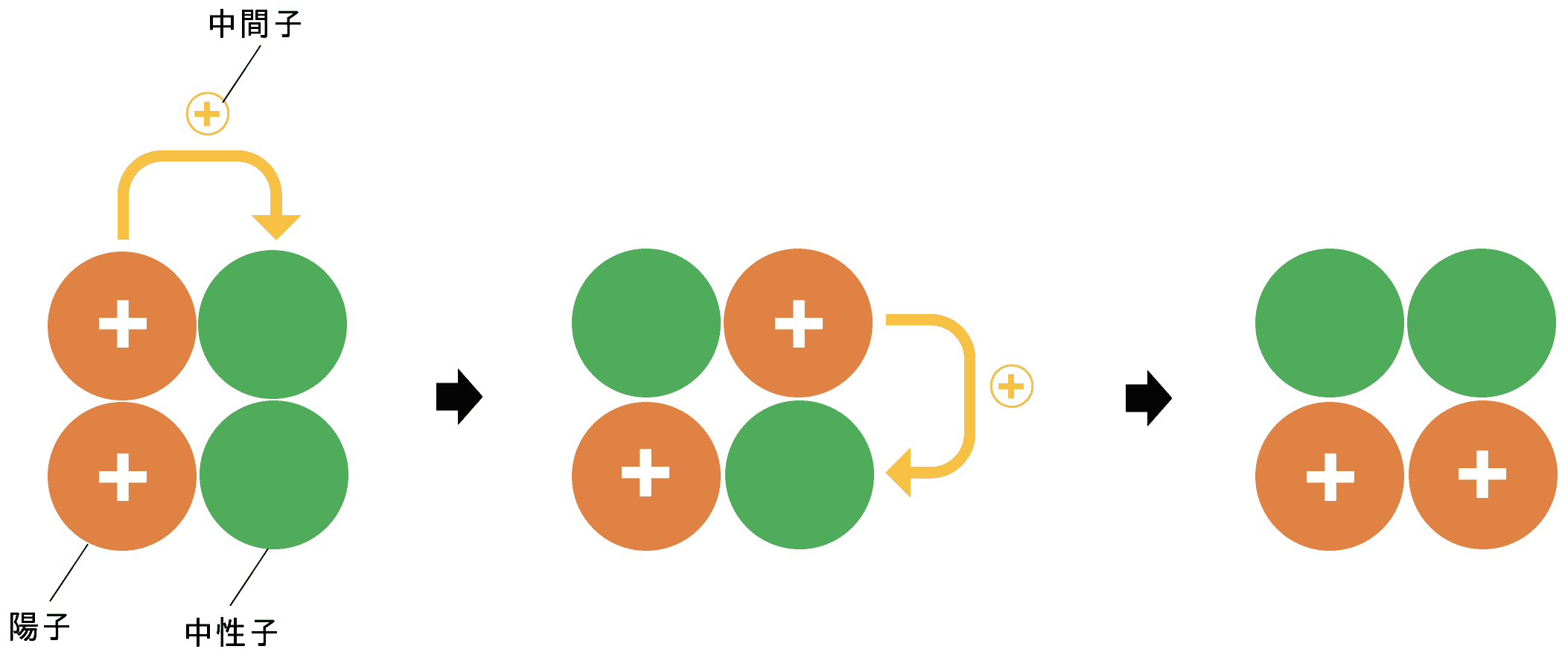
中間子と核力
- ヘリウム(原子番号2)以降の原子は陽子を複数個もつため、原子核に陽子しかない場合プラス同士の電気的な反発が起こる。これを避けるために中性子が存在している。
- 陽子と中性子は中間子と呼ばれる素粒子を素早く交換しながら結びついている。
- つまり、陽子が中間子を放出し、中性子がこれを受け取ると、陽子は中性子に、中性子は陽子に変化する。これを繰り返すことで中間子によって陽子の正電荷が絶えず運び続けられる。
- 結果、陽子と中間子の間には(陽子同士の反発を無力化するほどの)強い相互作用(=核力)が働くため原子核は安定して存在できる。