MENU
相対質量の異なる分子数の数え方〜四塩化炭素〜
目次
はじめに
【プロ講師解説】このページでは『相対質量の異なる分子数の数え方〜四塩化炭素〜』について解説しています。
前提
- 例えば、塩素Clと炭素Cにはそれぞれ2種類の同位体が存在する。

- このとき、ClとCから出来た化合物である四塩化炭素CCl4にはいくつの「相対質量が異なる分子」が存在するだろうか。
- 例えば、塩素の同位体の1つである35Clが4個と炭素の同位体の1つである12Cが1個で形成された四塩化炭素CCl4の相対質量は「35+35+35+35+12=152」となるし、35Clが2個、37Clが2個、13Cが1個で形成された四塩化炭素CCl4の相対質量は「35+35+37+37+13=155」となる。
- 今回は、このような相対質量の異なる分子数が複数存在する場合の、分子数の数え方について解説する。
参考:【決定版】相対質量・原子量・分子量・式量の定義、求め方、計算問題」や「同素体・同位体(違い・例・硫黄・炭素・酸素・リンなど)
相対質量の異なる分子数の数え方
問題
塩素には35Clと37Clの、炭素には12Cと13Cの同位体が存在するとして、CCl4には相対質量の異なる分子が何種類存在するか。
『早稲田大学 2016年 参考』
- 上で述べたように、塩素と炭素にはそれぞれ2種類ずつ同位体が存在する。

- これらが形成する分子「四塩化炭素CCl4」の相対質量は、4個のClの相対質量と1個のCの相対質量の合計で表されるため「4個のClと1個のCの組み合わせ」を考えていく必要がある。
- 組み合わせを考える際は全てのパターンを網羅するように紙に1つ1つ書き出す(そこまで組み合わせパターンが多い問題が出題されることは少ないため、数学のように数式を使って考える必要はない)。
まずは、塩素の同位体35Clと37Clの組み合わせを書き出す。

- 次に、炭素の同位体について考える。
- 炭素の同位体は12Cと13Cの2個のため、塩素の組み合わせと合わせて考えると次のようになる。
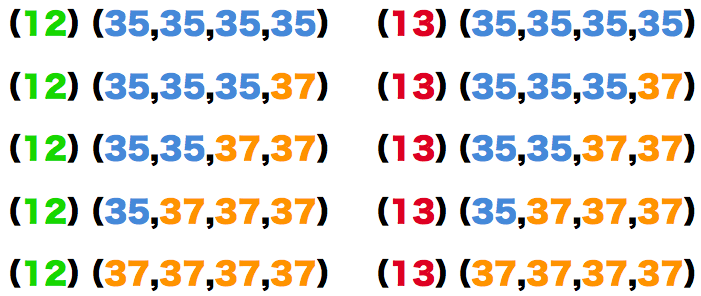
- 以上より、四塩化炭素の相対質量の異なる分子の数は10個である。