MENU
同素体・同位体(違い・例・硫黄・炭素・酸素・リンなど)
はじめに
【プロ講師解説】このページでは『同素体・同位体(違い・例・硫黄・炭素・酸素・リンなど)』について解説しています。
同素体・同位体とは
- まずは同素体と同位体の定義を確認する。
| 同素体 | 同じ元素からなる単体で、化学的性質(反応性など)が異なる物質同士 |
| 同位体 | 原子番号が同じで、質量数の異なる原子同士 化学的性質(反応性など)にあまり違いがない |
このページでは同素体を中心に解説します。同位体について詳しくは次のページを確認しましょう。
参考:同位体(一覧・例・性質・存在比を使った計算など)
同素体
- 同じ元素からなる単体で、化学的性質(反応性など)が異なる物質同士を互いに同素体という。
- 同素体の例としては「酸素(O2)とオゾン(O3)」が挙げられる。この2つは同じ「O」という元素からなる単体だが、色や臭いなどの化学的性質は異なる。
- 高校化学・化学基礎の同素体の単元では、「S・C・O・P」の4つの元素が多く登場する。
硫黄 S
- 硫黄の代表的な同素体は斜方硫黄・単斜硫黄・ゴム状硫黄である。
- 斜方硫黄・単斜硫黄・ゴム状硫黄は、それぞれ次のような特徴をもつ。
| 単体名 | 化学式 | 色 | 性質 | CS2への溶解性 |
|---|---|---|---|---|
| 斜方硫黄 | S8(環状分子) | 黄色 | 非常に安定 | 溶ける |
| 単斜硫黄 | S8(環状分子) | 黄色 | 放置すると斜方硫黄になる | 溶ける |
| ゴム状硫黄 | Sx(長鎖状分子) | 黄色 | 放置すると斜方硫黄になる | 溶けない |
- 常温・常圧下では斜方硫黄が最も安定しており、単斜硫黄もゴム状硫黄も常温で放置すると斜方硫黄に変化する。
炭素 C
- 炭素の代表的な同素体はダイヤモンド・黒鉛(グラファイト)・フラーレンである。
- ダイヤモンドは宝石として指輪などに用いられる。黒鉛は鉛筆の芯の原料になる。フラーレンはナノテクノロジーで用いられる。それぞれの特徴は次のとおりである。
| 単体名 | 化学式 | 色 | 構造 | 性質 |
|---|---|---|---|---|
| 黒鉛 | C | 黒色 | C原子により形成された6角形の層が分子間力で結合 | ・やわらかい ・もろい ・電気伝導性あり ・金属光沢あり |
| ダイヤモンド | C | 無色透明 | C原子が正四面体の頂点方向に共有結合 | ・極めて硬い ・電気伝導性なし |
| フラーレン | C60(C70・C80) | ー | C原子がサッカーボール型に結合 | ナノテクノロジーに利用 |
- 黒鉛はグラファイトともよばれる。
これらのほか、炭素の同素体として、黒鉛の平面構造の1層だけを取り出したグラフェン、炭素の平面構造が筒状になり形成されるカーボンナノチューブなどがあります。
酸素 O
- 酸素の代表的な同素体は酸素とオゾンである。
| 単体名 | 化学式 | 形 | 色 | 臭い | 性質 |
|---|---|---|---|---|---|
| 酸素 | O2 | 直線形 | 無色 | 無臭 | 助燃性あり |
| オゾン | O3 | 折れ線形 | 淡青色 | 特異臭 | 紫外線吸収効果あり |
リン P
- リンの代表的な同素体は黄リンと赤リンである。
| 単体名 | 化学式 | 形 | 色 | 毒性 | 性質 |
|---|---|---|---|---|---|
| 黄リン | P4 | 正四面体 | 黄色 | あり | ・自然発火する(水中に保存) ・真空中で加熱すると赤リンに |
| 赤リン | P | 無定形 | 赤色 | なし | ・マッチの箱の横に付いているヤツ |
- 黄リンは非常に危険な物質である。空気中で放置すると、突然火がつく場合がある(自然発火)。
- したがって、保存するときはビンに水をいれてその中に突っ込んでおく。(水中に置いておけば、空気に直接触れないから自然発火は起こらない)
- 黄リンは毒性をもつ。
- 赤リンは、マッチの箱の横に付いていて、マッチに火を点けるときに使う。日常で使われているものなので、当然無毒で自然発火もしない。
同位体
- 原子番号が同じで、質量数の異なる原子同士を同位体という。
- 例として水素を紹介する。水素は、天然に3つの同位体が存在する。
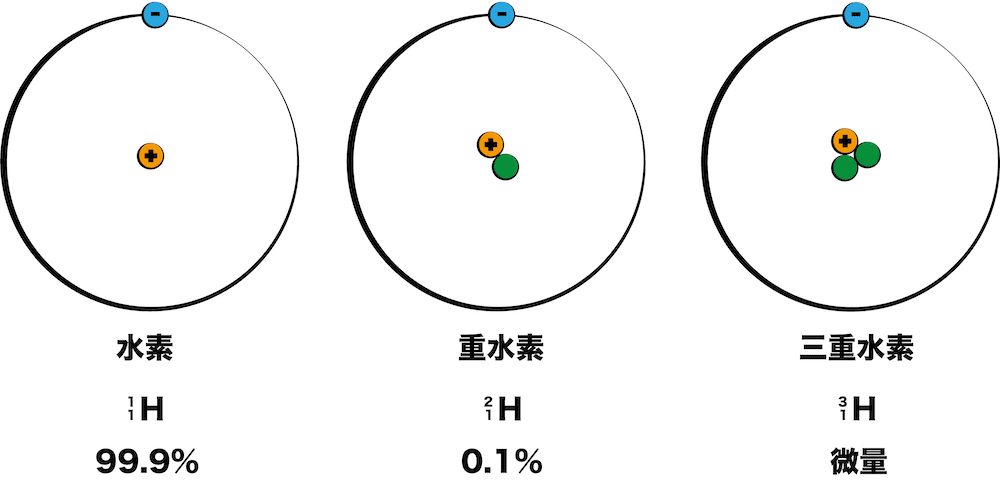
- これら3つは、同じ”水素”の仲間ではあるが、質量数が異なっている。原子番号(=陽子の数)が一緒であるにも関わらず質量数が違うということはつまり「中性子の数が異なっている」ということである。
参考:【原子の構造】陽子・中性子・電子・原子核・質量数・原子番号の数と関係
- 同位体により存在比が異なることにも注意が必要である。普通の水素が1番多く99.9%、次が重水素で0.1%、三重水素はほとんど存在しない。
- 同位体は、陽子や電子の数が等しいため、化学的性質(反応性など)にあまり違いがない。(ちなみに、同素体は化学的性質に違いがない)
同位体を使った計算は定期テストや入試頻出です。次のページで取り扱っているので、必ず確認しておきましょう。
参考:同位体(一覧・例・性質・存在比を使った計算など)
同位体の存在比
- 上述の通り、同位体は全てが等量存在している訳ではなく、存在比が異なる場合がある。
- 代表的な同位体の存在比に関して、次のページの一覧表を確認しておこう。
放射性同位体
- 同位体の中には原子核が“不安定”で放射線を出しながら崩壊(壊変)していくものがあり、このような同位体を放射性同位体という。
- 放射性同位体は遺物の年代測定・医療などに利用される。
壊変
- 放射性同位体の壊変には、いくつか種類が存在する。
α(アルファ)壊変
- α線(=ヘリウムの原子核)を放出する。
- ヘリウムの原子核は「陽子2個+中性子2個」で構成されているため、α壊変が1回起こると原子番号は2減少、質量数は4減少する。
β(ベータ)壊変
- β線(=電子)を放出する。
- 放出される電子は中性子が陽子に変化することで放出されるため、β壊変が1回起こると原子番号は1増加、質量数は変化しない。
γ(ガンマ)壊変
- γ線(=α、β壊変の際に出る余分なエネルギー)を放出する。質量数や原子番号に変化はない。
同素体・同位体まとめ
この『同素体・同位体(違い・例・硫黄・炭素・酸素・リンなど)』のページで解説した内容をまとめる。
- 同じ元素からなる単体で、化学的性質(反応性など)が異なる物質同士を互いに同素体という。
- 硫黄の代表的な同素体は斜方硫黄・単斜硫黄・ゴム状硫黄である。
- 硫黄の同素体において、常温・常圧下では斜方硫黄が最も安定しており、単斜硫黄もゴム状硫黄も常温で放置すると斜方硫黄に変化する。
- 炭素の代表的な同素体はダイヤモンド・黒鉛(グラファイト)・フラーレンである。
- 酸素の代表的な同素体は酸素とオゾンである。
- リンの代表的な同素体は黄リンと赤リンである。
- 黄リンは赤リンと比べ、危険な物質である。(自然発火、毒性)
- 原子番号が同じで、質量数の異なる原子同士を同位体という。
- 同位体は、化学的性質(反応性など)にあまり変化がみられない。
- 同位体の中には原子核が“不安定”で放射線を出しながら崩壊(壊変)していくものがあり、このような同位体を放射性同位体という。
演習問題
同じ元素からできた単体で、化学的性質が異なる物質同士を【1】という。
解答/解説:タップで表示
解答:【1】同素体
同じ元素からできた単体で、化学的性質が異なる物質同士を同素体という。
硫黄の同素体で、最も安定しているのは【1】である。
解答/解説:タップで表示
解答:【1】斜方硫黄
硫黄の同素体で、最も安定しているのは斜方硫黄である。
斜方硫黄を高温(約120℃)で熱した後冷やすと、針状結晶の【1】が得られる。
解答/解説:タップで表示
解答:【1】単斜硫黄
斜方硫黄を高温(約120℃)で熱した後冷やすと、針状結晶の単斜硫黄が得られる。
斜方硫黄を非常に高温(約250℃)で熱し、それを冷水の中に入れて急冷すると【1】が得られる。
解答/解説:タップで表示
解答:【1】ゴム状硫黄
斜方硫黄を非常に高温(約250℃)で熱し、それを冷水の中に入れて急冷するとゴム状硫黄が得られる。
硫黄の同素体はいずれも【1】色である。
解答/解説:タップで表示
解答:【1】黄
硫黄の同素体はいずれも黄色である。
炭素の同素体で、炭素原子によってつくられた薄い層が分子間力で結合したものを【1】という。
解答/解説:タップで表示
解答:【1】黒鉛
炭素の同素体で、炭素原子によってつくられた薄い層が分子間力で結合したものを黒鉛という。
黒鉛は【1】色で金属光沢がある。
解答/解説:タップで表示
解答:【1】黒
黒鉛は黒色で金属光沢がある。
炭素の同素体で、炭素原子が四面体の頂点方向に共有結合したものを【1】という。
解答/解説:タップで表示
解答:【1】ダイヤモンド
炭素の同素体で、炭素原子が四面体の頂点方向に共有結合したものをダイヤモンドという。
ダイヤモンドは、無色透明で非常に【1(柔らか or 硬)】い。
解答/解説:タップで表示
解答:【1】硬
ダイヤモンドは、無色透明で非常に硬い。
【1】は60個の炭素原子がサッカーボール型に結合した構造になっており、ナノテクノロジーに利用される。
解答/解説:タップで表示
解答:【1】フラーレン
フラーレンは60個の炭素原子がサッカーボール型に結合した構造になっており、ナノテクノロジーに利用される。
酸素の同素体で、2つの酸素原子が結合してできたものを【1】という。
解答/解説:タップで表示
解答:【1】酸素
酸素の同素体で、2つの酸素原子が結合してできたものを酸素という。
酸素は【1】色・【2】臭である。
解答/解説:タップで表示
解答:【1】無【2】無
酸素は無色・無臭である。
酸素は【1】性があり、空気の約【2】%を占める。
解答/解説:タップで表示
解答:【1】助燃【2】20
酸素は助燃性があり、空気の約20%を占める。
酸素の同素体で、3つの酸素原子が結合してできたものを【1】という。
解答/解説:タップで表示
解答:【1】オゾン
酸素の同素体で、3つの酸素原子が結合してできたものをオゾンという。
オゾンは【1】色で【2】臭をもつ。
解答/解説:タップで表示
解答:【1】淡青【2】刺激
オゾンは淡青色で刺激臭をもつ。
オゾンは成層圏で【1】を吸収して地球上の生物を守る役割を果たしている。
解答/解説:タップで表示
解答:【1】紫外線
オゾンは成層圏で紫外線を吸収して地球上の生物を守る役割を果たしている。
オゾンは酸素の【1】放電や、酸素への【2】照射により生成する。
解答/解説:タップで表示
解答:【1】無声【2】紫外線
オゾンは酸素の無声放電や、酸素への紫外線照射により生成する。
冷蔵庫やエアコンなどに使われる【1】はオゾンを分解するため代替物質の開発が急がれている。
解答/解説:タップで表示
解答:【1】ハロン
冷蔵庫やエアコンなどに使われるハロンはオゾンを分解するため代替物質の開発が急がれている。
リンの同素体のうち、空気中だと自然発火するため水中に保存するのは【1】である。
解答/解説:タップで表示
解答:【1】黄リン
リンの同素体のうち、空気中だと自然発火するため水中に保存するのは黄リンである。
リンの同素体のうち、毒性をもつのは【1】である。
解答/解説:タップで表示
解答:【1】黄リン
リンの同素体のうち、毒性をもつのは黄リンである。
リンの同素体のうち、マッチのする部分等に使用され、比較的安全なのは【1】である。
解答/解説:タップで表示
解答:【1】赤リン
リンの同素体のうち、マッチのする部分等に使用され、比較的安全なのは赤リンである。












