MENU
放射性同位体(例・一覧・各種壊変、入試問題の解き方など)
はじめに
【プロ講師解説】このページでは『放射性同位体(例・一覧・各種壊変、入試問題の解き方など)』について解説しています。
放射性同位体
- 同位体の中には原子核が”不安定”で放射線を出しながら崩壊(壊変)していくものがあり、このような同位体を放射性同位体という。
- 放射性同位体は遺物の年代測定などに利用される。具体例としては、放射性同位体である14Cを用いた遺跡の年代測定が挙げられる。
- 生きている木は、空気中に存在するの二酸化炭素から14Cが補給されるので、生体内の14Cの割合は一定に保たれる。しかし、枯れると14Cが補給されなくなり、14Cが放射線を出しながら減少していく。
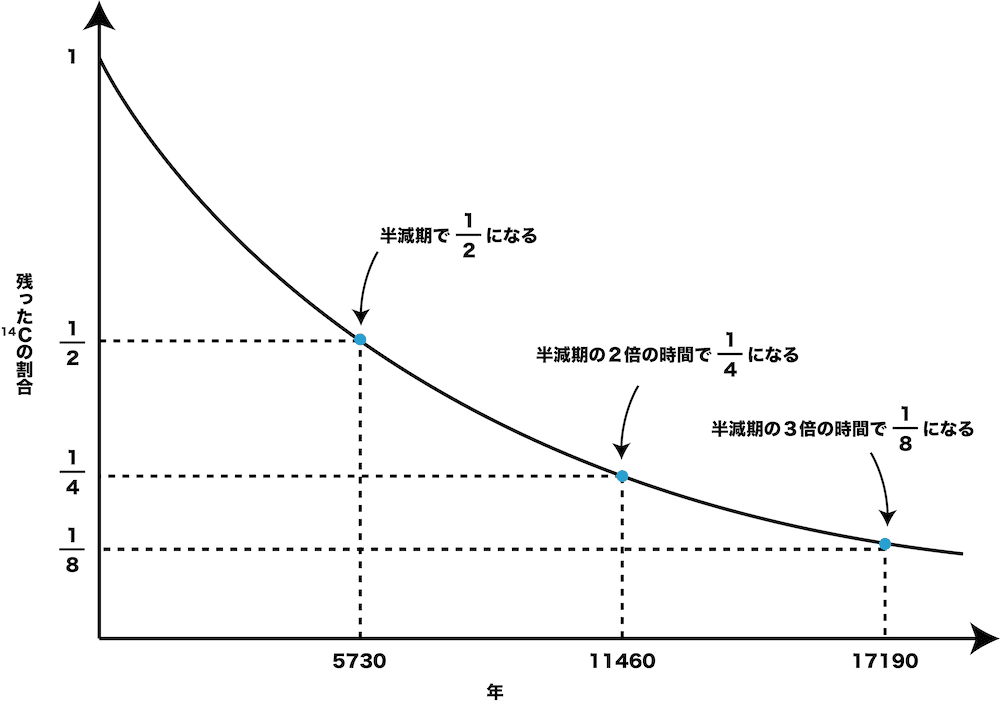
- 枯れて地中に埋もれた木の14Cは、約5730年経過するごとに半分になっていく(半分になるまでの時間を半減期という)。
α(アルファ)壊変
- α線(=ヘリウムの原子核)を放出する。
- ヘリウムの原子核は「陽子2個+中性子2個」で構成されているので、α壊変が一回起こると原子番号は2減少、質量数は4減少する。
β(ベータ)壊変
- β線(=電子)を放出する。
- 放出される電子は中性子が陽子に変化することで放出されるので、β壊変が一回起こると質量数は変わらないが原子番号は1増加する。
γ(ガンマ)壊変
- γ線(=α、β壊変の後に出る余分なエネルギー)を放出する。質量数や原子番号に変化はない。
放射性同位体が絡んだ問題例
- 放射性同位体が絡んだ問題の解き方を解説する。
表を見て、次の問いに答えなさい。
| 元素名 | 元素記号 | 存在比 |
|---|---|---|
| 水素 | 1H | 99.99% |
| 2H | 0.01% | |
| 3H | 極微量 | |
| 炭素 | 12C | 98.90% |
| 13C | 1.10% | |
| 14C | 極微量 | |
| 酸素 | 16O | 99.76% |
| 17O | 0.04% | |
| 18O | 0.20% |
(1)水素の同位体の1つである3Hは放射性同位体であり、ベータ線(β–)を放出する。この交換過程で生成する元素の記号を、解答例にならって、質量数をつけて記せ。(解答例:13C)
(2)炭素の同位体の1つである14Cの原子核中の陽子数と中性子数を記せ。
(3)天然に存在する炭素は12Cと13Cの2種類の同位体のみを含むとして、炭素の原子量を有効数字4桁まで求めよ。
(4)大気の二酸化炭素中には、放射性同位体である14Cが存在する。生物体は、生きている限り大気中と同じ存在比で14Cを保持しているが、死滅すると外界からの14Cの取り込みが停止する。ある地層から出土した木片の極微量の14Cの存在比を測定したところ、現在の存在比の1/4であることがわかった。この木は何年前まで生存していたかを推定し、有効数字3桁で答えよ。ただし、14Cの半減期は5700年とし、大気中の14Cの存在比は数万年前から現在まで一定であると仮定する。
(1)
β線を放出すると書かれているので、この時起こっているのはβ壊変。β壊変では中性子1つが陽子に変化するので、原子番号が1つ増加する。また「陽子数+中性子数=質量数」(詳しくは【原子の構造】陽子・中性子・電子・原子核・質量数・原子番号の数と関係を参照)なので、質量数は変化しない。
(2)
14Cの質量数は14。Cの原子番号は6なので、陽子の数は6、中性子の数は8となる(詳しくは【原子の構造】陽子・中性子・電子・原子核・質量数・原子番号の数と関係を参照)。
(3)
同位体の相対質量に、それぞれの存在比をかけて足す。
\[ \underbrace{12.0 × \frac{ 98.9 }{ 100 } }
_{ ^{ 12 }\text{ C }} +
\underbrace{13.0 × \frac{ 1.1 }{ 100 } }
_{ ^{ 13 }\text{ C }} = 12.011\]
約12になった。これが炭素の原子量である。
ちなみに、このような原子量計算をするときの有名な工夫がある。
\[ \begin{align}&12.0 × \frac{ 98.9 }{ 100 } + 13.0 × \frac{ 1.1 }{ 100 } \\
&= 12.0 × \frac{ 98.9 }{ 100 } + (12.0+1.00) × \frac{ 1.1 }{ 100 } \\
&= 12.0 × \frac{ 98.9 }{ 100 } + 12.0 × \frac{ 1.1 }{ 100 } + 1.00 × \frac{ 1.1 }{ 100 }\\
&= 12.0 × (\frac{ 98.9 }{ 100 } + \frac{ 1.1 }{ 100 }) + 1.00 × \frac{ 1.1 }{ 100 }\\
&= 12.0 × 1 + 1.00 × \frac{ 1.1 }{ 100 }\\
&= 12.0 + 0.011\\
&= 12.011\end{align}\]
同位体の存在比や原子量を使った計算について詳しくは次のページを参照のこと。
(4)
半減期はその同位体の存在比が半分になるまでに掛かる時間である。
したがって、存在比が1/4になっているということは半減期が二回訪れているはずなので…
\[ 5700×2=11400\]
答えは11400年(1.14×104年)となる。
放射性同位体まとめ
この『放射性同位体(例・一覧・各種壊変、入試問題の解き方など)』のページで解説した内容をまとめる。
- 原子核が”不安定”で放射線を出しながら崩壊(壊変)していくものがあり、このような同位体を放射性同位体という。
- 放射性同位体は遺物の年代測定に利用される。
- 放射性同位体が半分になるまでの時間を半減期という。
- α壊変が一回起こると原子番号は2減少、質量数は4減少する。
- β壊変が一回起こると質量数は変わらないが原子番号は1増加する。
- γ壊変では、質量数や原子番号に変化はない。
演習問題
陽子の数が同じで中性子の数が異なる原子同士を互いに【1】という。【1】の中には、不安定で【2】を出しながら壊れる(別の元素に変化する)ものがあり、それらを総称して【3】という。また、【2】を出す性質(能力)のことを【4】という。【3】が壊れて半分の量になる時間のことを【5】といい、これを利用して遺跡の年代測定などが行われる。
解答/解説:タップで表示
解答:【1】同位体【2】放射線【3】放射性同位体(ラジオアイソトープ)【4】放射能【5】半減期
同位体の中には原子核が”不安定”で放射線を出しながら崩壊(壊変)していくものがあり、このような同位体を放射性同位体という。
放射性同位体は遺物の年代測定などに利用される。具体例としては、放射性同位体である14Cを用いた遺跡の年代測定が挙げられる。
生きている木は、空気中に存在するの二酸化炭素から14Cが補給されるので、生体内の14Cの割合は一定に保たれる。しかし、枯れると14Cが補給されなくなり、14Cが放射線を出しながら減少していく。
枯れて地中に埋もれた木の14Cは、約5730年経過するごとに半分になっていく(半分になるまでの時間を半減期という)。















