MENU
電池の仕組み(イオン化傾向との関わり・正極と負極・電子と電流の向き)
目次
はじめに
【プロ講師解説】このページでは『電池の仕組み(イオン化傾向との関わり・正極と負極・電子と電流の向き)』について解説しています。
金属板の溶解
- 電池を学ぶ上で重要な「金属板の溶解」について説明する。
- 金属板を希硫酸(希H2SO4)に入れたときにどのような反応が起こるのか、考えてみよう。
Zn板の場合
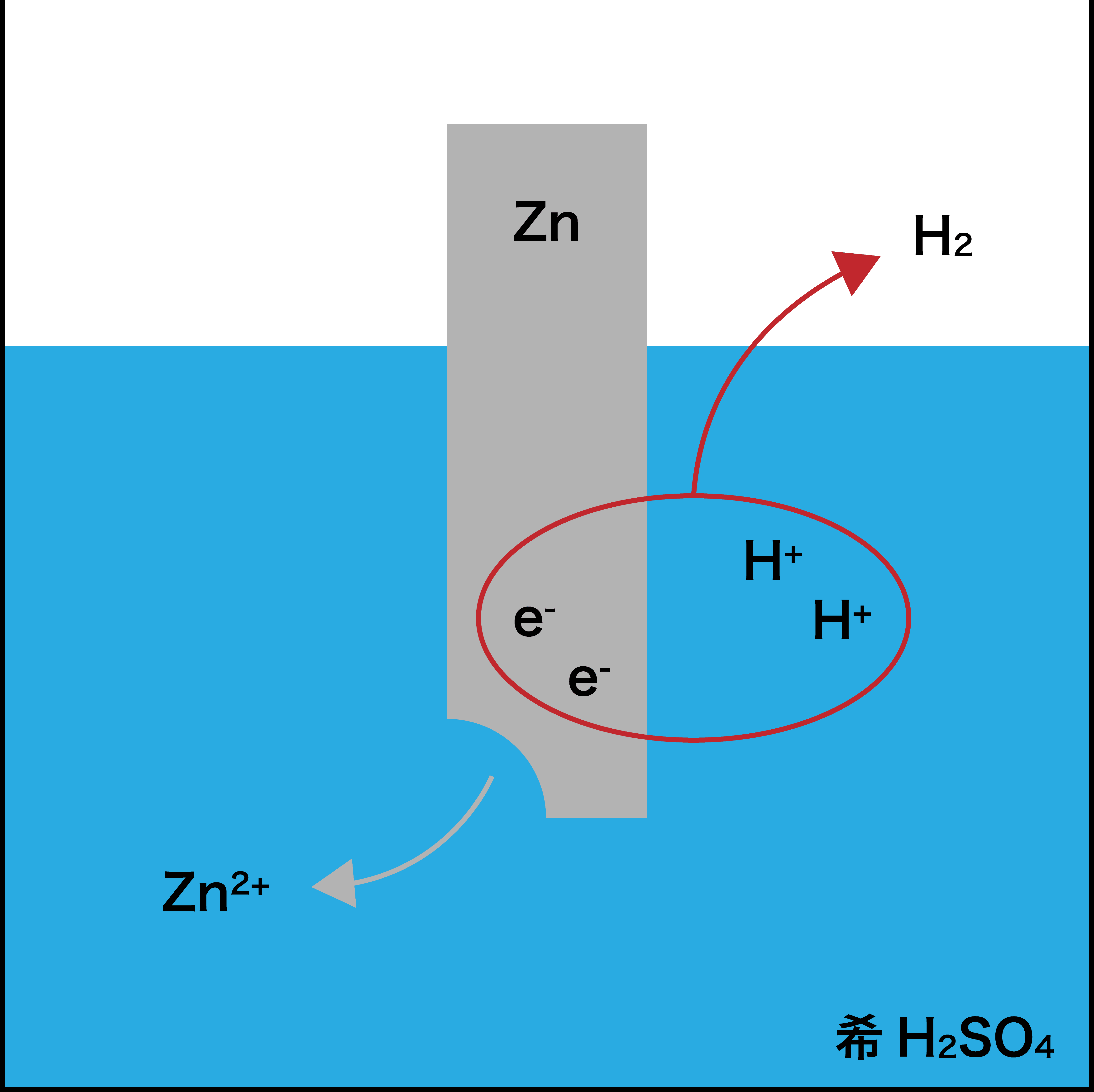
- Zn板を希H2SO4中に入れると、Zn板は融解しZn2+となる。
ZnがZn2+になることにより発生した2つのeーは、希H2SO4中に存在しているH+とくっつくことにより気体のH2となって外へ出ていく。 - この反応は「イオン化傾向の差」が原因となって起こる。
つまり、ZnとH2のイオン化傾向を比べたときに、よりイオン化傾向の大きなZnがイオンとなって溶け出し、イオン化傾向の小さなH2が気体となる。
Cu板の場合
- Cu板を希H2SO4中に入れても、(Zn板と異なり)全く変化が起こらない。
- これは、Cuのイオン化傾向がH2より低いためである。
電池とは
- 酸化還元反応を利用して電気エネルギーを取り出す装置を電池(又は化学電池)という。
- 酸化還元反応について詳しくは次のページを参照のこと。
電池の仕組み
- 電池の仕組みについて、次の3STEPで確認する。
●STEP1
イオン化傾向の大きい金属板が溶ける。
●STEP2
STEP1で発生した電子eーがもう片方の金属板の方へ流れる。
●STEP3
流れてきたeーが(溶液中の)イオン化傾向の小さい陽イオンとくっつく。
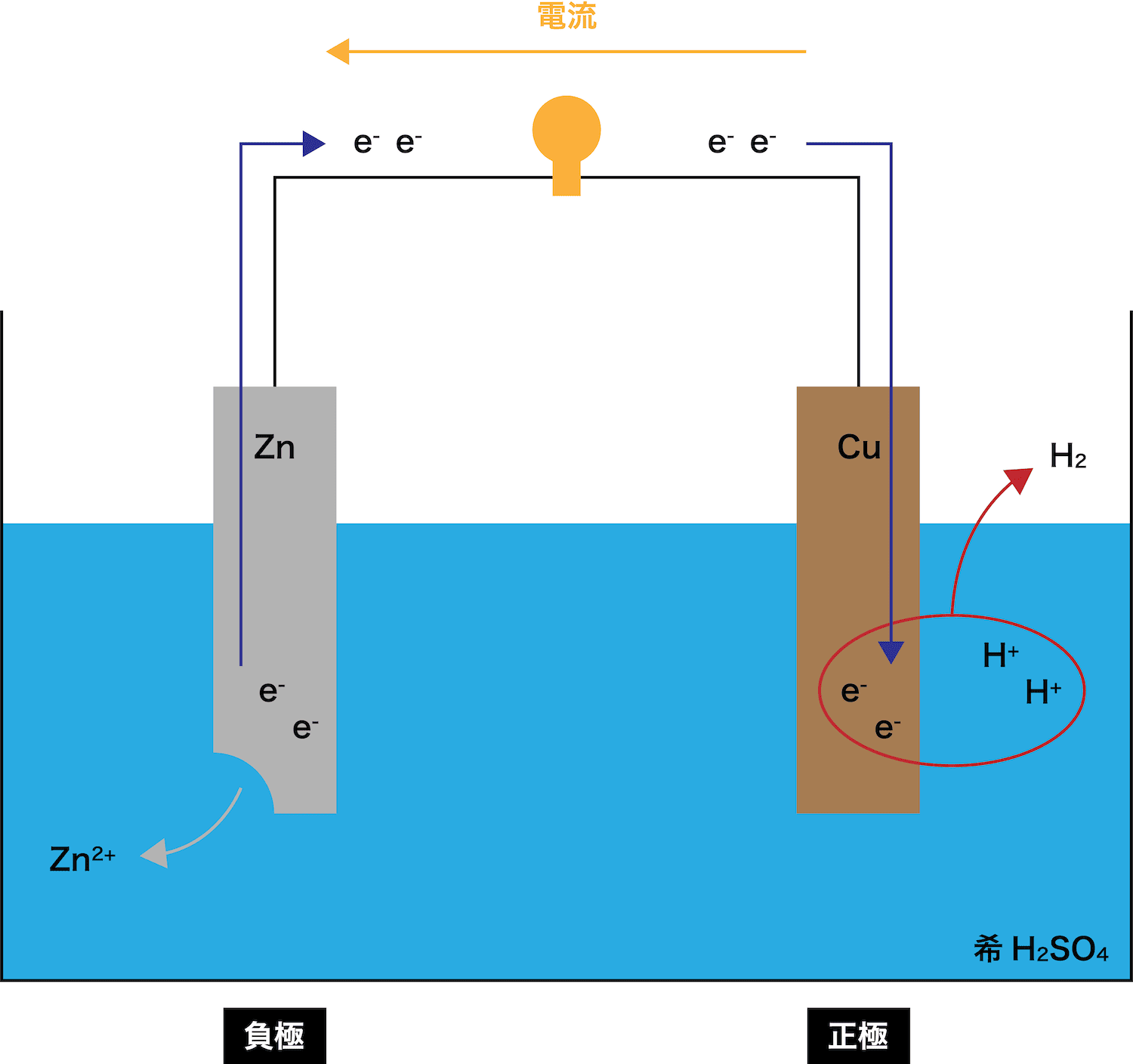
- 今回は最も基礎的な電池であるボルタ電池を例として用いる。
STEP
イオン化傾向の大きい金属板が溶ける。
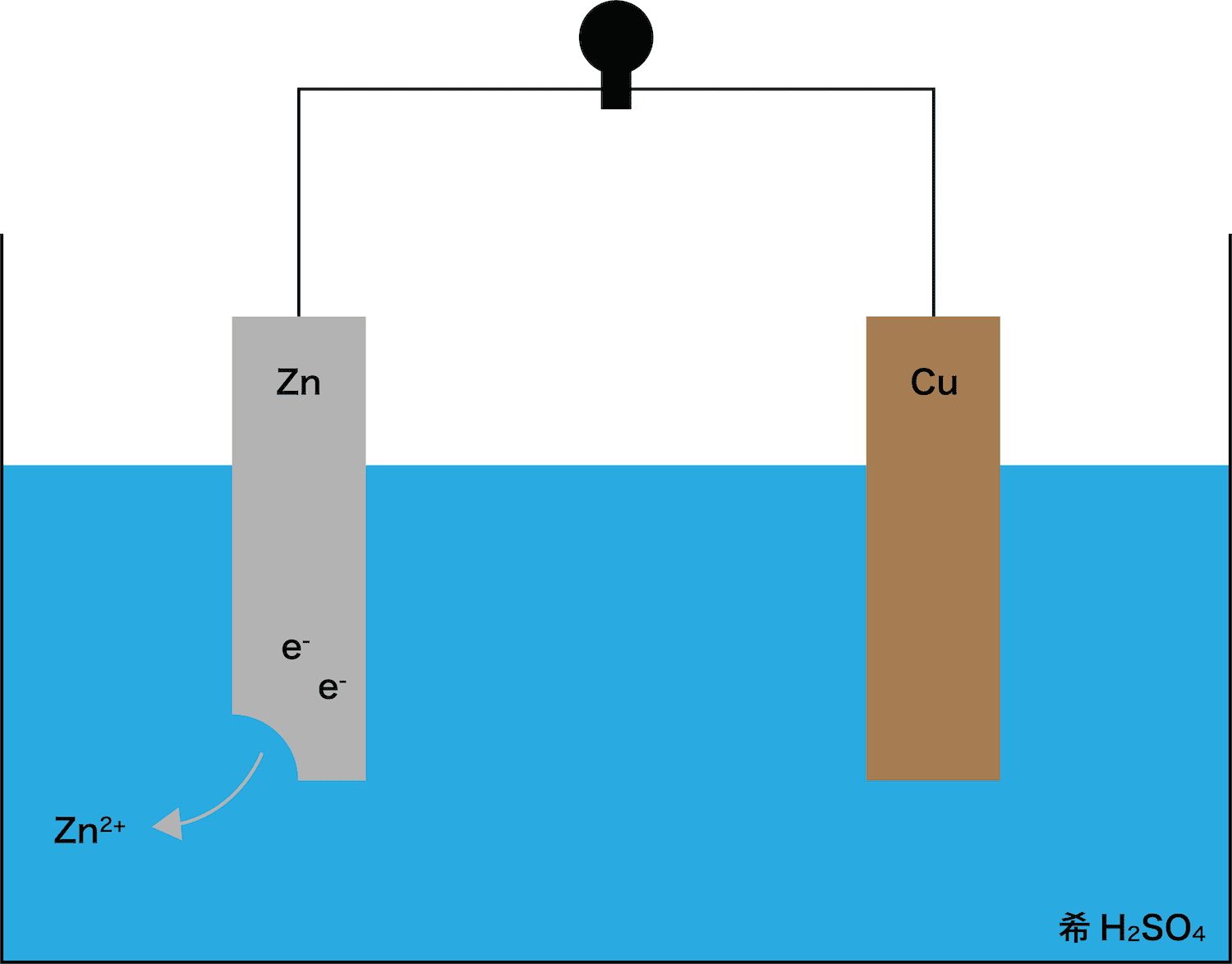
まずは、イオン化傾向の大きい金属板が溶ける。
ボルタ電池に使われている金属板はCuとZnであり、これらのうちイオン化傾向がより高いのはZnである。したがって、Zn板が溶け出す。
また、ZnがZn2+という陽イオンになったので、電子eーが発生していることも確認しておこう。
STEP
STEP1で発生した電子eーがもう片方の金属板の方へ流れる。

STEP1で発生した電子eーがCu板側に伝わる。
このとき、電子eーが通過することで(電流が発生して)豆電球が点灯していることに注目しよう。
STEP
流れてきたeーが(溶液中の)イオン化傾向の小さい陽イオンとくっつく。
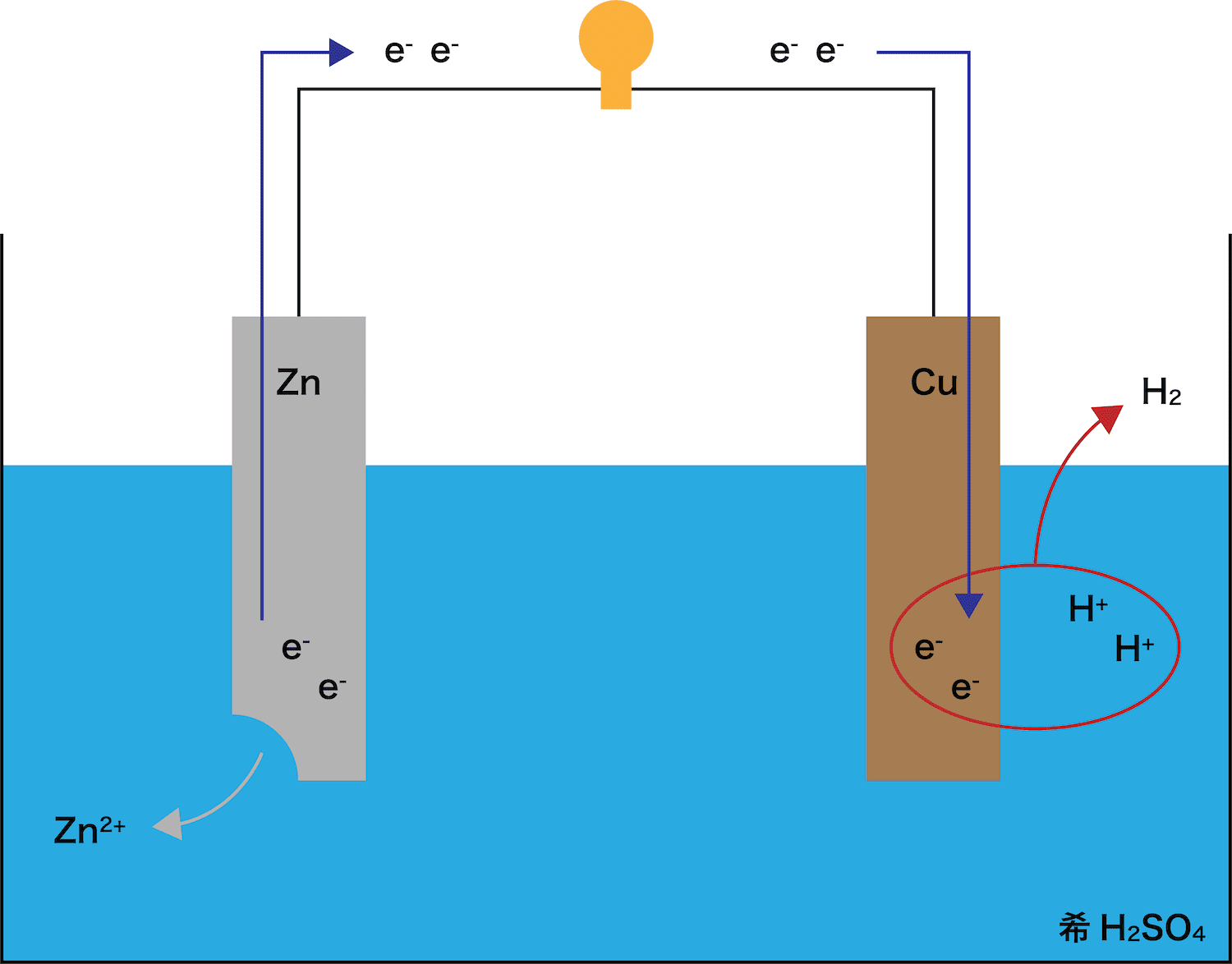
Cu板に流れてきた電子eーは、希H2SO4中に存在しているH+とくっつく。(=気体のH2発生)
正極と負極
- 電池で使われている2つの極板のうち、電子eーを出す方を負極、電子eーを受け取る方を正極という。
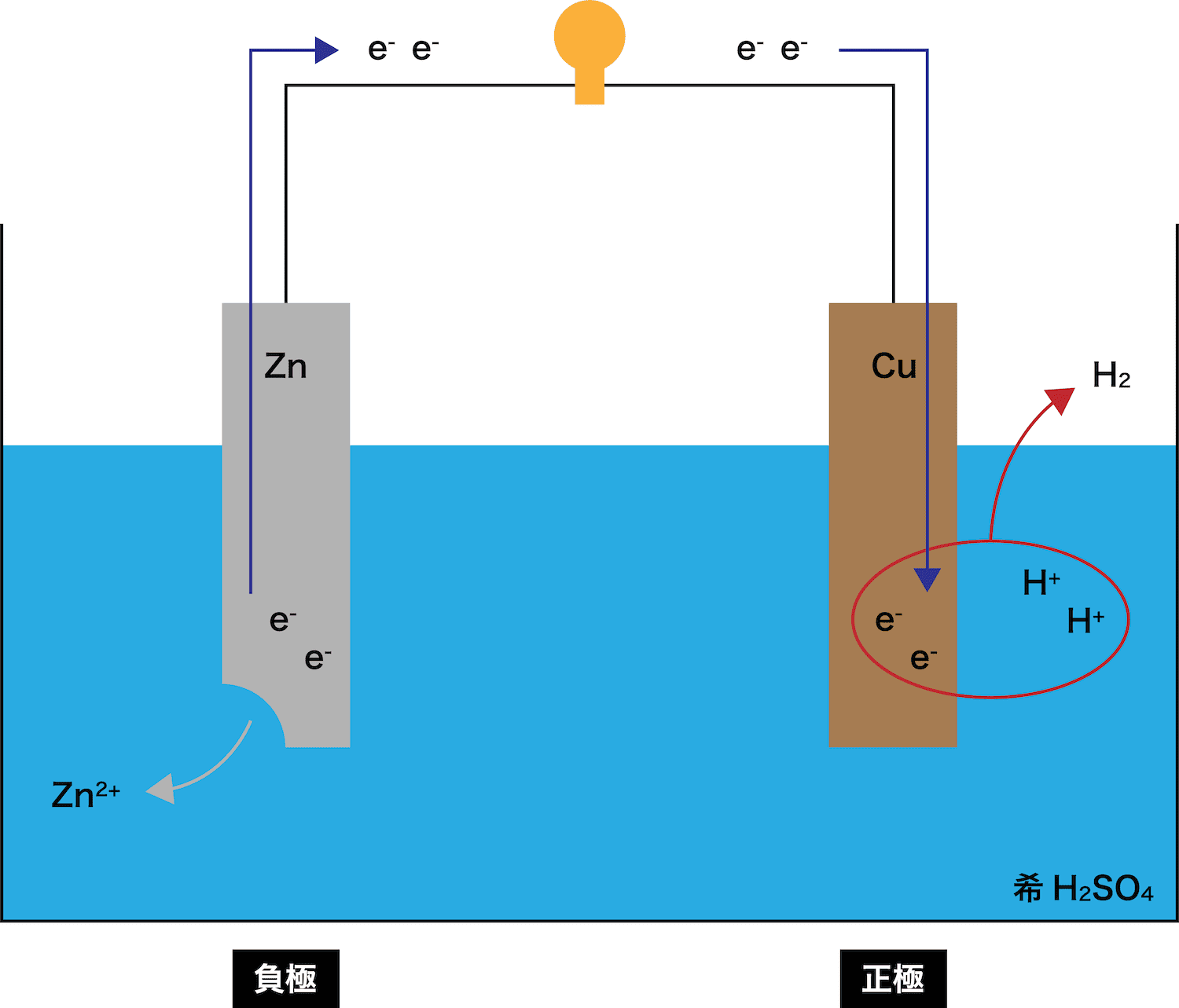
- これは先ほど例として使ったボルタ電池である。この電池で使われている2つの電極(ZnとCu)のうち、Zn板は電子eーを出しているため負極、Cu板は電子eーを受け取っているため正極となる。
- また、正極と負極の電位差のことを起電力ということも併せて覚えておこう。
電子と電流
- 電子eーの流れる向きと電流の流れる向きは「逆向き」である。
- つまり、電子eーは負極から正極へ流れるが、電流は反対に正極から負極へ流れる。