MENU
酸化・還元の定義〜水素・酸素・電子の3パターン〜
目次
はじめに
【プロ講師解説】このページでは『酸化・還元の定義〜水素・酸素・電子の3パターン〜』について解説しています。
電子eーに関する定義
- 電子eーに関する酸化・還元の定義は次の通りである。
| 酸化 | 電子eーを失う |
| 還元 | 電子eーを得る |
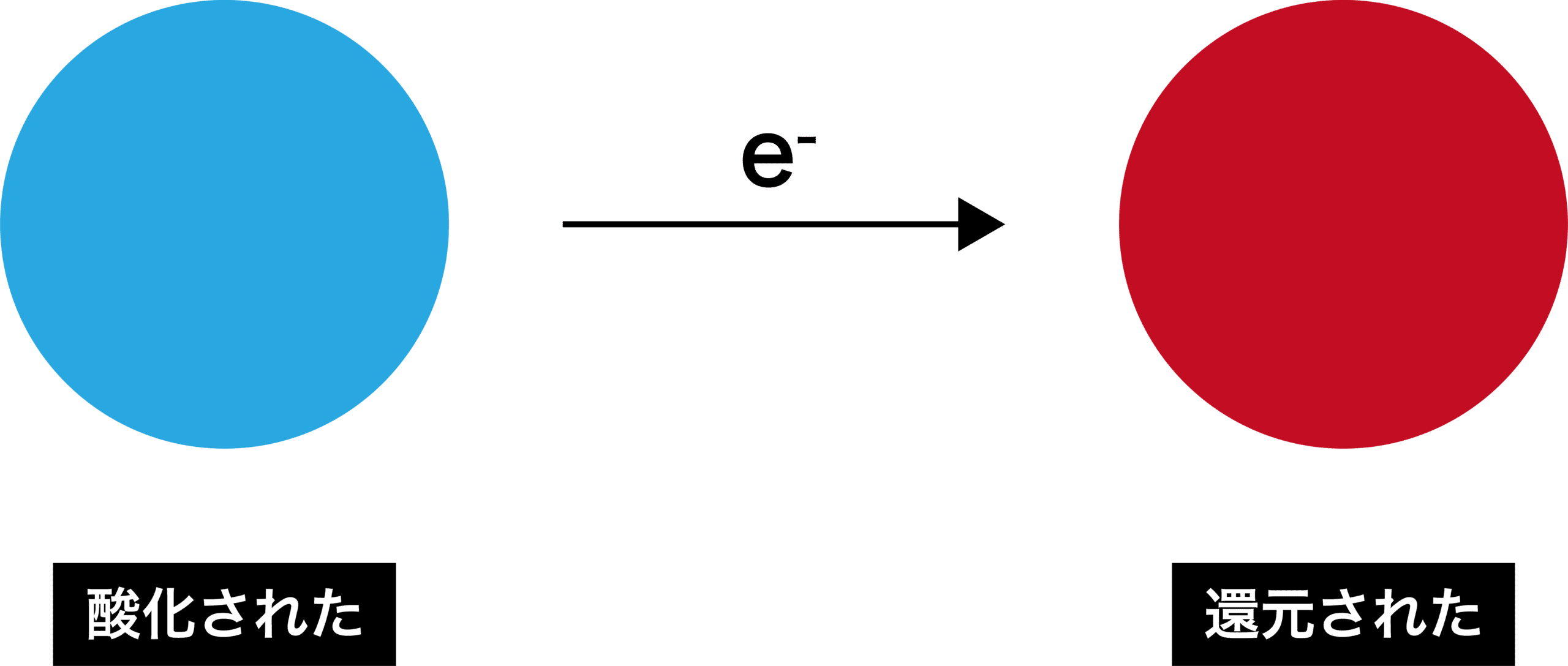
- 物質が電子eーを失うことを酸化、電子eーを得ることを還元という。
- また、電子eーを失った物質は「酸化された」、電子eーを得た物質は「還元された」という。
- 電子に関する定義の他に「酸素O原子を得ると酸化、失うと還元」「水素H原子を失うと酸化、得ると還元」という定義もあるが、これらはいずれも電子eーの移動を使って説明することができる。
酸素O原子に関する定義
- 酸素O原子に関する酸化・還元の定義は次の通りである。
| 酸化 | 酸素O原子を得る |
| 還元 | 酸素O原子を失う |
- 原子Aが酸素O原子と結合する場合を考える。酸素O原子は他の原子と比べて電気陰性度が大きいため、共有電子対は酸素O原子の方に引きつけられる。
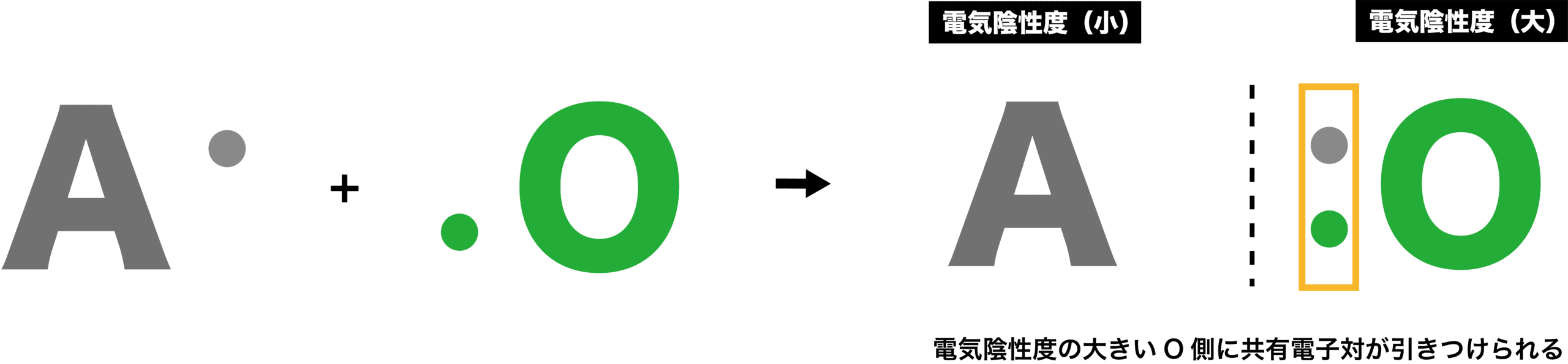
- よって、原子Aは酸素O原子に電子eーを奪われたことになるため、「酸素O原子と結合する(酸素O原子を得る)=電子eーを失う=酸化される」と考えることができる。
水素H原子に関する定義
- 水素H原子に関する酸化・還元の定義は次の通りである。
| 酸化 | 水素H原子を失う |
| 還元 | 水素H原子を得る |
- 原子Aが水素H原子と結合する場合を考える。水素H原子は多くの原子と比べて電気陰性度が小さいため、共有電子対は原子Aの方に引きつけられる。
- よって、「水素H原子が離れる」ということは、原子Aにとって手に入れたはずだった電子eーを失うことになる。

- よって、「水素H原子を失う=電子eーを失う=酸化される」と考えることができる。














