MENU
定比例の法則(発見者・例・グラフ・硫酸銅の問題の解き方など)
目次
はじめに
【プロ講師解説】このページでは『定比例の法則(発見者・例・グラフ・硫酸銅の問題の解き方など)』について解説しています。
定比例の法則とは
- 同じ1つの化合物では、その成分元素の質量組成は常に一定である。この法則を定比例の法則という。
- このページでは、例として酸化銅(Ⅱ)を使って解説する。
- 酸化銅(Ⅱ)は銅Cu原子1個と酸素O原子1個で形成されている。
- 酸化銅(Ⅱ)の質量と酸化銅(Ⅱ)に含まれる銅の質量の関係をグラフで表すと次のようになる。
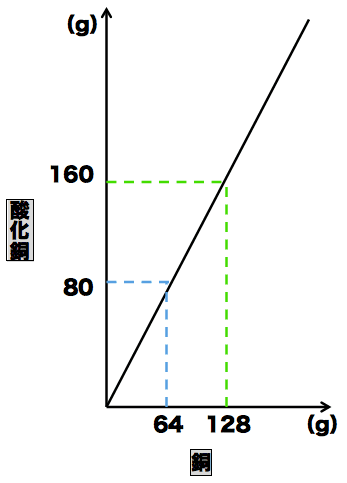
- このグラフにおいて、銅の質量が64のとき、酸化銅(Ⅱ)の質量は80になっている。また、酸化銅(Ⅱ)の質量から銅の質量を引くと酸素の質量も16と求めることができる。
- ここから、銅・酸素・酸化銅(Ⅱ)の質量の比は「64:16:80」=「4:1:5」となる。
- 次に、銅の質量が128のときを考える。グラフから酸化銅(Ⅱ)の質量は160だとわかる。酸化銅(Ⅱ)の質量から銅の質量を引いて、酸素の質量は32だとわかる。
- ここから、銅・酸素・酸化銅(Ⅱ)の質量の比は「128:32:160」=「4:1:5」となる。
- 酸化銅(Ⅱ)を構成する成分元素(銅と酸素)の質量が変化しても、質量の組成(比)は常に一定になっており、これが定比例の法則である。
定比例の法則の発見者・発見年
- 定比例の法則の発見者はジョゼフ・ルイ・ブルースト、発見した年は1799年である。
定比例の法則に関する問題
- 定比例の法則に関する問題の解き方について解説する。
問題
次のグラフを用いて、銅96gを完全燃焼させてできる酸化銅(Ⅱ)の質量を求めよ。

- 定比例の法則より、先ほど求めた銅・酸素・酸化銅(Ⅱ)の質量比は「4:1:5」なので、銅96gを完全燃焼させてできる酸化銅(Ⅱ)の質量をxとすると、次のような比例関係を導くことができる。
\[ 4:5 = 96:x \]
- これを解いて、x=120となる。
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
問1
定比例の法則について、簡単に説明せよ。
解答/解説:タップで表示
解答:下記参照
同じ1つの化合物では、その成分元素の質量組成は常に一定である。この法則を定比例の法則という。
問2
定比例の法則の発見者、発見した年を述べよ。
解答/解説:タップで表示
解答:ジョゼフ・ルイ・ブルースト/1799年
定比例の法則の発見者はジョゼフ・ルイ・ブルースト、発見した年は1799年である。














