MENU
ダニエル電池(仕組み・各極の反応式・素焼き版・起電力など)
目次
はじめに
【プロ講師解説】このページでは『ダニエル電池(仕組み・各極の反応式・素焼き版・起電力など)』について解説しています。
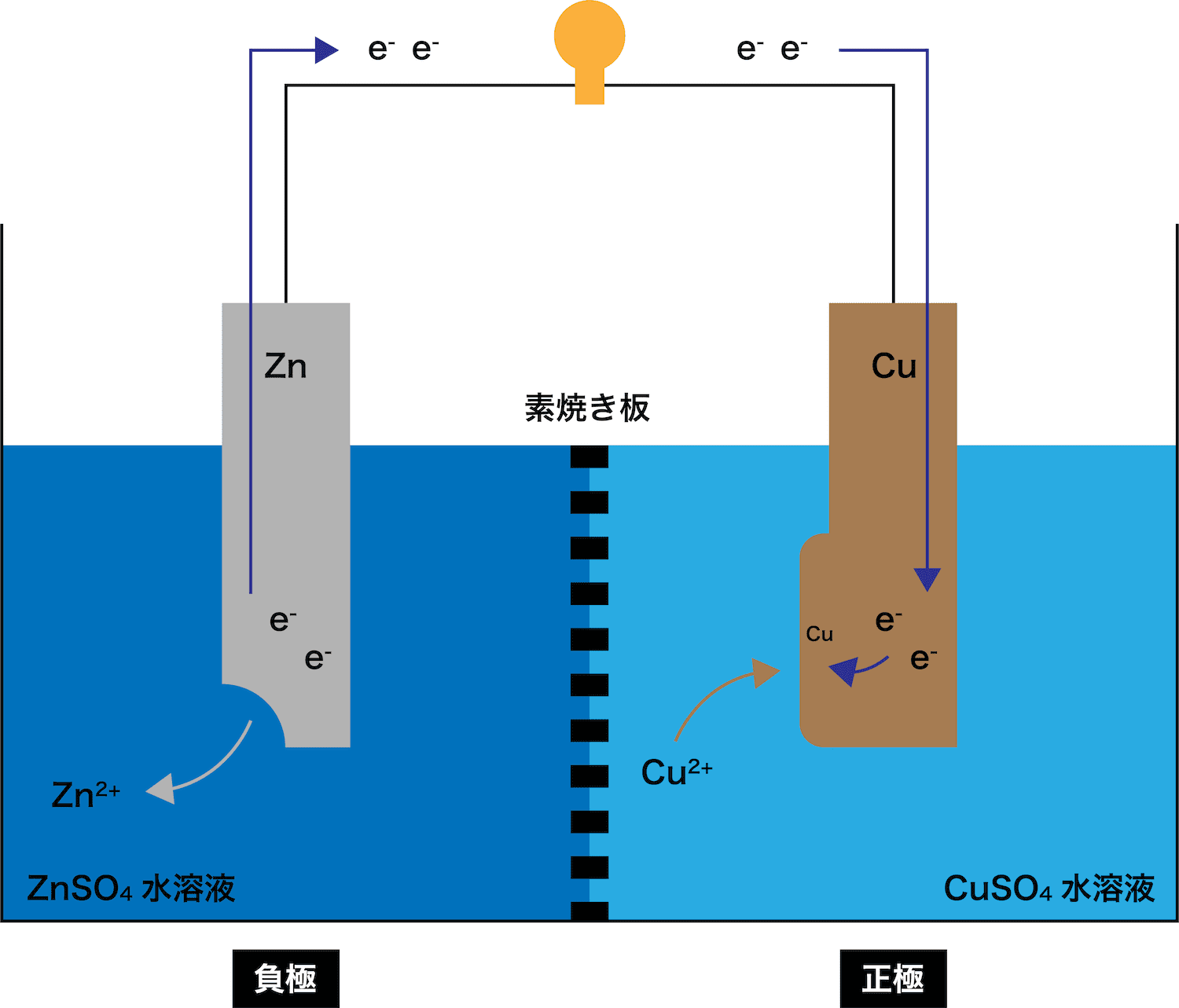
ダニエル電池とは
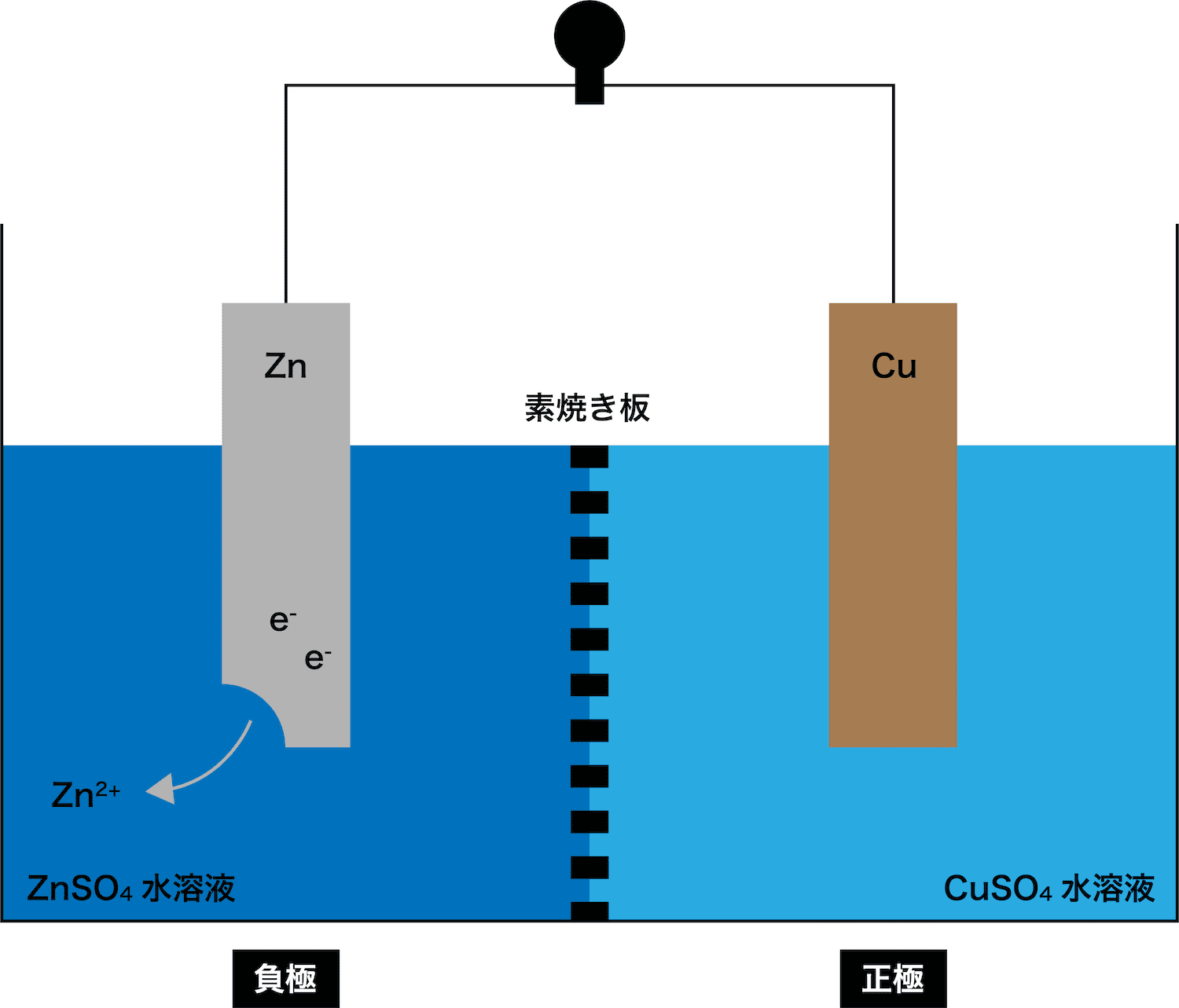
- 亜鉛Zn板を浸した硫酸亜鉛ZnSO4水溶液と、銅Cu板を浸した硫酸銅(Ⅱ)CuSO4水溶液を、素焼き板(セロハンでも可)で仕切った電池をダニエル電池という。
- ダニエル電池は、イギリス人であるダニエルが1836年に考案した電池が原形になっており、ボルタ電池の欠点を改善することによってつくられた、世界初の実用的な電池である。ダニエル電池の起電力は約1.1Vである。
ダニエル電池の電池式
- 上述の通り、ダニエル電池とは、亜鉛Zn板(負極)を浸した硫酸亜鉛ZnSO4水溶液と、銅Cu板を浸した硫酸銅(Ⅱ)CuSO4水溶液を、素焼き板で仕切った電池である。
- これを踏まえて、ダニエル電池の電池式は次のように表すことができる。
\[ \mathrm{(-)Zn|H_{2}SO_{4}aq|Cu(+)} \]
ダニエル電池の仕組み
- ダニエル電池の仕組みについて、電池の仕組み(イオン化傾向との関わり・正極と負極・電子と電流の向き)で紹介した3STEPを使って解説する。
●STEP1
イオン化傾向の大きい金属板が溶ける。
●STEP2
STEP1で発生した電子eーがもう片方の金属板の方へ流れる。
●STEP3
流れてきたeーが(溶液中の)イオン化傾向の小さい陽イオンとくっつく。
STEP
イオン化傾向の大きい金属板が溶ける。
まずは、イオン化傾向の大きい金属板が溶ける。
ダニエル電池に使われている金属板はCuとZnであり、これらのうちイオン化傾向がより高いのはZnである。したがって、Zn板が溶け出す。
また、ZnがZn2+という陽イオンになったので、電子eーが発生していることも確認しておこう。
STEP
STEP1で発生した電子eーがもう片方の金属板の方へ流れる。

STEP1で発生したeーがCu板側に伝わる。
このとき、eーが通過することで(電流が発生して)豆電球が点灯していることに注目しよう。
STEP
流れてきたeーが(溶液中の)イオン化傾向の小さい陽イオンとくっつく。

Cu板に流れてきたeーがCuSO4中に存在しているCu2+とくっつく。(=単体のCuが析出)
各極の反応
- ダニエル電池の負極・正極での反応をそれぞれまとめる。
負極
- ダニエル電池の負極では、Zn板が溶け出してZn2+とeーが発生する。
\[ \mathrm{Zn→Zn^{2+}+2e^{-}} \]
正極
- ダニエル電池の正極では、CuSO4中に存在しているCu2+がeーを受け取ることでCuが発生する。
\[ \mathrm{Cu^{2+}+2e^{-}→Cu} \]
ボルタ電池との違い
- ダニエル電池とボルタ電池の違いについて解説する。
- ボルタ電池とダニエル電池では、Zn板からCu板に向かって流れたeーを受け取る陽イオンが異なる。
●ボルタ電池
正極でeーを受け取るのはH+
●ダニエル電池
正極でeーを受け取るのはCu2+
| ボルタ電池 | ダニエル電池 |
|---|---|
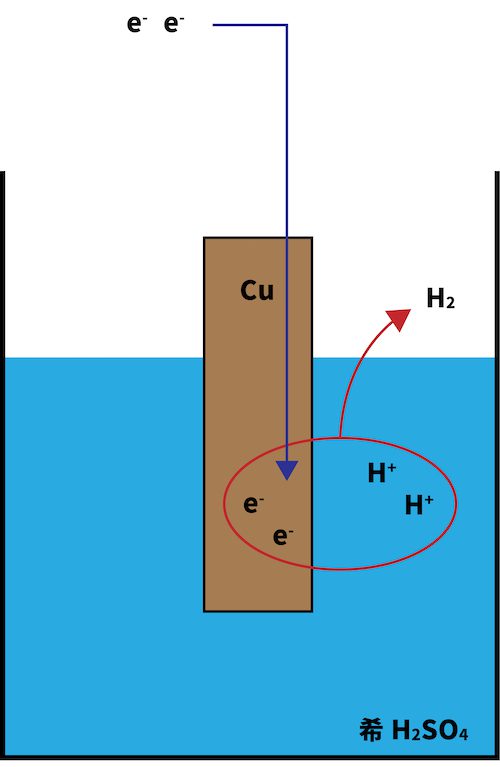 | 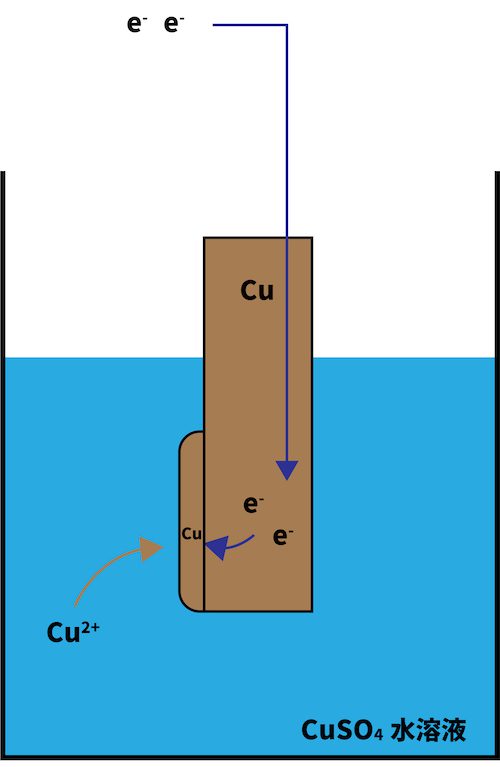 |
| ボルタ電池では、H+がeーを受け取ってH2になる。 ボルタ電池が分極を起こすのは、このH2がCu板の表面に溜まることで、次のH+がeーを受け取りづらくなってしまうためである。 | ダニエル電池では、Zn板からeーが流れてくると、Cu2+がこれを受け取って単体のCuとなる。 生成する物質(Cu)が電極と一緒なので、くっついたところでなにも変化が起きていないのと同じ。よって、分極が起こる心配はなく、継続的に電気を得ることができる。 |
素焼き版の役割
- ダニエル電池において、素焼き板は2つの重要な役割を担っている。
●素焼き板の役割①
2つの溶液を混ぜない
●素焼き板の役割②
電荷のバランスを保つ
素焼き板の役割①
- 素焼き板の1つ目の役割は「2つの溶液(ZnSO4とCuSO4)が混ざるのを防ぐ」というもの。
- 素焼き板はZnSO4とCuSO4を隔てる役割を果たしている。
素焼き板の役割②
- 素焼き板の2つ目の役割は「イオンを透過させることで、電荷のバランスを調整する」というもの。
- ダニエル電池を使い続けていると、負極では次第にZn2+が、正極ではSO42ーが増加していく。(正極でSO42ーが増えるのは、CUSO4から電離したCu2+がCuになることで、相方のSO42ーが余ってしまうため)
- このとき、陽イオンが増えた負極はプラス側に、陰イオンが増えた正極はマイナス側に電荷が偏っている。この「電荷の偏り」を調整するのが素焼き板である。

- 素焼き板はイオンを通す性質をもつので、Zn2+が素焼き板を通って正極側に、SO42ーが負極側に移動する。これによって、電気的なバランスが整えられる。
より大きな起電力を得るために
- ダニエル電池において、より大きな起電力を得るためには2つの重要なポイントがある。
●起電力UPのポイント①
ZnSO4の濃度を薄くしておく
●起電力UPのポイント②
CuSO4の濃度を濃くしておく
起電力UPのポイント①
- 1つ目のポイントは「ZnSO4の濃度を低くしておく」ということである。
- はじめから溶液中にZn2+がたくさんあると、(溶けて生成するZn2+の居場所がないため)Zn板が溶解しづらくなってしまう。
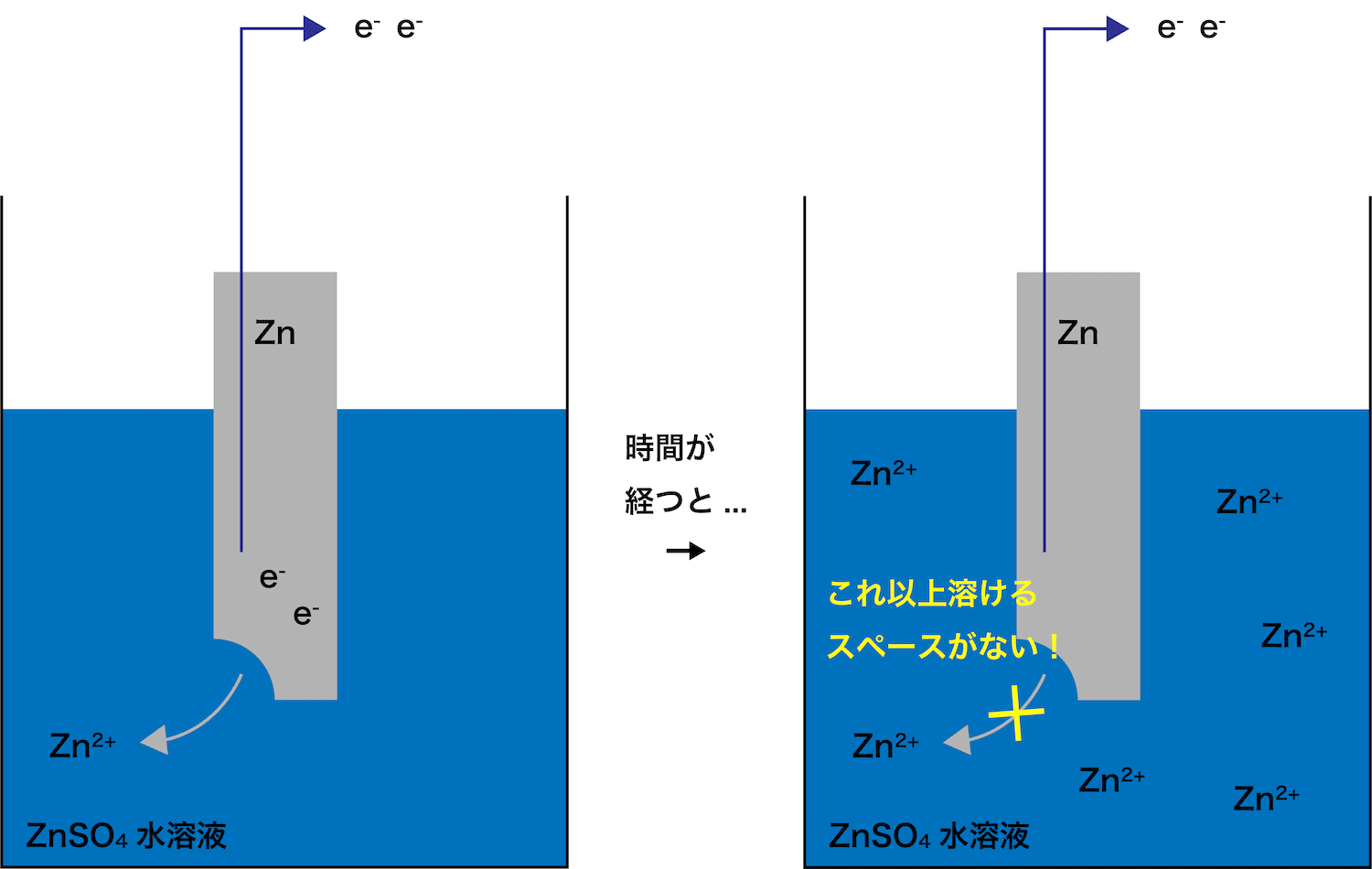
- したがって、より大きい起電力を得るためには「スタート時のZnSO4の濃度を低くしておきZn板をスムーズに溶解させる」ことが重要になる。
起電力UPのポイント②
- 2つ目のポイントは「CuSO4の濃度を高くしておく」ということである。
- 正極では、Cu2+がeーを受け取り単体のCuとなる。
したがって、スタート時に溶液中のCu2+が少ないと、はやい段階でCu2+を使い切ってしまう。
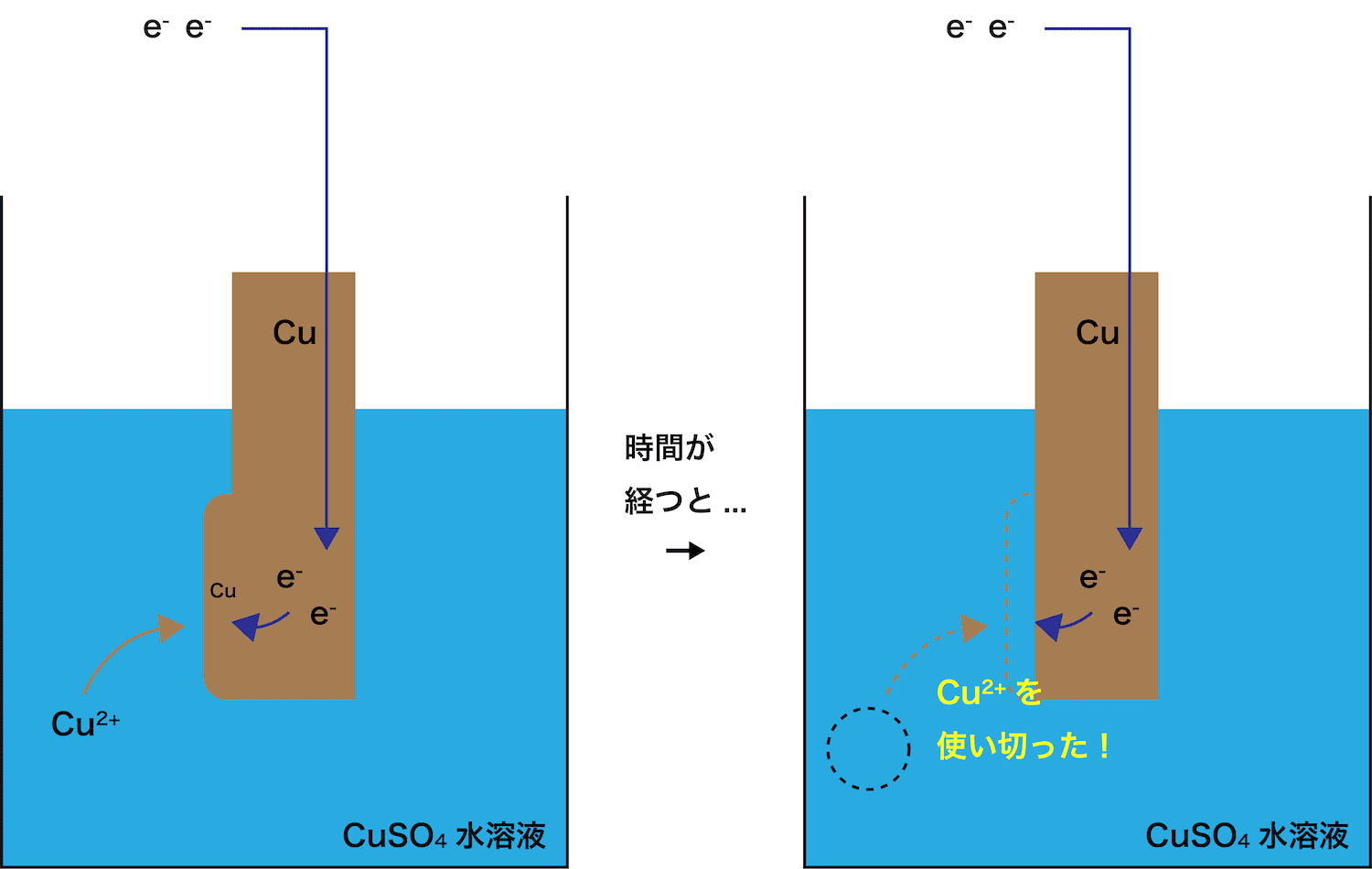
- Cu2+濃度が高ければ高いほど、たくさんのeーを受け取ることができる。














