MENU
ボルタ電池(仕組み・各極の反応・分極の理由など)
はじめに
【プロ講師解説】このページでは『ボルタ電池(仕組み・各極の反応・分極の理由など)』について解説しています。
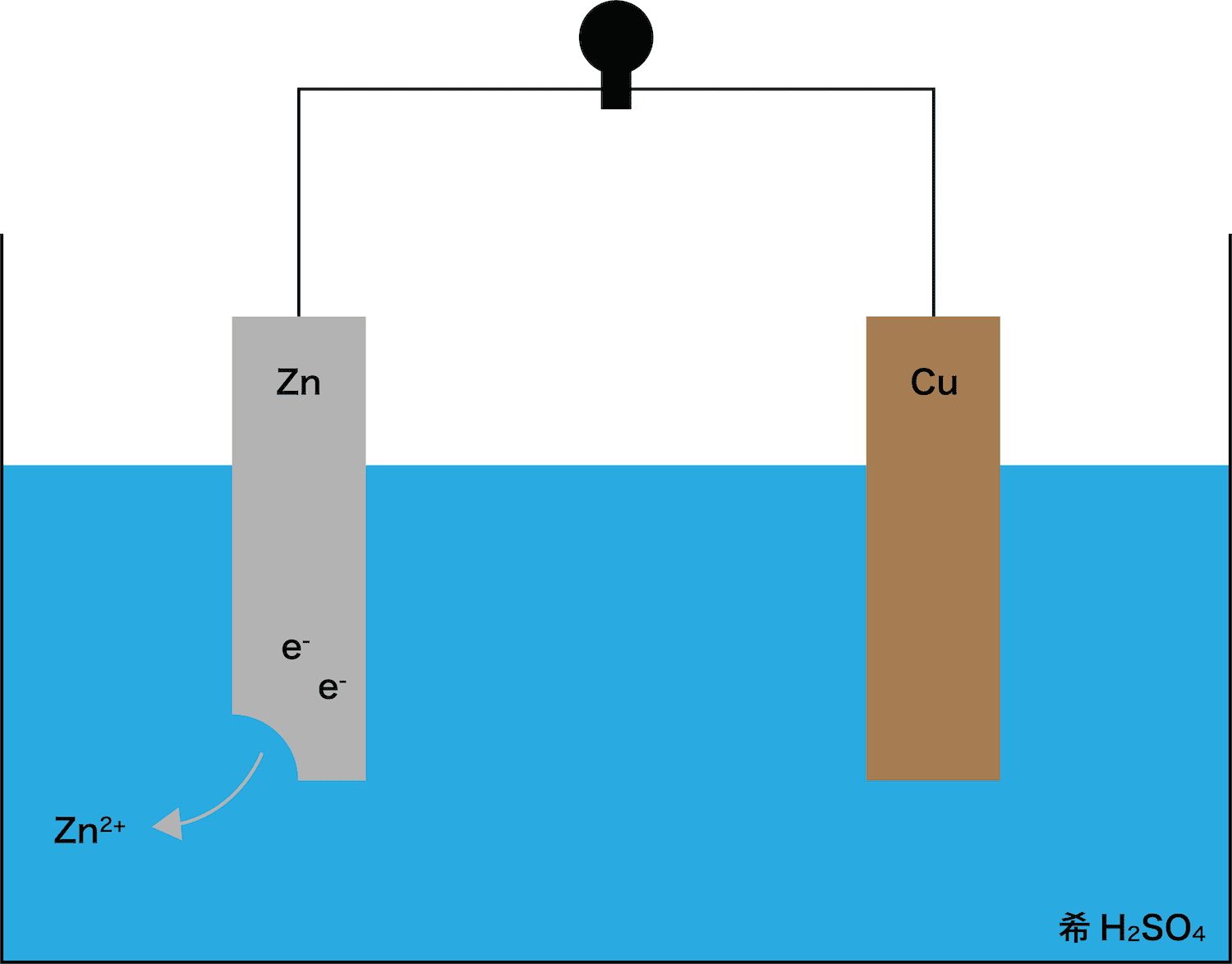
ボルタ電池とは
- 亜鉛Zn板と銅Cu板を希硫酸H2SO4に浸してできる電池をボルタ電池という。
- ボルタ電池は、イタリア人であるボルタが1800年に発明した電池が原形になっている。
ボルタ電池の電池式
- 上述の通り、亜鉛Zn板と銅Cu板を希硫酸H2SO4に浸してできる電池をボルタ電池という。
- これを踏まえて、ボルタ電池の電池式は次のように表すことができる。
\[ \mathrm{(-)Zn|H_{2}SO_{4}aq|Cu(+)} \]
ボルタ電池の仕組み
- ボルタ電池の仕組みについて、電池の仕組み(イオン化傾向との関わり・正極と負極・電子と電流の向き)で紹介した3STEPを使って解説する。
●STEP1
イオン化傾向の大きい金属板が溶ける。
●STEP2
STEP1で発生した電子eーがもう片方の金属板の方へ流れる。
●STEP3
流れてきたeーが(溶液中の)イオン化傾向の小さい陽イオンとくっつく。
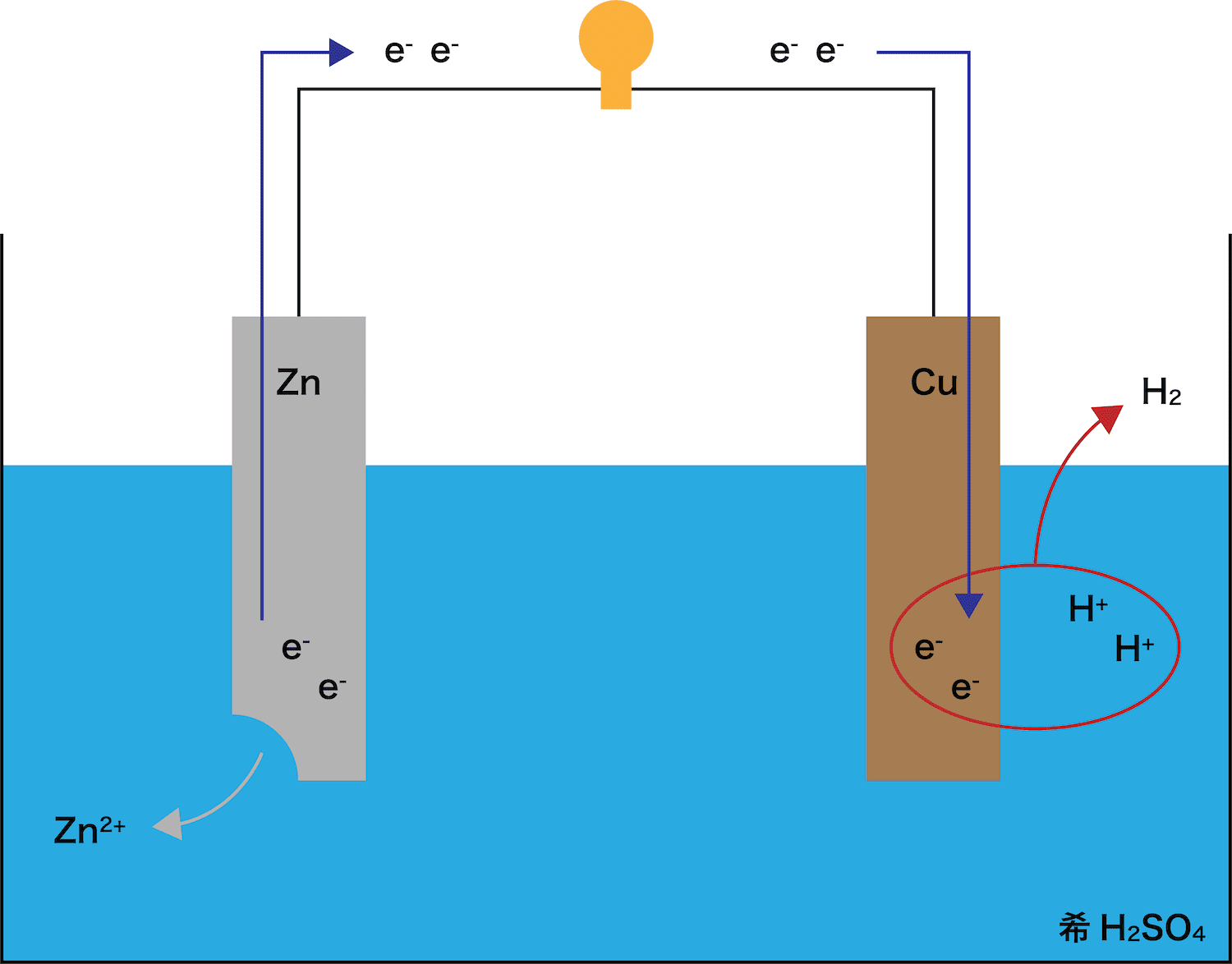
まずは、イオン化傾向の大きい金属板が溶ける。
ボルタ電池に使われている金属板はCuとZnであり、これらのうちイオン化傾向がより高いのはZnである。したがって、Zn板が溶け出す。
また、ZnがZn2+という陽イオンになったので、電子eーが発生していることも確認しておこう。

STEP1で発生したeーがCu板側に伝わる。
このとき、eーが通過することで(電流が発生して)豆電球が点灯していることに注目しよう。

Cu板に流れてきたeーは、希H2SO4中に存在しているH+とくっつく。(=気体のH2発生)
各極の反応
- ボルタ電池の負極・正極での反応をそれぞれまとめる。
負極
- ボルタ電池の負極では、Zn板が溶け出してZn2+とeーが発生する。
\[ \mathrm{Zn→Zn^{2+}+2e^{-}} \]
正極
- ボルタ電池の正極では、H2SO4中に存在しているH+がeーを受け取ることでH2が発生する。
\[ \mathrm{2H^{+}+2e^{-}→H_{2}} \]
ボルタ電池の問題点
- ボルタ電池では、正極で気体の水素H2を発生する。
- ボルタ電池を使い続けるとこのH2がCu板の周りに溜まってくる。
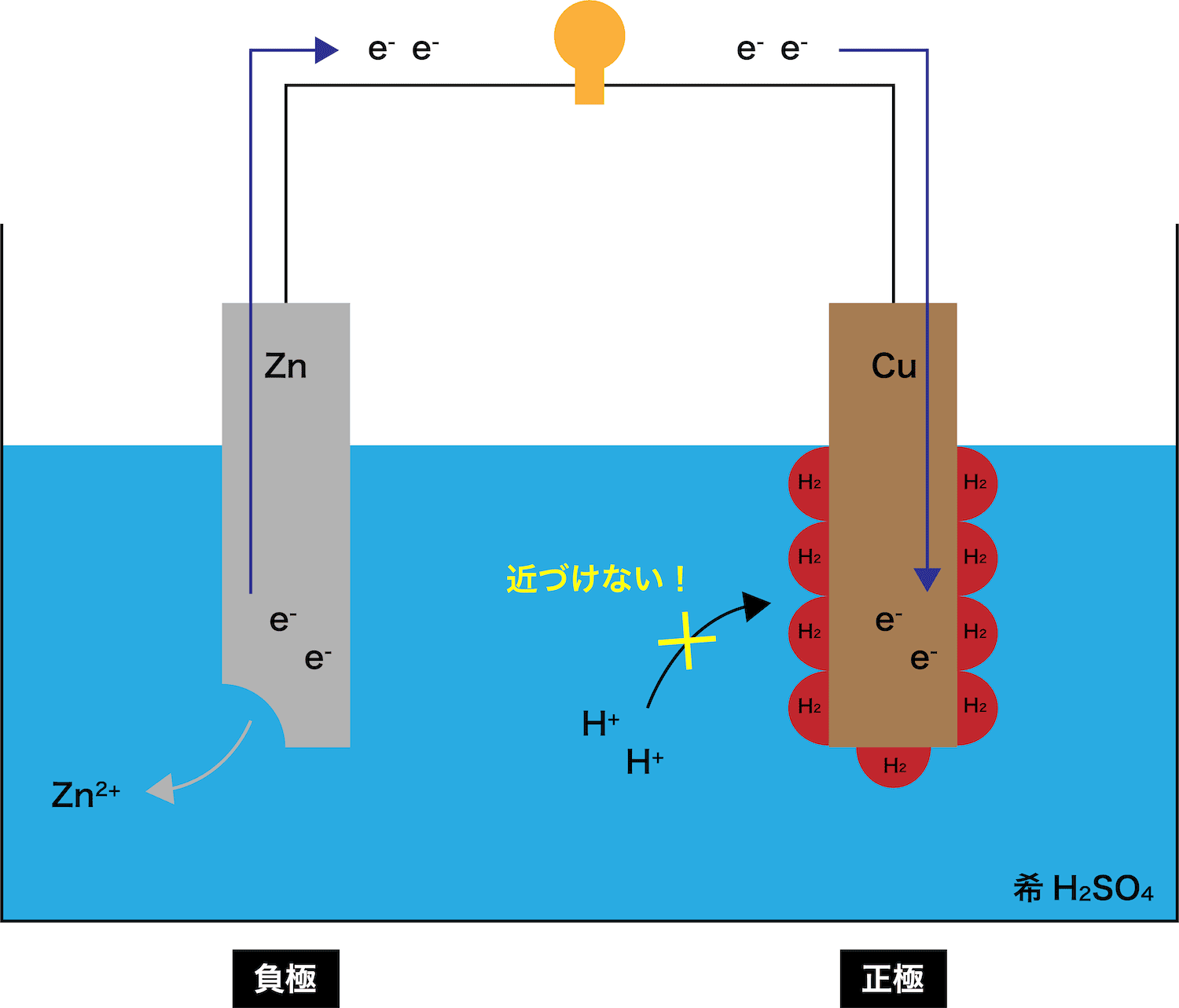
- 溜まったH2は、水溶液中のH+が負極からやってきたeーを受け取るのを妨害してしまう。
- その結果、電子の受け渡しに不具合が生じ、電圧が急激に低下する分極とよばれる現象が起こる。
- 分極を防ぐためには、過酸化水素H2O2などの減極剤を溶液に加える必要がある。
ボルタ電池まとめ
この『ボルタ電池(仕組み・各極の反応・分極の理由など)』のページで解説した内容をまとめる。
- 亜鉛Zn板と銅Cu板を希硫酸H2SO4に浸してできる電池をボルタ電池という。
- ボルタ電池の電池式は次のように表される。
\[ \mathrm{(-)Zn|H_{2}SO_{4}aq|Cu(+)} \]
- ボルタ電池の負極では、Zn板が溶け出してZn2+とeーが発生する。
\[ \mathrm{Zn→Zn^{2+}+2e^{-}} \]
- ボルタ電池の正極では、H2SO4中に存在しているH+がeーを受け取ることでH2が発生する。
\[ \mathrm{2H^{+}+2e^{-}→H_{2} }\]
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
ボルタ電池の負極は【1】板、正極は【2】板である。
解答/解説:タップで表示
解答:【1】亜鉛Zn【2】銅Cu
ボルタ電池の負極は亜鉛Zn板、正極は銅Cu板である。
ボルタ電池の電池式は次の通りである。
(ー)Zn|【1】|Cu(+)
解答/解説:タップで表示
解答:【1】H2SO4
亜鉛Zn板と銅Cu板を希硫酸H2SO4に浸してできる電池をボルタ電池という。
これを踏まえて、ボルタ電池の電池式は次のように表すことができる。
\[ \mathrm{(-)Zn|H_{2}SO_{4}aq|Cu(+)} \]
ボルタ電池では、まずイオン化傾向のより【1(大き or 小さ)】い亜鉛板が溶け出し【2】となる。このとき放出された【3】は銅板側に伝わる。銅板側で【3】を希H2SO4中の【4】が受け取り【5】が発生する。
解答/解説:タップで表示
解答:【1】大き【2】亜鉛イオンZn2+【3】電子e–【4】水素イオンH+【5】水素H2
ボルタ電池では、まずイオン化傾向のより大きい亜鉛板が溶け出し亜鉛イオンZn2+となる。このとき放出された電子eーは銅板側に伝わる。銅板側でeーを希H2SO4中の水素イオンH+が受け取り水素H2が発生する。
ボルタ電池の負極で起こる変化を電子eーを用いた反応式で表せ。
解答/解説:タップで表示
解答:Zn → Zn2+ + 2e–
ボルタ電池の負極では、Zn板が溶け出してZn2+とeーが発生する。
\[ \mathrm{Zn→Zn^{2+}+2e^{-}} \]
ボルタ電池の正極で起こる変化を電子eーを用いた反応式で表せ。
解答/解説:タップで表示
解答:2H+ + 2e– → H2
ボルタ電池の正極では、H2SO4中に存在しているH+がeーを受け取ることでH2が発生する。
\[ \mathrm{2H^{+}+2e^{-}→H_{2}} \]
ボルタ電池では【1】が原因となり、時間が経つと起電力が低下する。
解答/解説:タップで表示
解答:【1】分極
ボルタ電池では分極が原因となり、時間が経つと起電力が低下する。
ボルタ電池の分極を防ぐためには、H2O2などの【1】を溶液に加える必要がある。
解答/解説:タップで表示
解答:【1】減極剤
ボルタ電池の分極を防ぐためには、H2O2などの減極剤を溶液に加える必要がある。














