MENU
【図解】水和・水和物(定義・例・原理・仕組みなど)
はじめに
【プロ講師解説】このページでは『コロイド(例・種類・大きさ・透析・電気泳動など)』について解説しています。
水和の原理
- 水分子が溶質の分子やイオンと強く引き合うことを水和という。
例)塩化ナトリウムNaCl
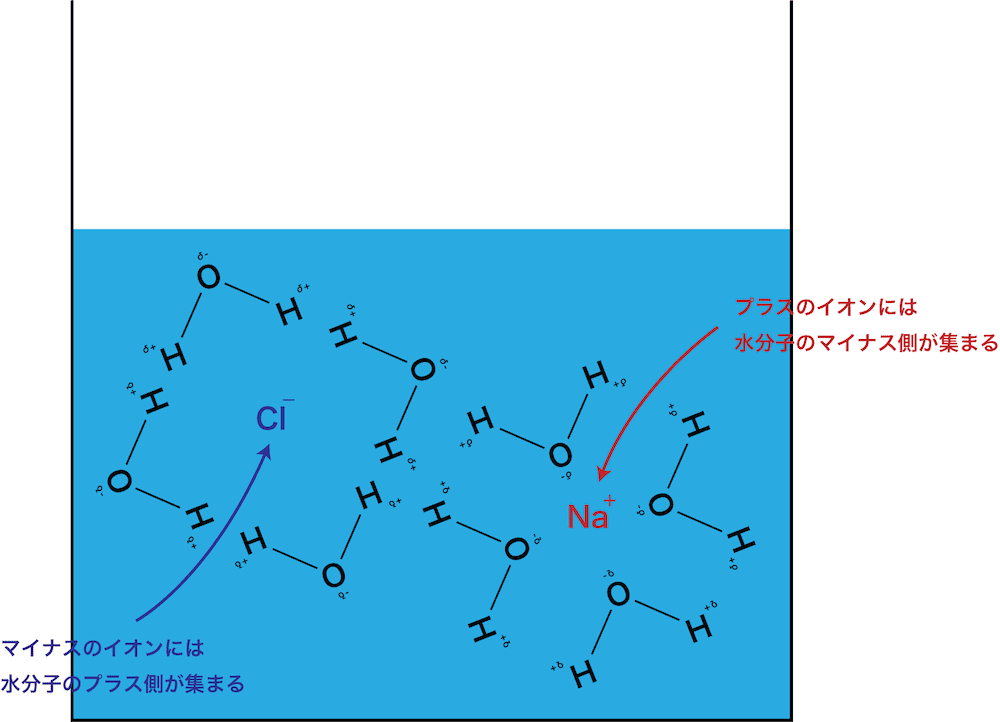
- 水和しているイオンを水和イオン、水和している分子を水和分子という。また、水和している陽イオンを水和陽イオン、水和している陰イオンを水和陰イオンとよぶこともある。
- 水和は、主に電気陰性度(極性)が原因となって起こる現象である。
- 水分子は極性分子であり、分子内の一部はややプラスに、一部はややマイナスに電荷が偏っている。
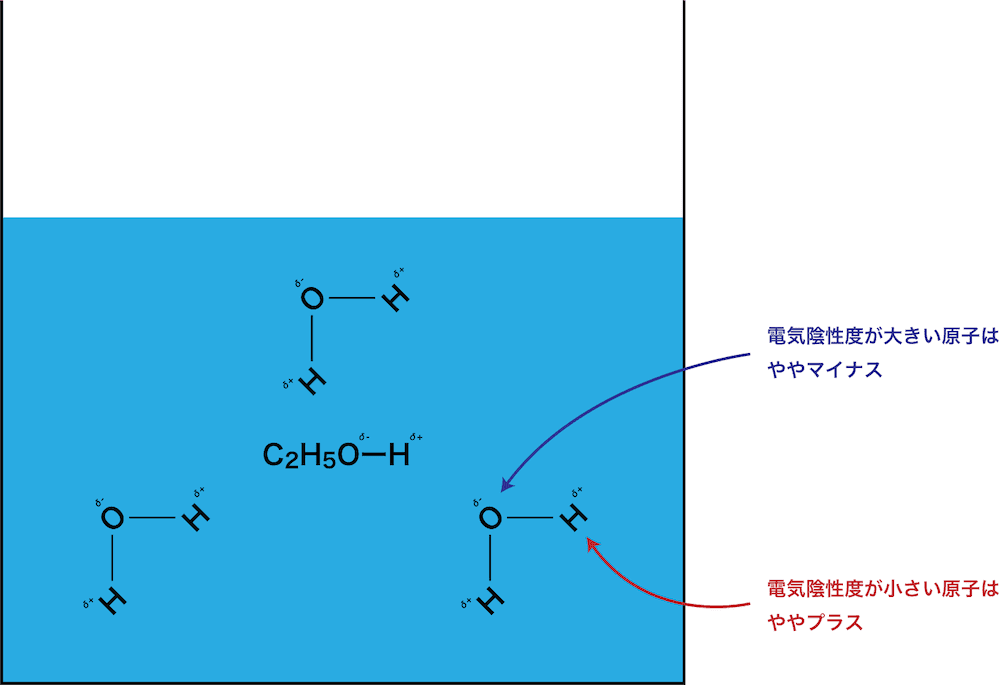
- NaClは水の中で次のように電離している。
\[ \mathrm{NaCl → Na^{+}+Cl^{-}} \]
- 電離により生じるナトリウムイオンNa+と塩化物イオンClーの周りには、それぞれ水分子のδー部分とδ+部分が近づいてくる。

- その結果、いわゆる”水和”した状態となり、ナトリウムイオンNa+とClーは引き離される。
水和物とは
- 水和水が分子にくっついたものを水和物という。
- 例えば、高校化学で頻出の水和物である硫酸銅五水和物の化学式は次の通りである。
\[ \mathrm{CuSO_{4}・5H_{2}O} \]
硫酸銅五水和物
- 硫酸銅(Ⅱ)水溶液を冷却して得られる結晶は、CuSO4:H2O=1:5の物質量比からなる。この結晶を硫酸銅五水和物という。
- 先述の通り、硫酸銅五水和物の化学式は次の通りである。
\[ \mathrm{CuSO_{4}・5H_{2}O} \]
- また、硫酸銅五水和物の構造は次の通りである。
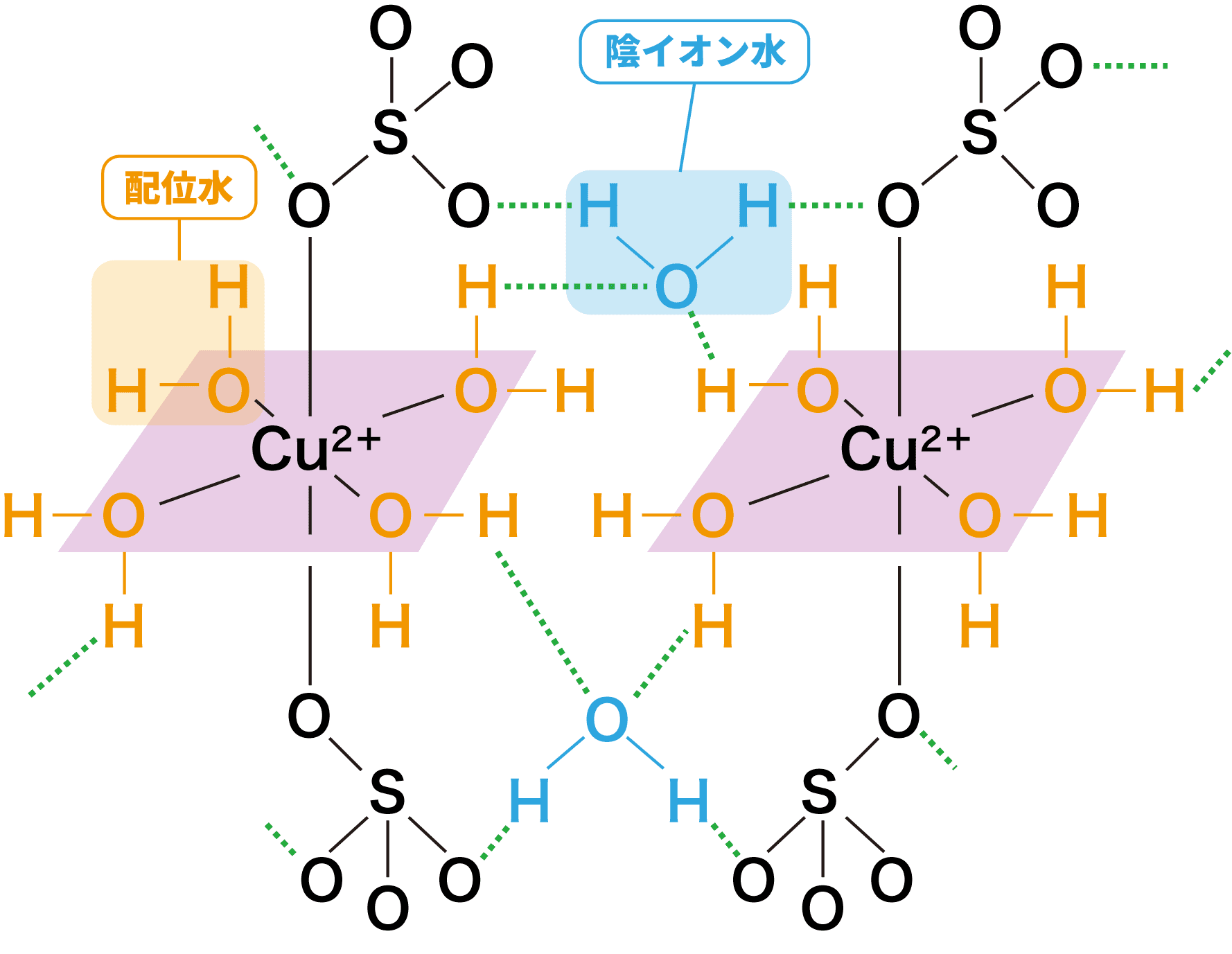
硫酸銅水和物の構造を覚えておく必要はありませんが、硫酸銅五水和物が絡んだ問題は入試頻出です。理論化学や無機化学における「硫酸銅五水和物が絡んだ問題」をまとめた次のページは必ず確認しておきましょう。
参考:硫酸銅五水和物(化学式・構造式・頻出問題の解法など)
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
水分子が溶質の分子やイオンと強く引き合うことを【1】という。
解答/解説:タップで表示
解答:【1】水和
水分子が溶質の分子やイオンと強く引き合うことを水和という。
水和しているイオンを【1】、水和している分子を【2】という。
解答/解説:タップで表示
解答:【1】水和イオン【2】水和分子
水和しているイオンを水和イオン、水和している分子を水和分子という。また、水和している陽イオンを水和陽イオン、水和している陰イオンを水和陰イオンとよぶこともある。
水分子は【1(極性or無極性)】分子であり、塩化ナトリウムNaClを入れると水H2O分子の水素H原子が【2】イオンを、酸素O原子が【3】イオンを取り囲み、いわゆる”溶けた”状態になる。
解答/解説:タップで表示
解答:【1】極性【2】塩化物イオン【3】ナトリウムイオンNa
NaClは水の中で次のように電離している。
\[ \mathrm{NaCl → Na^{+}+Cl^{-}} \]
電離により生じるナトリウムイオンNa+と塩化物イオンClーの周りには、それぞれ水分子のδー部分とδ+部分が近づいてくる。

その結果、いわゆる”水和”した状態となり、ナトリウムイオンNa+とClーは引き離される。
水和水が分子にくっついたものを【1】といい、代表的な【1】である硫酸銅五水和物の化学式は【2】である。
解答/解説:タップで表示
解答:【1】水和物【2】CuSO4・5H2O
硫酸銅(Ⅱ)水溶液を冷却して得られる結晶は、CuSO4:H2O=1:5の物質量比からなる結晶で、この結晶を硫酸銅五水和物という。硫酸銅五水和物の化学式は次のようになる。
\[ \mathrm{CuSO_{4}・5H_{2}O} \]














