MENU
硫酸銅五水和物(化学式・構造式・頻出問題の解法など)
目次
はじめに
【プロ講師解説】このページでは『硫酸銅五水和物(化学式・構造式・頻出問題の解法など)』について解説しています。
硫酸銅五水和物とは
- 硫酸銅(Ⅱ)水溶液を冷却して得られる結晶は、CuSO4:H2O=1:5の物質量比からなる。この結晶を硫酸銅(Ⅱ)五水和物といい、化学式は次の通りである。
\[ \mathrm{CuSO_{4}・5H_{2}O} \]
- また、硫酸銅(Ⅱ)五水和物CuSO4・5H2Oの構造は次の通りである。
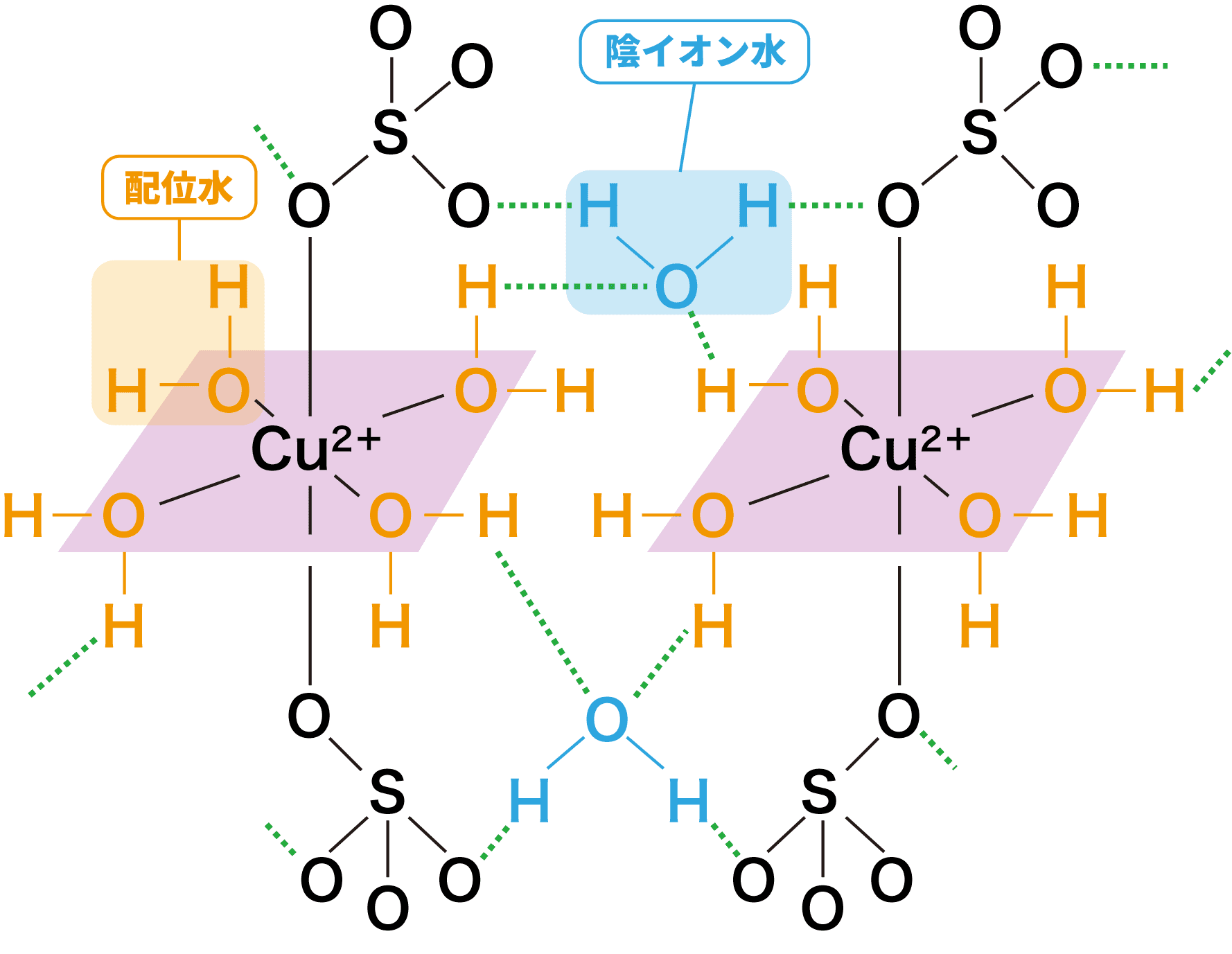
- 結晶に含まれる水和水のうち、4個は中心のCu2+に対し正方形の頂点方向から強く配位結合し、錯イオンである[Cu(H2O)4]2+を形成する(この4個の水和水は配位水とよばれる)。
- また、平面からやや距離が離れたところに硫酸イオンSO42ーが存在し、これもCu2+に弱く配位結合している。
- 残る1個の水和水は、[Cu(H2O)4]2+とSO42ーの隙間に存在し、[Cu(H2O)4]2+中の配位水とSO42ーに水素結合している(この1個の水和水を陰イオン水という)。
参考:配位結合(例・強さ・共有結合との違い・錯イオンとの関係など)
参考:【図解】水和・水和物(定義・例・原理・仕組みなど)
硫酸銅五水和物が絡んだ入試問題
- 硫酸銅五水和物関連の入試頻出問題をいくつか紹介する。
【理論】固体の溶解度絡みの問題
問題
(1)硫酸銅(Ⅱ)五水和物100g中に含まれる硫酸銅(Ⅱ)は何gか。(H=1,O=16,S=32,Cu=64)
(2)80℃の硫酸銅(Ⅱ)飽和水溶液100gを20℃まで冷却すると、硫酸銅(Ⅱ)五水和物の結晶が析出した。この結晶の質量は何gか。ただし、硫酸銅(Ⅱ)の溶解度は20℃で20、80℃で56とする。
(1)
- 硫酸銅(Ⅱ)五水和物の化学式はCuSO4・5H2Oである。したがって、硫酸銅(Ⅱ)五水和物の式量は次のように求めることができる。
\[ \underbrace{
\underbrace{ \mathrm{CuSO_{4}} }
_{ \text{ 160 }}
・
\underbrace{ \mathrm{5H_{2}O} }
_{ \text{ 90 }}
}
_{ \text{ 250 }}
\]
- Cu・S・Oの原子量はそれぞれ64、32、16のためCuSO4は160、H・Oの原子量はそれぞれ1、16のため5H2Oは90、これらを足し合わせるとCuSO4・5H2Oの式量は250となる。
- 硫酸銅(Ⅱ)五水和物100g中に含まれる硫酸銅(Ⅱ)の割合を求めるには、硫酸銅(Ⅱ)五水和物の質量である100gに硫酸銅(Ⅱ)五水和物中に含まれる硫酸銅(Ⅱ)の割合をかければOK。
\[ 100×\frac{ 160 }{ 250 }=64 \]
- よって、答えは64(g)となる。
(2)
- 問題文より、硫酸銅(Ⅱ)の溶解度は80℃で56なので、80℃の飽和水溶液に含まれる硫酸銅(Ⅱ)の量は次のように求めることができる。
\[ \begin{align} 溶液:溶質 &=(100+56):56 \\
&= 100:x \end{align} \]
- これを解くと、x≒36(g)となる。
- 冷却後の硫酸銅(Ⅱ)の質量は、もともとあった36gから沈殿に含まれる硫酸銅(Ⅱ)分の質量を引いた値になる。
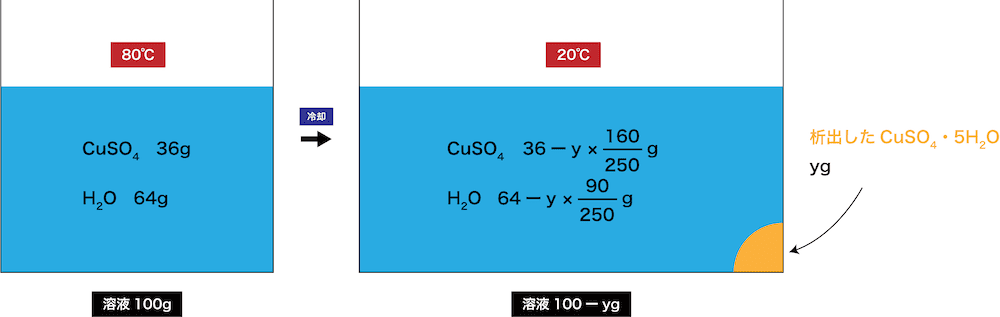
- 以上より、次のような式をたてることができる。
\[ \begin{align} 溶液:溶質 &=(100+20):20 \\
&= (100-y):(36-\frac{ 160 }{ 250 }y) \end{align} \]
- これを解くと、y≒41(g)となる。
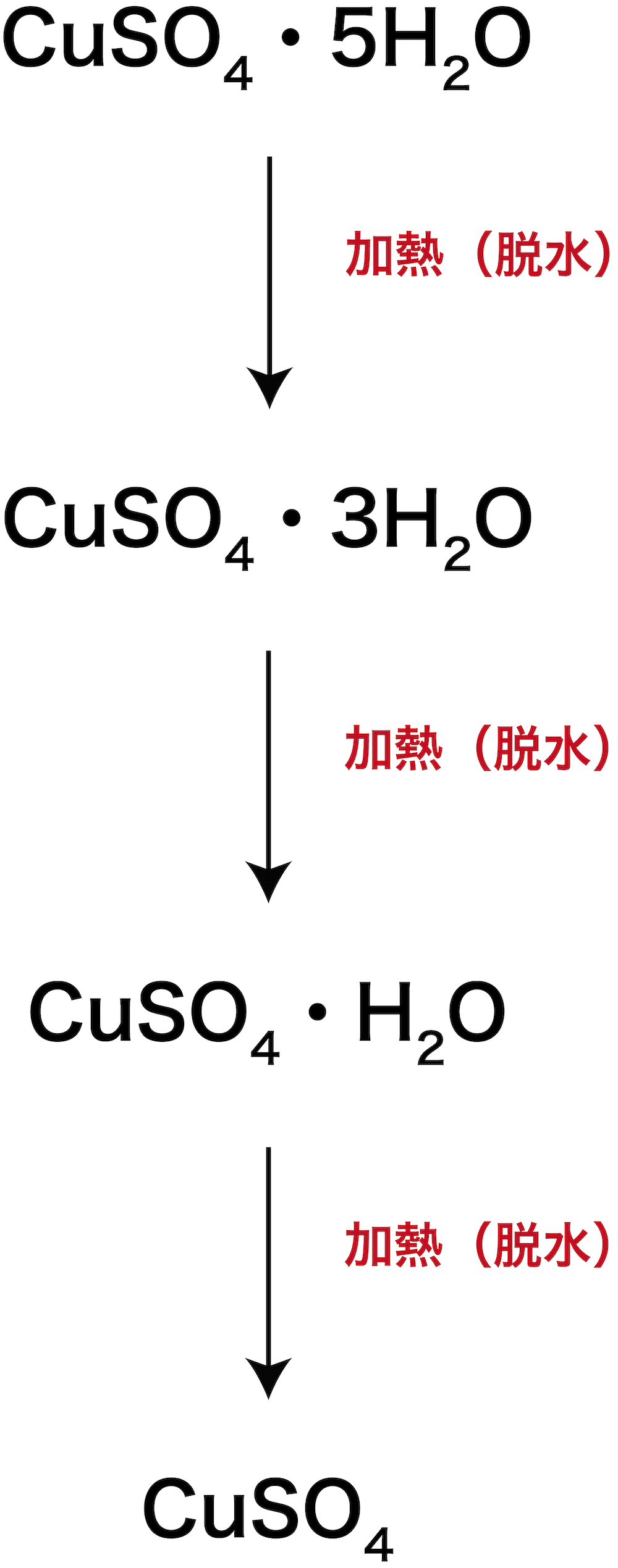
【無機】硫酸銅五水和物を加熱したときの色変化を答える問題
問題
硫酸銅(Ⅱ)五水和物の結晶は何色か。また、硫酸銅(Ⅱ)五水和物を十分に加熱したときの色は何色か。
- 硫酸銅(Ⅱ)五水和物CuSO4・H2Oは青色である。
- これを加熱していくと、徐々にH2Oが取れて、最終的に無水和物(無水物)であるCuSO4の白色沈殿となる。