MENU
アンモニアソーダ法(覚え方・順番・仕組み・覚え方・反応式など)
はじめに
【プロ講師解説】このページでは『アンモニアソーダ法(覚え方・順番・仕組み・覚え方・反応式など)』について解説しています。
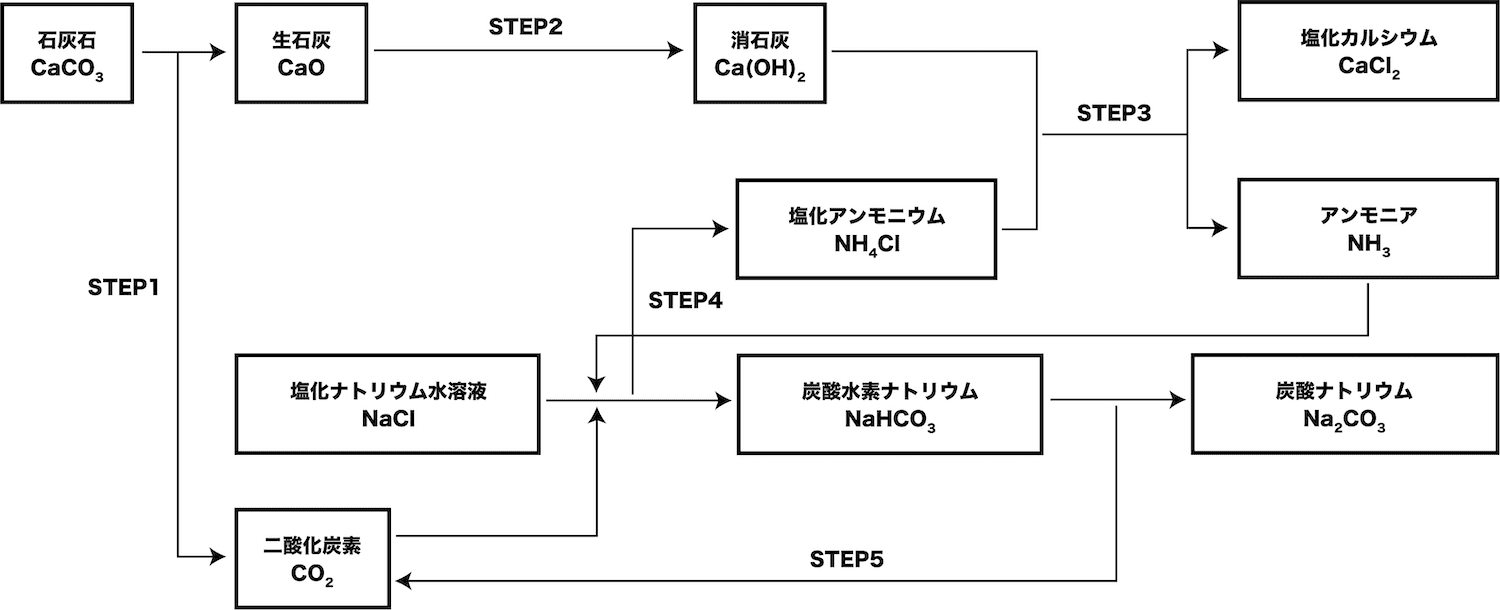
アンモニアソーダ法とは
- 塩化ナトリウムNaClや石灰石CaCO3を原料とした炭酸ナトリウムNa2CO3の工業的製法をアンモニアソーダ法という。
- アンモニアソーダ法はベルギー人の化学者であるエルネスト・ソルベーが考えたことからソルベー法ともよばれる。
アンモニアソーダ法の仕組み
- アンモニアソーダ法は次の手順で行う。
●STEP1
石灰石CaCO3を熱分解する
●STEP2
生石灰CaOを水に溶かす
●STEP3
消石灰Ca(OH)2と塩化アンモニウムNH4Clを反応させる
●STEP4
塩化ナトリウムNaClの飽和水溶液にNH3、CO2を順に吹き込む
●STEP5
炭酸水素ナトリウムNaHCO3を熱分解する
まず、石灰石CaCO3を熱分解する。
\[ \mathrm{CaCO_{3} → CaO + CO_{2}} \]
CaCO3は炭酸塩の1種である。
したがって、熱分解するとCO2と酸化物(ここではCaO)になる。
次に、STEP1で生成した生石灰CaOを水に溶かす。
\[ \mathrm{CaO + H_{2}O → Ca(OH)_{2}} \]
CaOは金属元素が含まれる酸化物なので塩基性酸化物に分類される。
したがって、酸化物の反応(金属元素・非金属元素)にあるように、水と反応させると水酸化物ができる。
次に、消石灰Ca(OH)2と塩化アンモニウムNH4Clを反応させる。
\[ \mathrm{Ca(OH)_{2} + 2NH_{4}Cl → CaCl_{2} + 2NH_{3} + 2H_{2}O} \]
Ca(OH)2は強塩基、NH4Clは弱塩基を含む塩なので弱塩基遊離反応が起こる。
参考:【弱酸・弱塩基遊離反応】原理や公式、反応式の作り方など
ここで使われているCa(OH)2はSTEP2で、NH4ClはSTEP4でつくられたものです。STEP4でつくられたものを使うのはおかしいと思う人もいるかも知れませんが、実際は5つのSTEPはサイクルで連続して行われているため、前の回転のSTEP4でつくられたものを使っていると考えればOKです。
次に、塩化ナトリウムNaClの飽和水溶液にNH3、CO2を順に吹き込む。
\[ \mathrm{NaCl + H_{2}O + NH_{3} + CO_{2} → NaHCO_{3} + NH_{4}Cl} \]
H2OとNH3はSTEP3でつくられたものである。
最後に、炭酸水素ナトリウムNaHCO3を熱分解する。
\[ \mathrm{2NaHCO_{3} → Na_{2}CO_{3} + H_{2}O + CO_{2}} \]
NaHCO3は炭酸水素塩の1種である。
したがって、熱分解するとH2OとCO2と炭酸塩(ここではNa2CO3)になる。
全体の反応式
- アンモニアソーダ法のSTEP1〜STEP5の反応を1つの式にまとめる。
\[ \mathrm{2NaCl + CaCO_{3} → Na_{2}CO_{3} + CaCl_{2}} \]
- STEP1とSTEP4で使ったNaClとCaCO3が反応物、最終的にできる生成物はNa2CO3とCaCl2である。
- 各STEPで登場する他の物質は、できて、また使われてというように5STEPの流れの中で生成と消失が完結してしまうので、全体の反応式には書く必要がない。
アンモニアソーダ法の図
- アンモニアソーダ法の流れを図でまとめる。