MENU
【弱酸・弱塩基遊離反応】原理や公式、反応式の作り方など
はじめに
【プロ講師解説】このページでは『【弱酸・弱塩基遊離反応】原理や公式、反応式の作り方など』について解説しています。
弱酸遊離反応
- 弱酸や弱塩基は電離度が小さく、電離しにくい。電離しにくいということはつまり、くっつきやすい。
- この性質を頭に入れて、弱酸からなる塩、弱塩基からなる塩の反応を確認する。
酢酸ナトリウムCH3COONa+塩酸HCl
- 弱酸からなる塩は、水中で電離して弱酸由来のイオンを生じる。たとえば、酢酸ナトリウムCH3COONaは、電離して酢酸イオンCH3COOーを生じる。
\[ \mathrm{CH_{3}COONa → CH_{3}COO^{-} + Na^{+}} \]
- ここに、塩酸HClのような強酸を加えると、弱酸由来のイオンと強酸から電離したH+がくっつき、弱酸CH3COOHができる(弱酸はくっつきやすいため)。
\[ \mathrm{CH_{3}COONa + HCl → CH_{3}COOH + NaCl} \]
- このように、弱酸からなる塩と強酸を混ぜ合わせると、弱酸が生じる。これを弱酸遊離反応という。
弱酸からなる塩 + 強酸 → 強酸からなる塩 + 弱酸
弱酸遊離反応式の作り方
- 弱酸や弱塩基は電離度が小さく、電離しにくい。電離しにくいということはつまり、くっつきやすい。
●STEP1
弱酸を含む塩・強酸の電離式をそれぞれ書く。
●STEP2
電離した陽イオンと陰イオンで新しいペアをつくる。
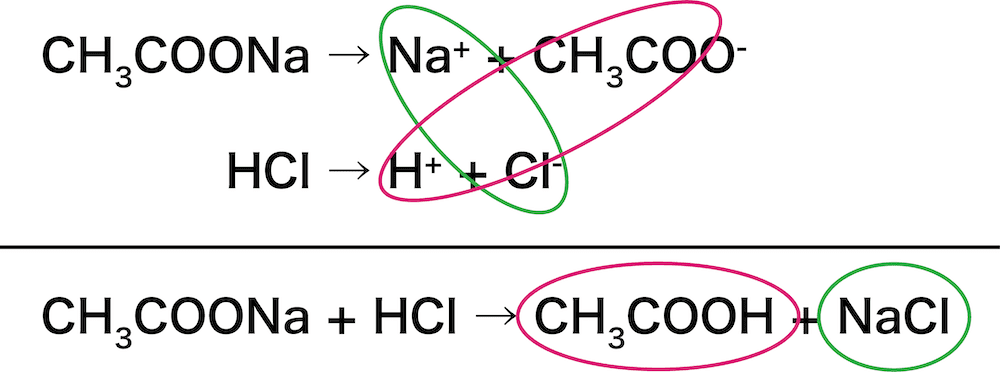
酢酸CH3COOH+塩酸HCl
まずは、弱酸を含む塩・強酸の電離式をそれぞれ書く。
【弱酸を含む塩】
\[ \mathrm{CH_{3}COONa→Na^{+}+CH_{3}COO^{-}} \]
【強酸】
\[ \mathrm{HCl→H^{+}+Cl^{-}} \]
次に、電離した陽イオンと陰イオンで新しいペアをつくる。
弱塩基遊離反応
- 弱塩基遊離反応について、具体例を用いて解説する。
塩化アンモニウムNH4Cl+水酸化カルシウムCa(OH)2
- 弱塩基からなる塩は、水中で電離して弱塩基由来のイオンを生じる。たとえば、塩化アンモニウムNH4Clは、電離してアンモニウムイオンNH4+を生じる。
\[ \mathrm{NH_{4}Cl → NH_{4}^{+} + Cl^{-}} \]
- ここに、水酸化カルシウムCa(OH)2のような強塩基を加えると、弱塩基由来のイオンと強塩基から電離したOHーがくっつき、弱塩基であるアンモニアNH3ができる。(弱塩基はくっつきやすいため)
\[ \mathrm{2NH_{4}Cl + Ca(OH)_{2} → 2NH_{3} + CaCl_{2} + 2H_{2}O} \]
- このように、弱塩基からなる塩と強塩基を混ぜ合わせると、弱塩基が生じる。これを弱塩基遊離反応という。
弱塩基を含む塩 + 強塩基 → 強塩基を含む塩 + 弱塩基
弱酸・弱塩基遊離反応まとめ
この『【弱酸・弱塩基遊離反応】原理や公式、反応式の作り方など』のページで解説した内容をまとめる。
- 弱酸からなる塩と強酸を混ぜ合わせると、弱酸が生じる。これを弱酸遊離反応という。
弱酸からなる塩 + 強酸 → 強酸からなる塩 + 弱酸 - 弱塩基からなる塩と強塩基を混ぜ合わせると、弱塩基が生じる。これを弱塩基遊離反応という。
弱塩基を含む塩 + 強塩基 → 強塩基を含む塩 + 弱塩基
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
弱酸を含む塩と強酸を反応させると、強酸を含む塩と弱酸が生成する。この反応を【1】という。
解答/解説:タップで表示
解答:【1】弱酸遊離反応
弱酸を含む塩と強酸を反応させると、強酸を含む塩と弱酸が生成する。この反応を弱酸遊離反応という。
CaCO3 + 2HCl → 【1】 + CO2 + H2O
解答/解説:タップで表示
解答:【1】CaCl2
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
弱塩基を含む塩と強塩基を反応させると、強塩基を含む塩と弱塩基が生成する。この反応を【1】という。
解答/解説:タップで表示
解答:【1】弱塩基遊離反応
弱塩基を含む塩と強塩基を反応させると、強塩基を含む塩と弱塩基が生成する。この反応を弱塩基遊離反応という。
2NH4Cl + Ca(OH)2 → 2【1】 + CaCl2 + 2H2O
解答/解説:タップで表示
解答:【1】NH3
2NH4Cl + Ca(OH)2 → 2NH3 + CaCl2 + 2H2O













