MENU
酸化物の反応(金属元素・非金属元素)
はじめに
【プロ講師解説】このページでは『酸化物の反応(金属元素・非金属元素)』について解説しています。
前提知識:酸化物について
- 酸化物の基礎事項をまだ理解できていないという人は,まず酸性酸化物・塩基性酸化物・両性酸化物(違い・見分け方・一覧・反応など)をみてからこのページを読み進めることをおすすめする。
金属元素の酸化物の反応
- 金属元素の酸化物は全て酸化物イオンO2ーを含んでおり,塩基性酸化物に分類される。したがって,金属元素の酸化物はO2ーに由来する共通の反応を示す。
- OHーがH2OからH+が1個取れたものと考えられる。また,O2ーはH2OからH+が2個取れたものと考えられる。
- OHーはH+を受け取りやすいが,O2ーはOHーよりもH+が不足している状態のため,OHー以上にH+を受け取りやすい。
- これを前提知識として,金属元素の酸化物の反応を紹介する。
金属元素の酸化物と水の反応
- 金属元素の酸化物を水に加えると,水に溶けるものの場合,水中にO2ーが溶け出す。
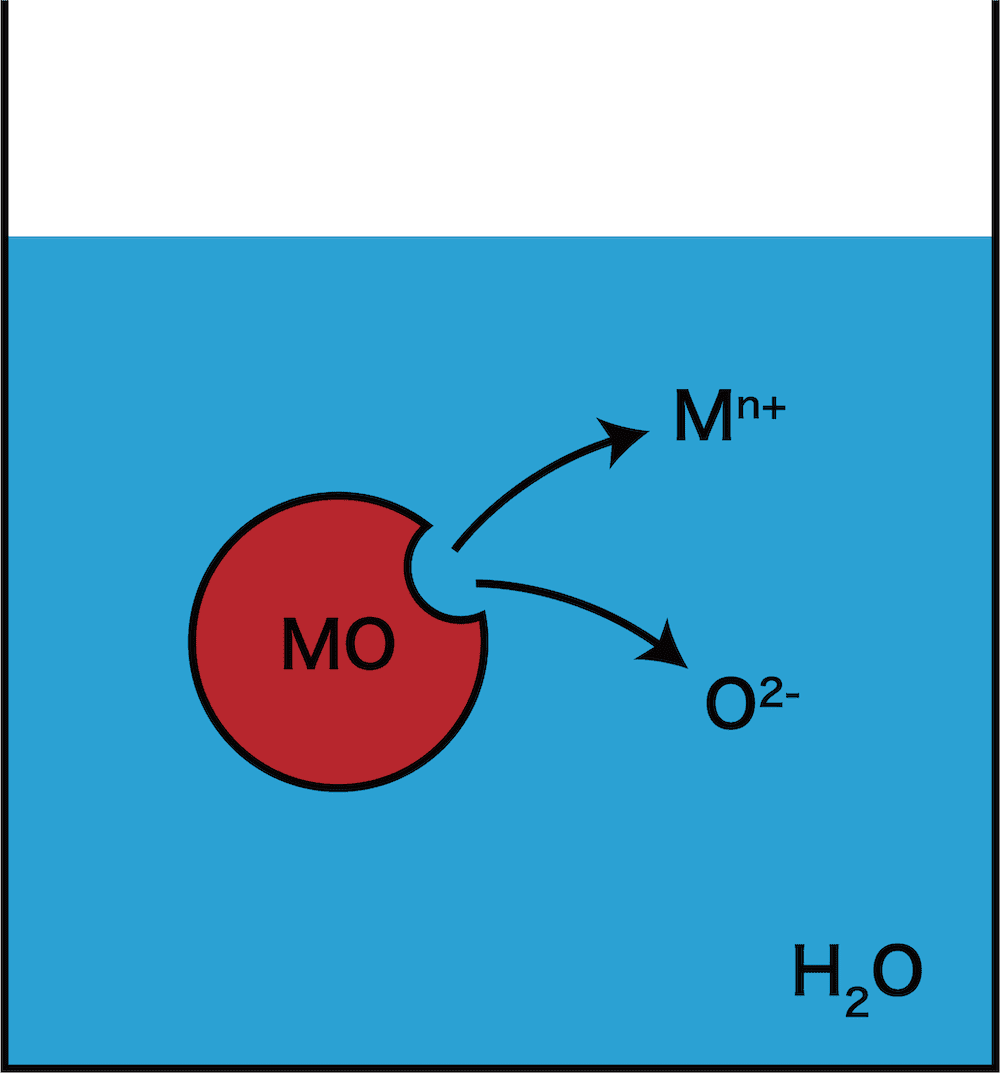
- O2ーはH2Oと比べてH+が2個少ないため,H2OからH+を奪い取り,次のような反応が起こる。
\[ \mathrm{O^{2-}+H_{2}O→OH^{-}+OH^{-}} \]
- このように,金属元素の酸化物が水と反応すると,水酸化物が生じる。
金属元素の酸化物 + 水 → 水酸化物
- これを踏まえると,金属元素の酸化物と水の反応を表す反応式は,次の3STEPでつくることができる。
●STEP1
酸化物をバラバラにする。
●STEP2
O2ーとH2Oを2個のOHーにする。
●STEP3
2つの式を組み合わせる。
- 酸化カルシウムCaOと水H2Oの反応を例に解説する。
まず,酸化物をバラバラにする。
\[ \mathrm{CaO→Ca^{2+}+O^{2-}} \]
次に,STEP1でできたO2ーをH2Oと反応させ,2個のOHーをつくる。
\[ \mathrm{O^{2-}+H_{2}O→2OH^{-}} \]
最後に,STEP1とSTEP2でつくった2つの式を組み合わせる。
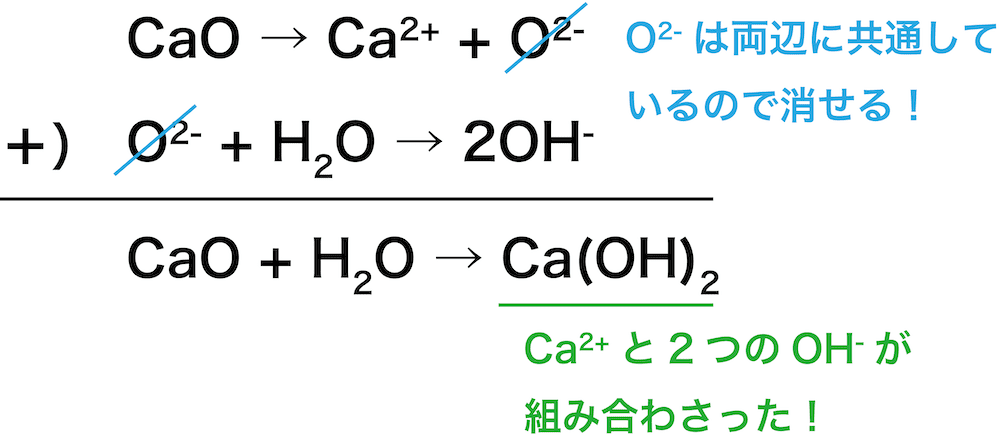
両辺に共通しているO2ーは消すことができる。
また,右辺のCa2+と2個のOHーは組み合わせてCa(OH)2とする。
金属元素の酸化物と酸の反応
- 次に金属元素の酸化物と酸の反応を考える。
- O2ーはH+を受け取りやすく,酸はH+を放出しやすいため,O2ーが酸からH+を受け取り,次のような反応が起こる。
\[ \mathrm{O^{2-}+2H^{+}→H_{2}O} \]
- このように,金属元素の酸化物が酸と反応すると,水が生じる。
金属元素の酸化物 + 酸 → 塩 + 水
- これを踏まえると,金属元素の酸化物と酸の反応を表す反応式は,次の4STEPでつくることができる。
●STEP1
酸化物をバラバラにする。
●STEP2
O2ーと2個のH+をH2Oにする。
●STEP3
2つの式を組み合わせる。
●STEP4
足りないイオンを付け加える。
- 酸化カルシウムCaOと塩酸HClの反応を例に解説する。
まず,酸化物をバラバラにする。
\[ \mathrm{CaO→Ca^{2+}+O^{2-}} \]
次に,STEP1でできたO2ーを2個のH+と反応させ,H2Oをつくる。
\[ \mathrm{O^{2-}+2H^{+}→H_{2}O} \]
次に,STEP1とSTEP2でつくった2つの式を組み合わせる。

両辺に共通しているO2ーは消すことができる。
最後に,足りないイオンを付け加える。

今回はHCl中に存在するClーが使われていないため,それを両辺に足す。
非金属元素の酸化物の反応
- 非金属元素の酸化物は全て,大きく分極した共有結合XOをもち,酸性酸化物に分類される。したがって,非金属元素の酸化物にはXOに由来する共通の反応がある。
非金属元素の酸化物と水の反応
- 非金属元素の酸化物を水に加えると,XOとH2Oの反応が起こる。
- つまり,電子はマイナスの電荷をもっており,δ+と引き合うため,水分子は分子中の酸素O原子が有している非共有電子対を頭にして,Xのδ+の部分を攻撃する。結果,水分子が次のように酸化物にくっつくことになる。
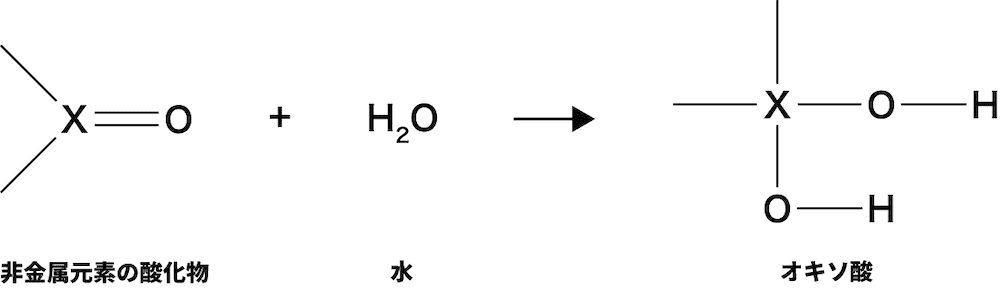
- このとき生じるXOHはオキソ酸に特有の構造であり,したがって,非金属の酸化物が水と反応すると,対応するオキソ酸が生じることがわかる。
- 以上を踏まえると,非金属元素の酸化物と水の反応を表す反応式は,次の2STEPでつくることができる。
●STEP1
酸化物に対応するオキソ酸を考える。
●STEP2
酸化物と水を反応物,オキソ酸を生成物として反応式をつくる。
- 三酸化硫黄SO3と水H2Oの反応を例に解説する。
非金属元素の酸化物と水を反応させるとオキソ酸が生成するため,まずは酸化物に対応するオキソ酸を考える。
\[ \mathrm{SO_{3}に対応するオキソ酸→H_{2}SO_{4}} \]
オキソ酸(例・酸化力・一覧・強さ・構造・酸化数など)にあるように,SO3に対応するオキソ酸は硫酸H2SO4である。
次に,酸化物と水を反応物,オキソ酸を生成物として反応式を立てる。
\[ \mathrm{SO_{3}+H_{2}O→H_{2}SO_{4}} \]
非金属元素の酸化物と塩基の反応
- 次に非金属元素の酸化物を塩基に加えた場合をみていこう。
- 非金属元素の酸化物を塩基に加えると,XOと(塩基由来の)OHーが出会うことになる。
- 水分子中の酸素O原子同様,水酸化物イオンもXのδ+の部分を攻撃する力があるため,次のような反応がおこる(OHーは全体としてマイナスの電荷をもっているため,δ+を攻撃する力は水分子中の酸素O原子と比較して非常に強い)。
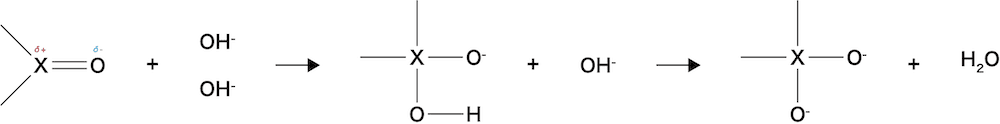
- この過程において,一度生じた構造XOHは,オキソ酸の部分構造でH+を出しやすいため,すぐに別のOH–と反応している。
- 最終的に生じた物質は,炭酸イオンCO32ーや硫酸イオンSO42ーといったオキソ酸由来の陰イオンである。この陰イオンは,溶液中に存在する塩基由来の陽イオンと組み合わさって塩を形成する。つまり,非金属元素の酸化物が塩基と反応すると,対応するオキソ酸の塩と水が生成する。
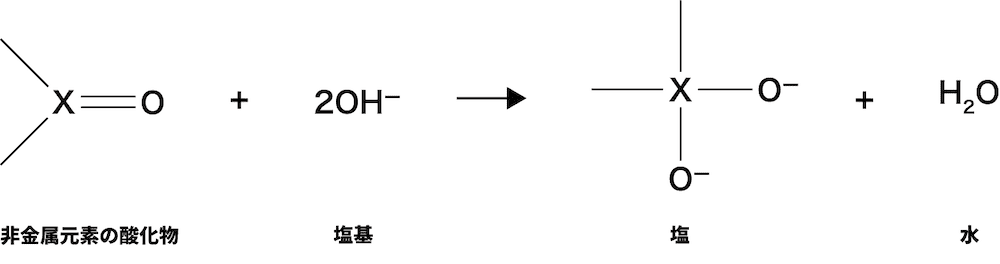
- これを踏まえると,非金属元素の酸化物と塩基の反応を表す反応式は次の4STEPでつくることができる。
●STEP1
酸化物に対応するオキソ酸を考える。
●STEP2
酸化物と塩基を反応物,オキソ酸の塩と水を生成物として反応式をつくる。
- 二酸化炭素CO2と水酸化カルシウムCa(OH)2の反応を例に解説する。
非金属元素の酸化物と水を反応させるとオキソ酸が生成するため,まずは酸化物に対応するオキソ酸を考える。
\[ \mathrm{CO_{2}に対応するオキソ酸→H_{2}CO_{3}} \]
オキソ酸(例・酸化力・一覧・強さ・構造・酸化数など)にあるように,CO2に対応するオキソ酸は炭酸H2CO3である。
次に,酸化物と塩基を反応物,オキソ酸の塩と水を生成物として反応式をつくる。
\[ \mathrm{CO_{2}+Ca(OH)_{2}→CaCO_{3}+H_{2}O} \]
上述の通り,オキソ酸由来の陰イオンCO32ーが塩基由来の陽イオンCa2+と組み合わさって,オキソ酸の塩である炭酸カルシウムCaCO3が生じている。














