MENU
分子間力(水素結合・ファンデルワールス力・沸点のグラフなど)
はじめに
【プロ講師解説】このページでは『分子間力(水素結合・ファンデルワールス力・沸点のグラフなど)』について解説しています。
分子間力とは
- 分子間にはたらく力の総称を分子間力という。
- 分子間力は共有結合やイオン結合、金属結合などに比べて弱い結合だが、多くの分子に関係する非常に重要な結合である。
- 高校化学で押さえておくべき分子間力は、ファンデルワールス力と水素結合であり、このページではこれら2つの結合について解説する。
ファンデルワールス力
- 極性の有無に関わらず、分子の中では常に”電子の移動”が起こっている。
- したがって、世の中に存在する全ての分子に”瞬間的な電荷の偏り”が生じる可能性がある。
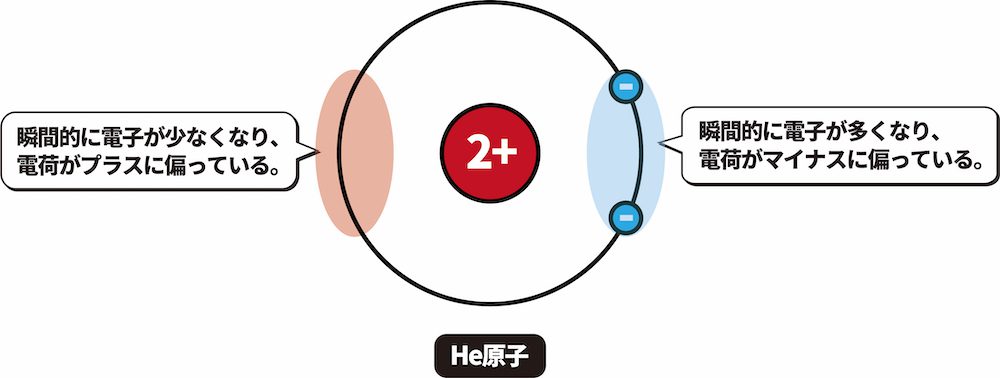
- この電荷の偏りがある分子が別の分子に近づいたとき、電荷の偏りが誘発される。

- このように、全ての分子で発生し得る、瞬間的な電荷の偏りが原因となり生じる引力をファンデルワールス力という。
極性分子については、電荷の偏りがもともと存在するため、これによっても引力が発生します。
ファンデルワールス力の特徴
- ファンデルワールス力には、次の特徴がある。
●ファンデルワールス力の特徴
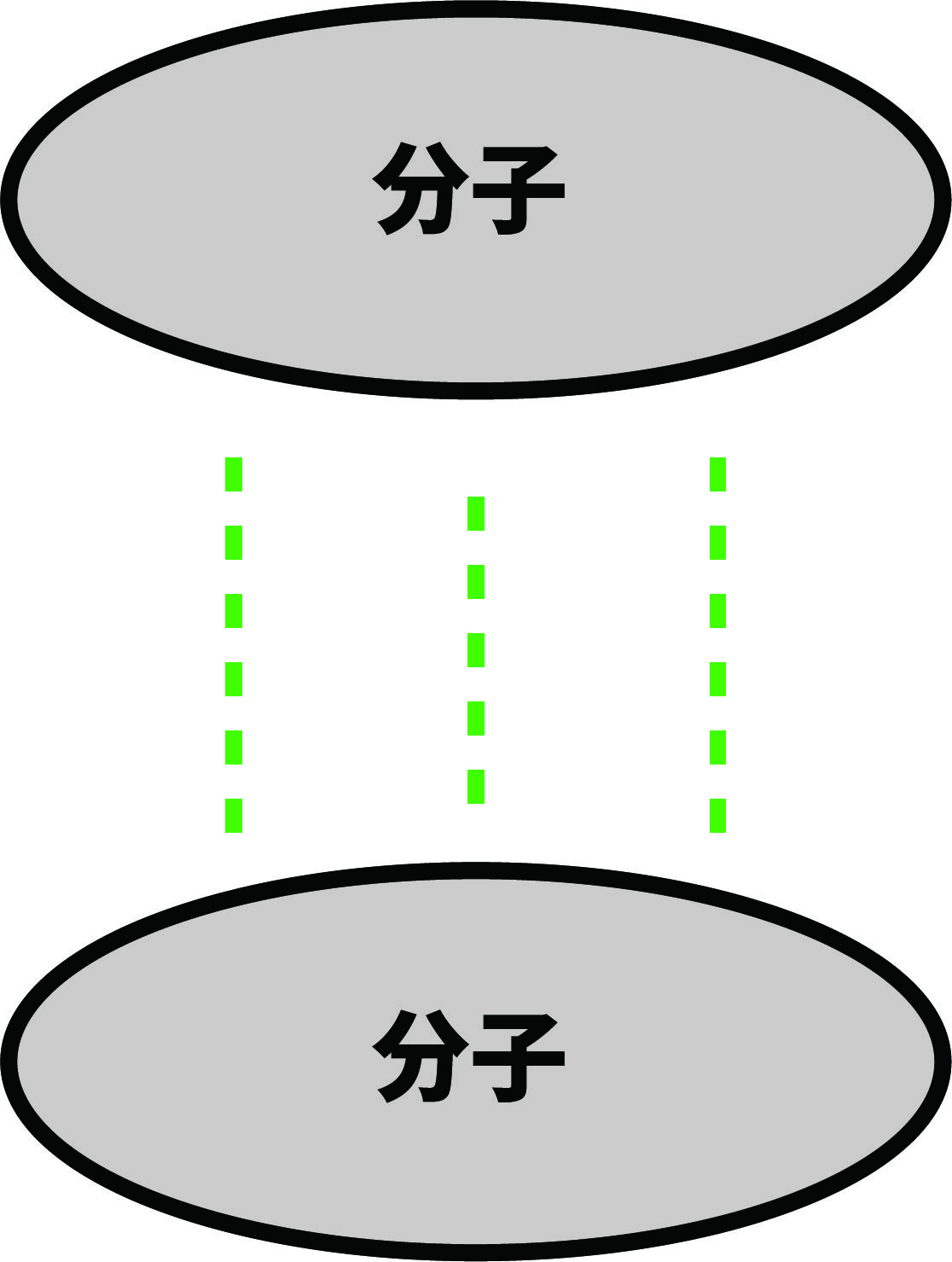
- 分子量の大きな分子はファンデルワールス力が大きい
- 表面積の大きな分子はファンデルワールス力が大きい
- 極性の大きな分子はファンデルワールス力が大きい
❶ 分子量の大きな分子はファンデルワールス力が大きい
- 分子量の大きな分子ほど、分子間にはたらくファンデルワールス力が大きい。
| 分子量 小 | 分子量 大 |
|---|---|
 分子量の小さな分子は、分子間にはたらくファンデルワールス力が小さい。 | 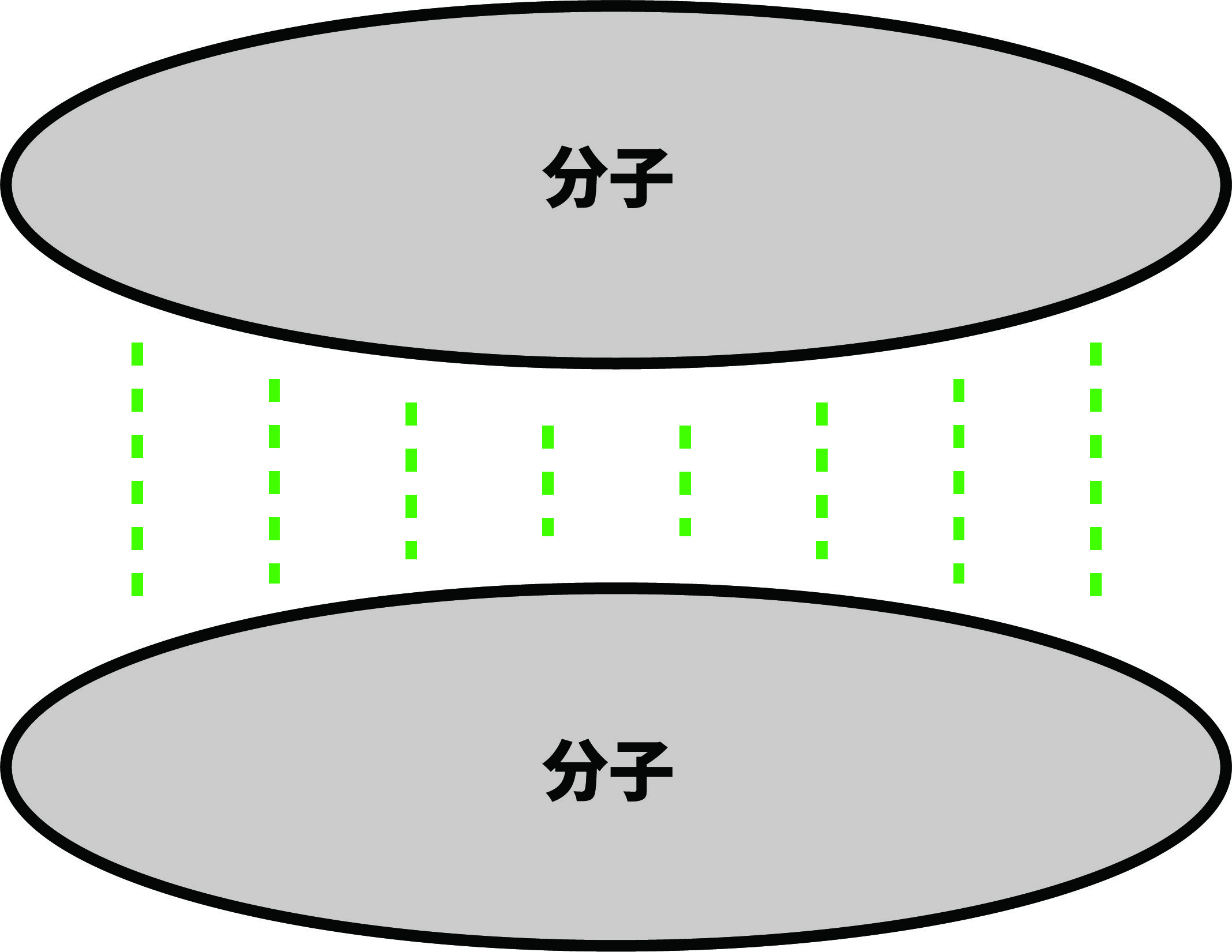 分子間力の大きな分子は、分子間にはたらくファンデルワールス力が大きい。 |
- 分子量はファンデルワールス力に直接的な影響を与えない。しかし、分子量が大きくなるほど陽子や電子の数が増え、それに伴って電荷の偏りが生じやすくなり、結果的にファンデルワールス力が大きくなる。
❷ 表面積の大きな分子はファンデルワールス力が大きい
- 表面積の大きな分子ほど、分子間にはたらくファンデルワールス力が大きい。
| 表面積 小 | 表面積 大 |
|---|---|
 表面積の小さな分子は、分子間にはたらくファンデルワールス力が小さい。 |  表面積の大きな分子は、分子間にはたらくファンデルワールス力が大きい。 |
- 表面積が大きいということはすなわち、接触面積が大きいということである。接触面積が大きいほど引力が大きくなる。
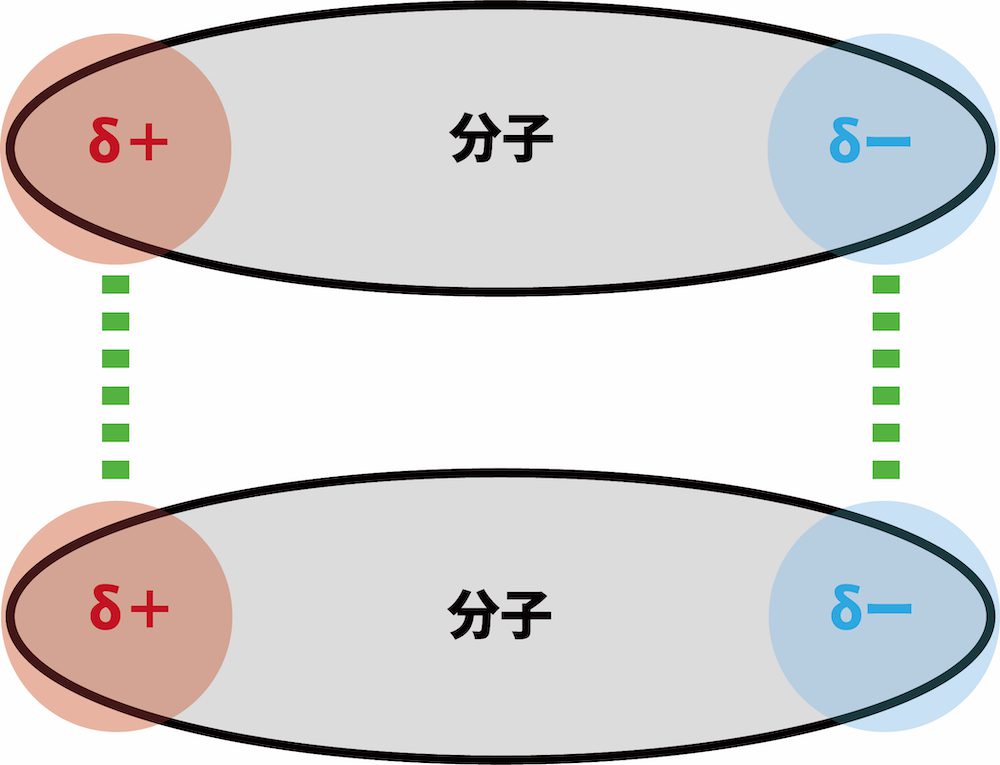
❸ 極性の大きな分子はファンデルワールス力が大きい
- 極性の大きな分子ほど、分子間にはたらくファンデルワールス力が大きい。
| 極性 小 | 極性 大 |
|---|---|
 極性の小さな分子は、分子間にはたらくファンデルワールス力が小さい。 | 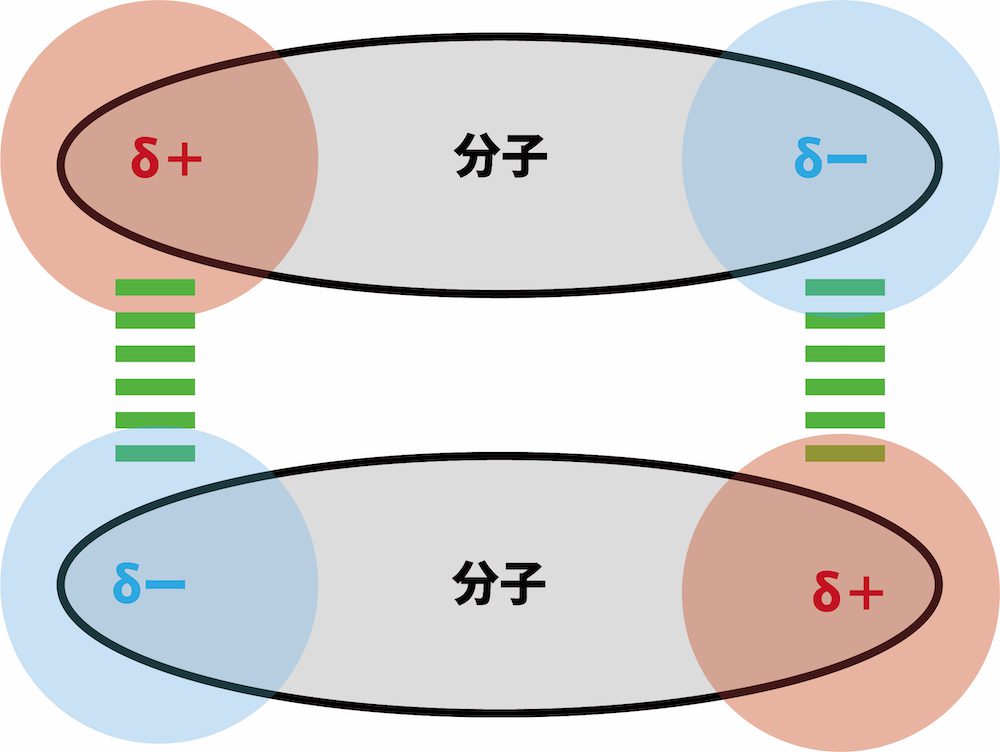 極性の大きな分子は、分子間にはたらくファンデルワールス力が大きい。 |
- ファンデルワールス力は電荷の偏りが原因で生じる引力のため、極性分子のようにもとから電荷が大きく偏っている分子はファンデルワールス力が大きい。
ファンデルワールス力と沸点
- ファンデルワールス力の大きな分子ほど、分子同士を引き離すのに大きな力が必要になるため、沸点が高い。
ハロゲン単体
- ハロゲン単体の沸点は次の通りである。
| 化学式 | 分子量 | 沸点〔℃〕 |
|---|---|---|
| F2 | 38 | ー188 |
| Cl2 | 71 | ー33.9 |
| Br2 | 160 | ー58.7 |
| I2 | 254 | ー184 |
- 分子量の大きな分子ほど(周期表上で下にあるほど)、ファンデルワールス力が大きく、沸点が高いことが確認できる。
異性体
- 分子式(分子量)が同じで、構造が異なる物質同士を異性体という。
- 分子式C5H12の化合物の異性体の構造式、沸点は次の通りである。
| 名称 | 構造式 | 沸点〔℃〕 |
|---|---|---|
| ペンタン |  | 36 |
| 2-メチルブタン |  | 28 |
| 2,2-ジメチルプロパン | 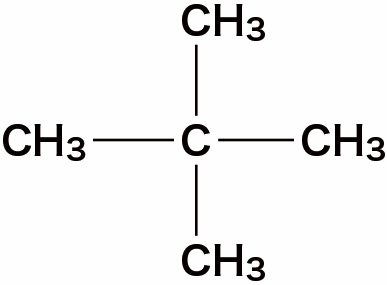 | 9.5 |
- 表面積が大きな分子ほど、ファンデルワールス力が大きく、沸点が高いことが確認できる。
水素結合とは
- フッ素F・酸素O・窒素N原子と結合している水素H原子と、別の分子のF・O・N原子との結合を水素結合という。
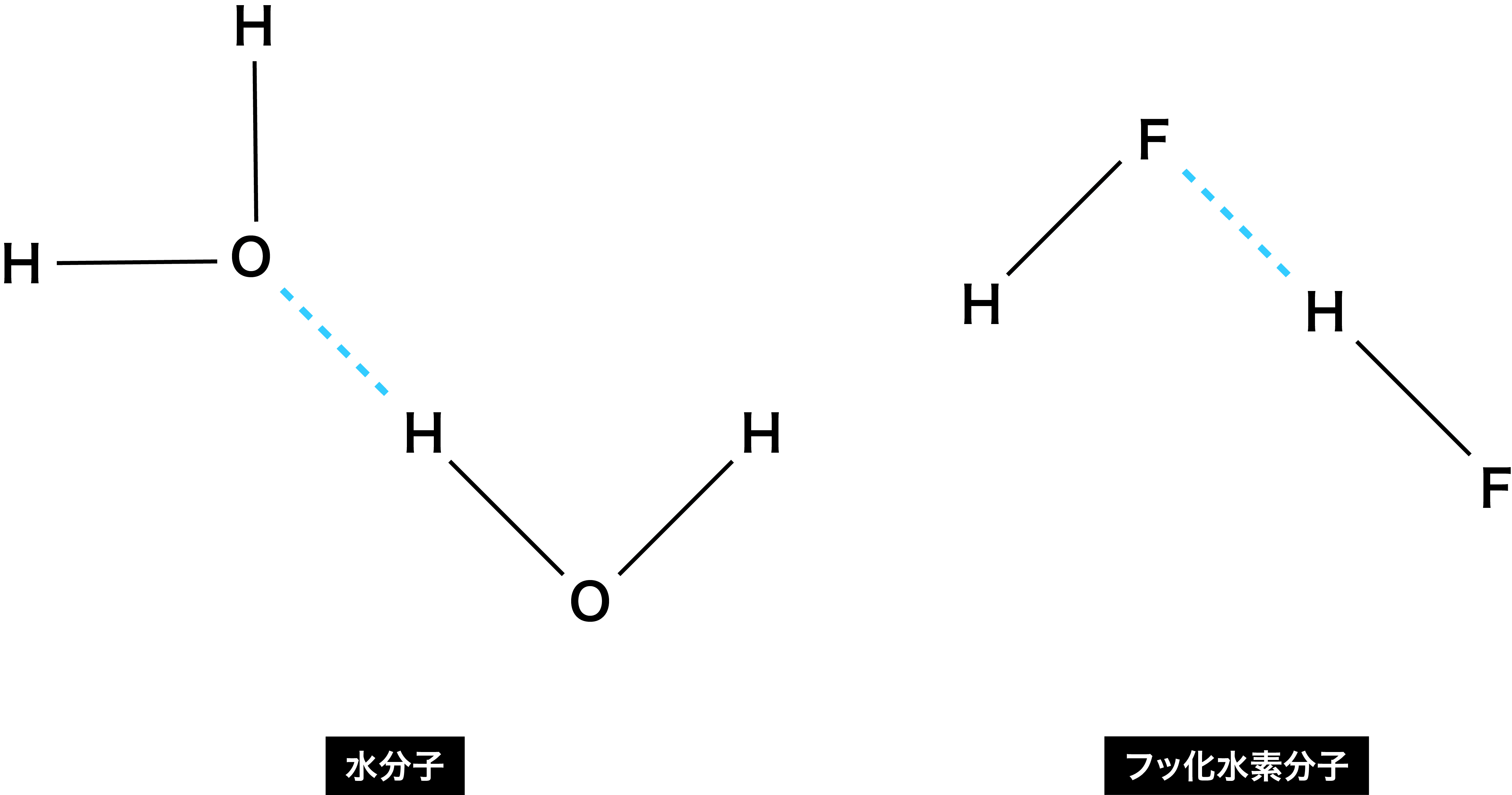
- F・O・N原子は、H原子と比較して電気陰性度が非常に大きい。
- 電気陰性度は「自分の方に共有電子対を引っ張る強さ」なので、水H2O分子を例にすると、分子中に存在するH原子とO原子の結合に使われている電子は、より電気陰性度の大きいO原子の方に引っ張られることになる。
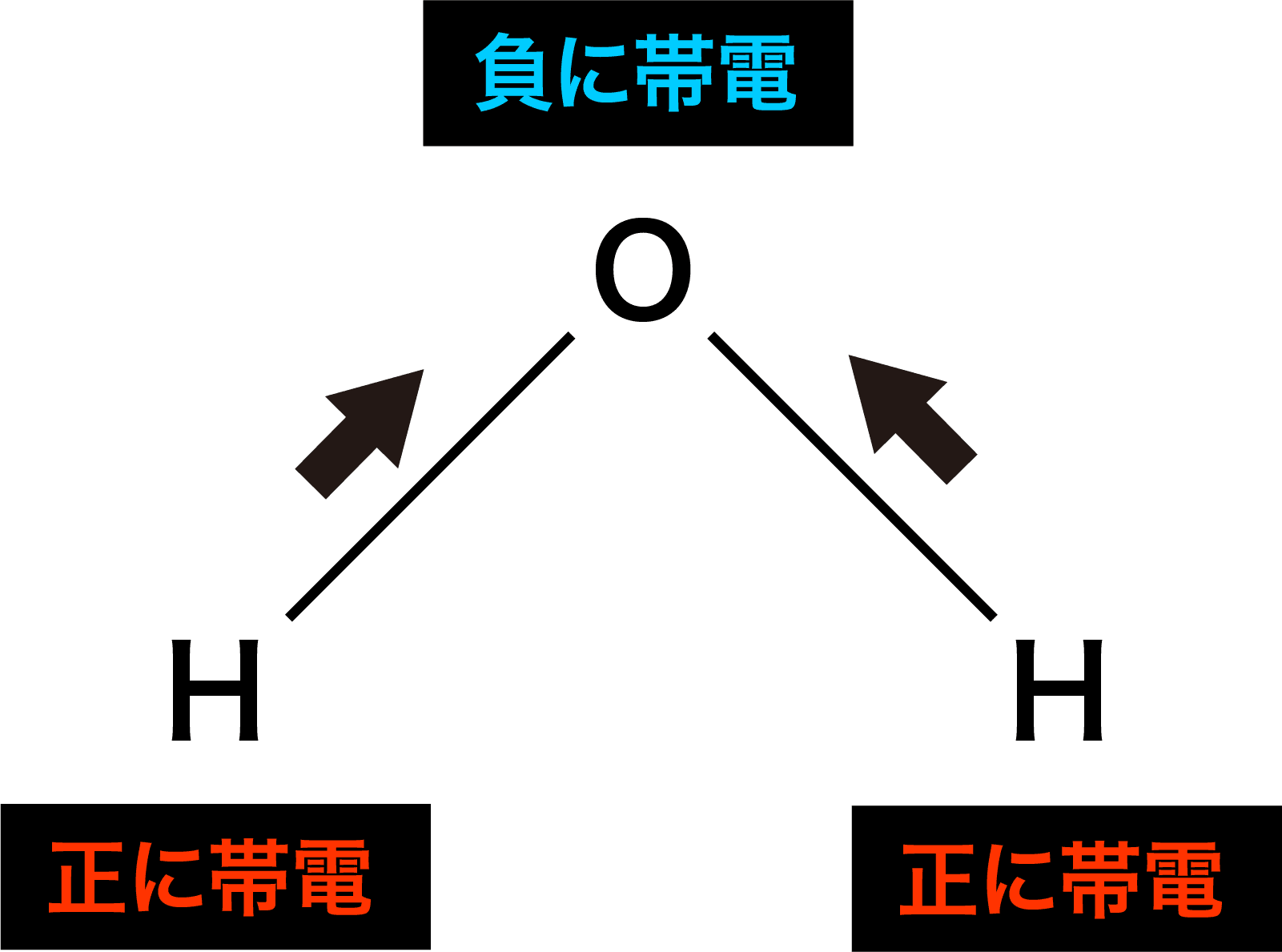
- この結果、H原子はプラスに、O原子はマイナスに帯電するため、隣の同分子と静電引力(クーロン力)に基づく結合が形成される。
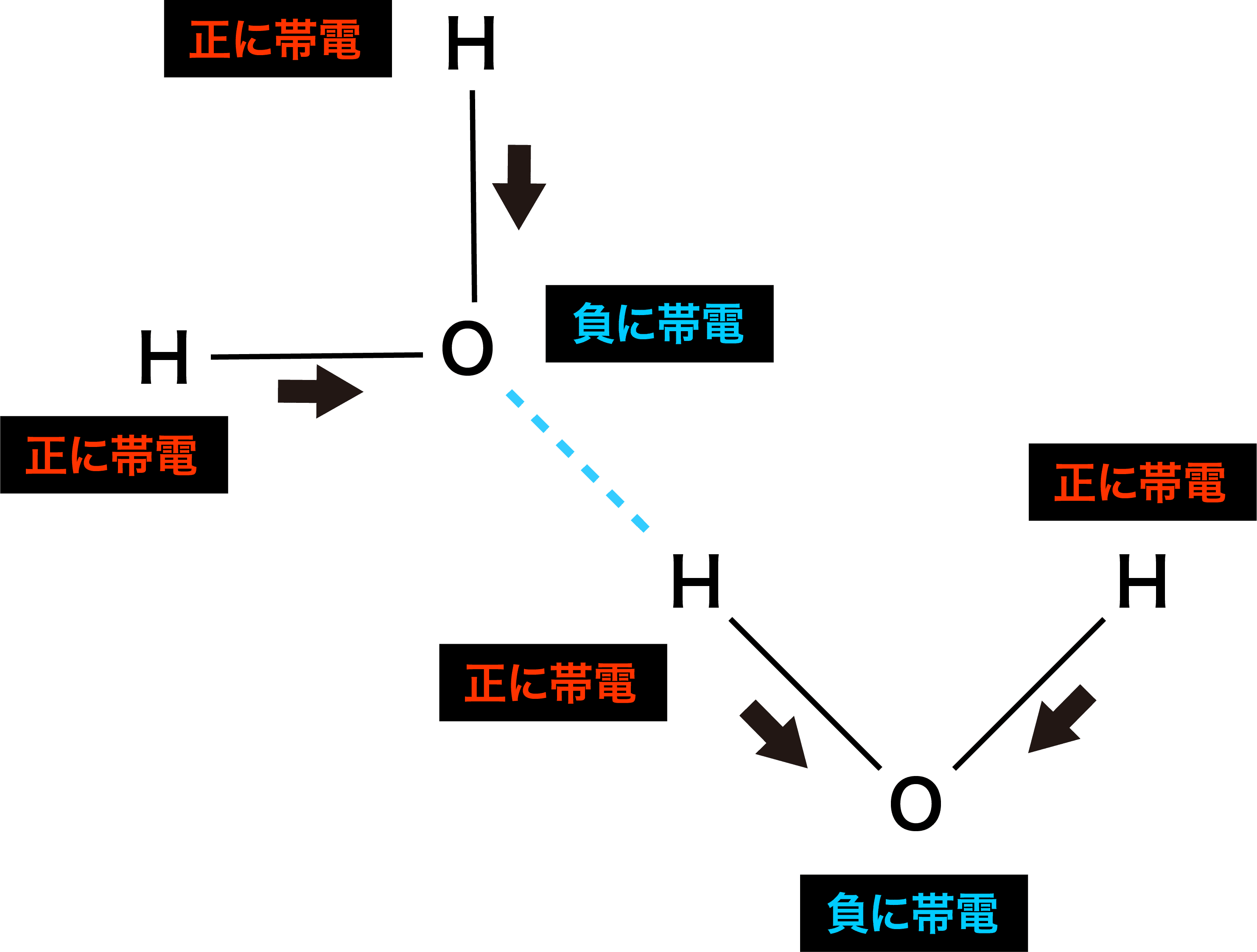
- この静電引力による結合を(水素が使われた結合のため)水素結合という。
水素結合と沸点
- 通常、同族元素の水素化物の沸点は分子量に比例して高くなる。
- しかし、分子間で水素結合をつくるフッ化水素HF・水H2O・アンモニアNH3などは(分子量が小さいにもかかわらず)比較的高い沸点を示す。
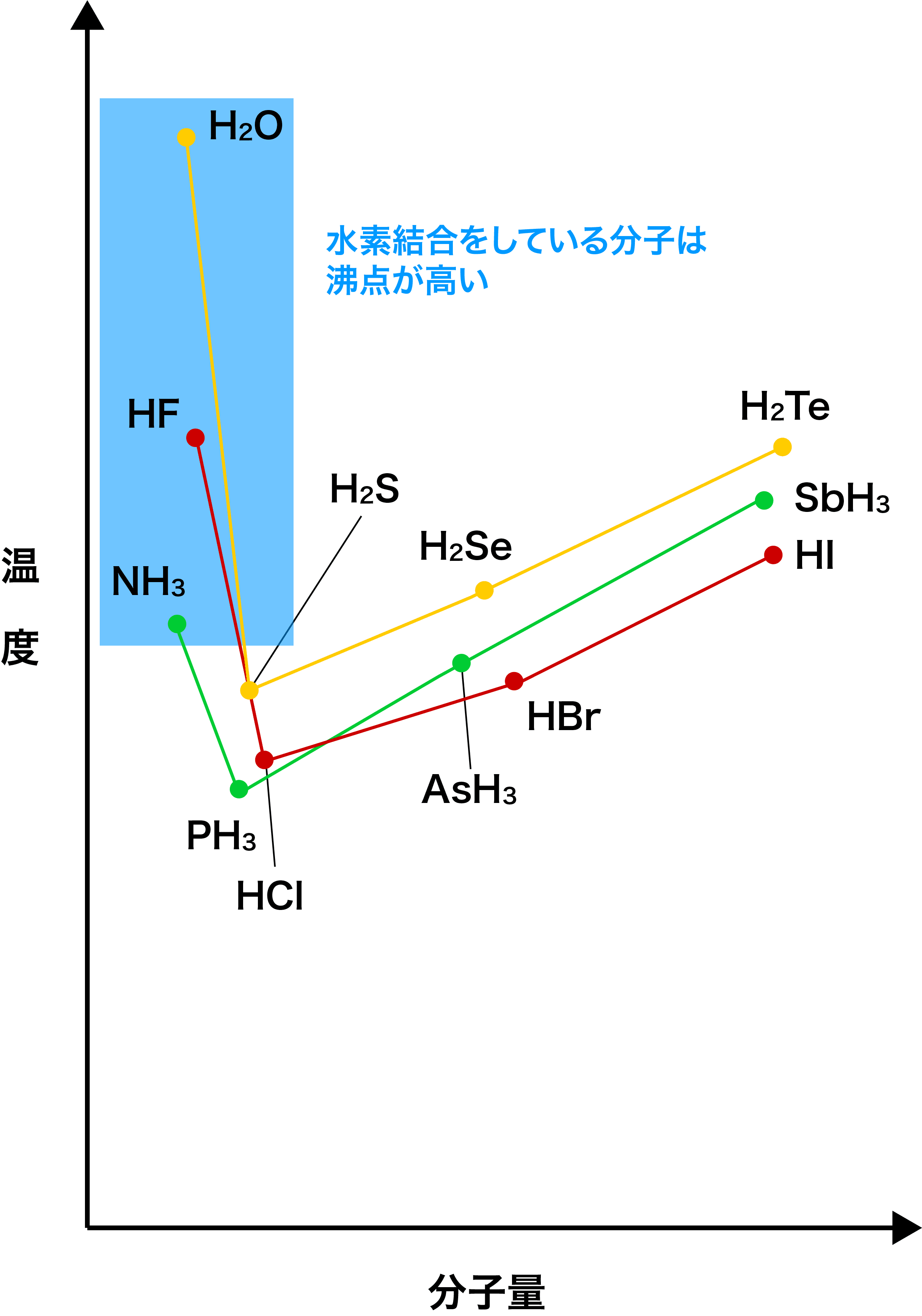
- これは、これらの分子間に水素結合がはたらいており、分子同士を引き離すために大きなエネルギー(=熱)が必要となるためである。
- ちなみに、水素結合をしている分子の中でも「H2O」の沸点が際立って大きくなっているのは、水は1つの分子につき最大4つの水素結合を形成できるためである。
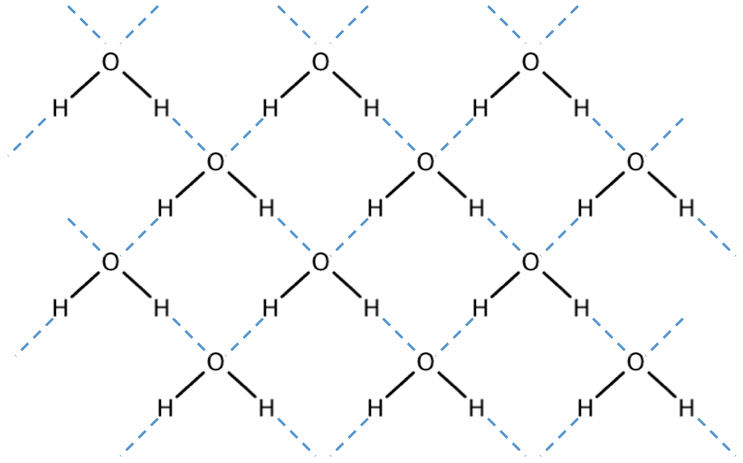
分子結晶
- ドライアイスCO2・ヨウ素I2・氷H2Oなど、多数の分子が分子間力によって引き合って、規則正しく配列してできた結晶を分子結晶という。
- 分子結晶には、次の特徴がある。
●分子結晶の特徴
- 融点が低い・柔らかい
- 昇華性を示す
- 電気伝導性がない
❶ 融点が低い・柔らかい
❷ 昇華性を示す
- 固体↔︎気体の変化を昇華、昇華を起こす性質を昇華性という。
- 分子間力は弱い結合であり、少しの温度上昇であっても、分子の運動エネルギーが分子間力を上回る。したがって、分子が簡単に結晶から飛び出すため、分子結晶は昇華性を示す場合が多い。
参考:【分離法】昇華法(ヨウ素を使った実験の原理・操作など)
❸ 電気伝導性がない
- 分子は電気的に中性である。したがって、固体でも液体でも電気伝導性がない。
分子間力まとめ
この『分子間力(水素結合・ファンデルワールス力・沸点のグラフなど)』のページで解説した内容をまとめる。
- 分子間にはたらく力の総称を分子間力という。
- 高校化学で頻出の分子間力は、ファンデルワールス力と水素結合である。
- ファンデルワールス力には、次の特徴がある。
❶ 分子量の大きな分子はファンデルワールス力が大きい
❷ 表面積の大きな分子はファンデルワールス力が大きい
❸ 極性の大きな分子はファンデルワールス力が大きい - ファンデルワールス力の大きな分子ほど、分子同士を引き離すのに大きな力が必要になるため、沸点が高い。
- フッ素F・酸素O・窒素N原子と結合している水素H原子と、別の分子のF・O・N原子との結合を水素結合という。
- 分子間で水素結合をつくるフッ化水素HF・水H2O・アンモニアNH3などは非常に高い沸点を示す。
- ドライアイスCO2・ヨウ素I2・氷H2Oなど、多数の分子が分子間力によって引き合って、規則正しく配列してできた結晶を分子結晶という。
- 分子結晶には、次の特徴がある。
❶ 融点が低い・柔らかい
❷ 昇華性を示す
❸ 電気伝導性がない
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
分子間にはたらく力の総称を【1】という。
解答/解説:タップで表示
解答:【1】分子間力
分子間にはたらく力の総称を分子間力という。
分子内での電荷の偏りが原因となって生じる引力を【1】という。
解答/解説:タップで表示
解答:【1】ファンデルワールス力
分子内での電荷の偏りが原因となって生じる引力をファンデルワールス力という。
ファンデルワールス力は他の化学結合を形成する力と比べて、非常に【1(強 or 弱)】い力である。
解答/解説:タップで表示
解答:【1】弱
ファンデルワールス力は他の化学結合を形成する力と比べて、非常に弱い力である。
ファンデルワールス力は【1】や【2】が大きいほど強い。
解答/解説:タップで表示
解答:【1】分子量【2】表面積(順不同)
ファンデルワールス力は分子量や表面積が大きいほど強い。
F・O・Nと結合しているHと、別の分子のF・O・Nとの結合を【1】という。
解答/解説:タップで表示
解答:【1】水素結合
F・O・Nと結合しているHと、別の分子のF・O・Nとの結合を水素結合という。
通常、同族元素の水素化物の沸点は【1】に比例して大きくなる。
解答/解説:タップで表示
解答:【1】分子量
通常、同族元素の水素化物の沸点は分子量に比例して大きくなる。
分子間で水素結合をつくるフッ化水素HF・水H2O・アンモニアNH3などは分子量が小さい割に【1(大き or 小さ)】い沸点を示す。
解答/解説:タップで表示
解答:【1】大き
分子間で水素結合をつくるフッ化水素HF・水H2O・アンモニアNH3などは分子量が小さい割に大きい沸点を示す。
H2Oの沸点が際立って大きいのは、1つの分子につき最大【1】個の水素結合をつくるためである。
解答/解説:タップで表示
解答:【1】4
H2Oの沸点が際立って大きいのは、1つの分子につき最大4個の水素結合をつくるためである。














