MENU
イオン化傾向(覚え方・定義・金属板の反応のしやすさ)
目次
はじめに
【プロ講師解説】このページでは『イオン化傾向(覚え方・定義・金属板の反応のしやすさ)』について解説しています。
イオン化列とイオン化傾向
- 単体の反応(酸化還元反応)にあるように、金属の単体は電子eーを放出する還元剤としてはたらく。
- このとき、還元力の強さは金属ごとに異なり、簡単にeーを放出する強い還元剤としてはたらくものもあれば、なかなかeーを放出しない弱い還元剤としてはたらくものもある。
- ここで、金属単体を還元力の強さの順番に並べるために、ある実験を行う。
- ある金属Mの陽イオンM+が存在している水溶液に、別の金属Nの単体を加えるとする。
このとき、NがMよりも陽イオンになりやすければ、つまりNがMよりも還元力が強ければ、NがN+となって溶けていき、M+がeーを受け取って、金属Mが析出する。
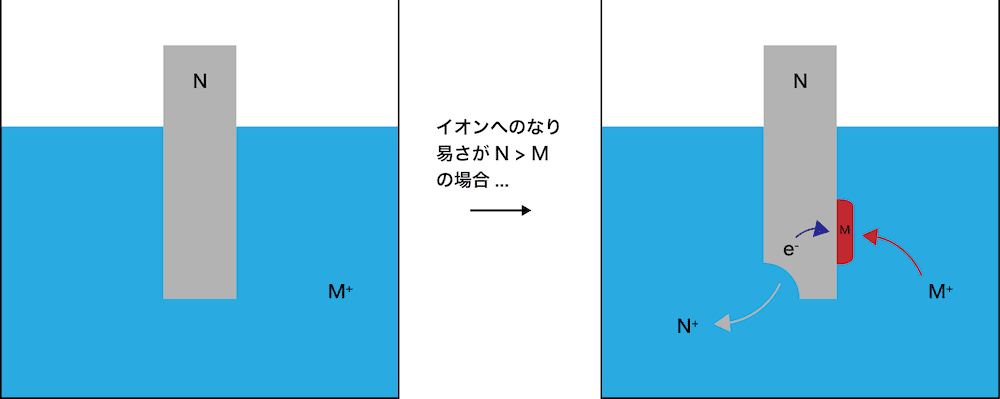
- この実験を利用して様々な金属単体の還元力の強さを調べると次のような順になった。

- 金属単体が水溶液中で陽イオンになる性質をイオン化傾向といい、金属をイオン化傾向の順に並べたものをイオン化列という。
- 上で説明した内容を考慮すると、イオン化列は金属単体の還元力の強さの順番を表しているといえる。
- 酸化・還元/酸化剤・還元剤などについて詳しくは以下のページを参照のこと。
イオン化傾向と金属単体の反応性
- ここまで説明したように、イオン化傾向は金属単体の還元力の強さを表したものである。
- したがって、イオン化傾向は酸化還元反応の起こりやすさに密接に関連していると想像できる。なぜなら、還元剤としての力が強いほど酸化還元反応を起こしやすいからである。
- 金軸単体の反応性を表した次の図を見てみよう。
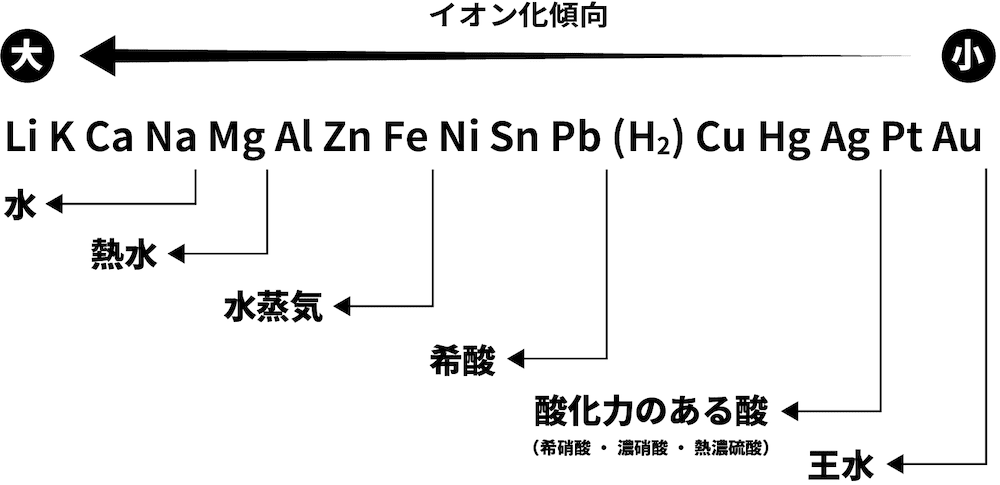
- イオン化傾向の大きな(=還元力の強い)金属単体ほど、反応性が大きい。
❶ 水と反応
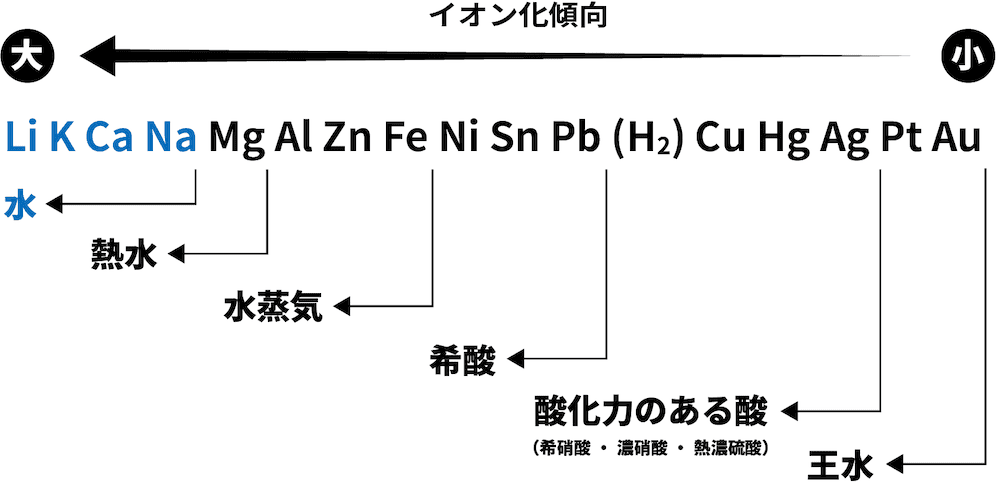
- Naよりイオン化傾向が大きい金属は、常温の水と反応して水酸化物(次の例ではNaOH)と水素H2を生成する。
\[ \mathrm{2Na + 2H_{2}O → 2NaOH + H_{2}} \]
❷ 熱水と反応
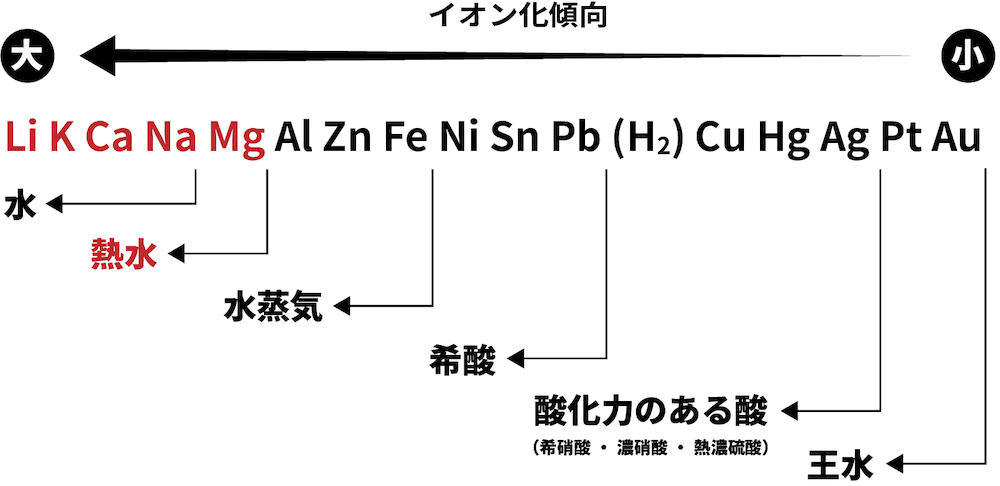
- Mgよりイオン化傾向が大きい金属は、熱水と反応して水酸化物(今回はMg(OH)2)と水素H2を生成する。
\[ \mathrm{Mg + 2H_{2}O → Mg(OH)_{2} + H_{2}} \]
❸ 水蒸気と反応
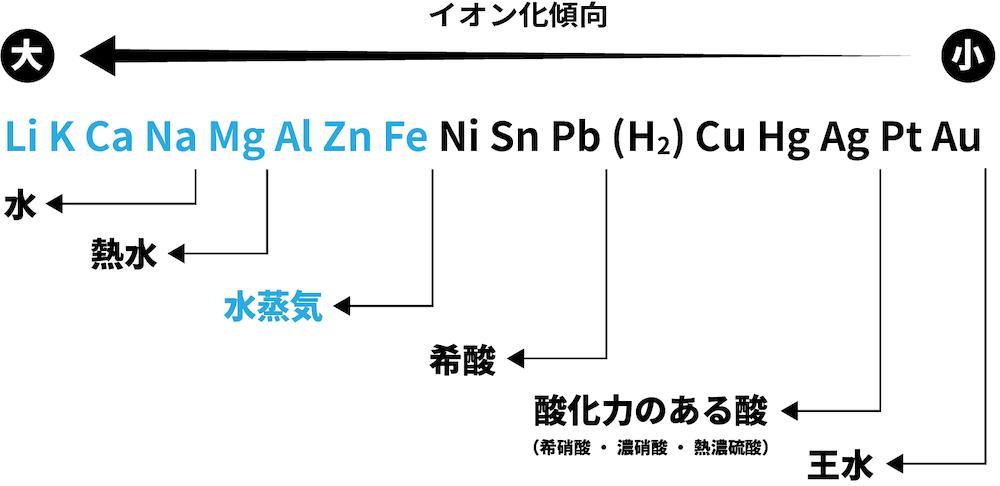
- Feよりイオン化傾向が大きい金属は水蒸気と反応して酸化物(今回はZnO)と水素H2を生成する。
\[ \mathrm{Zn + H_{2}O → ZnO + H_{2}} \]
❹ 希酸と反応
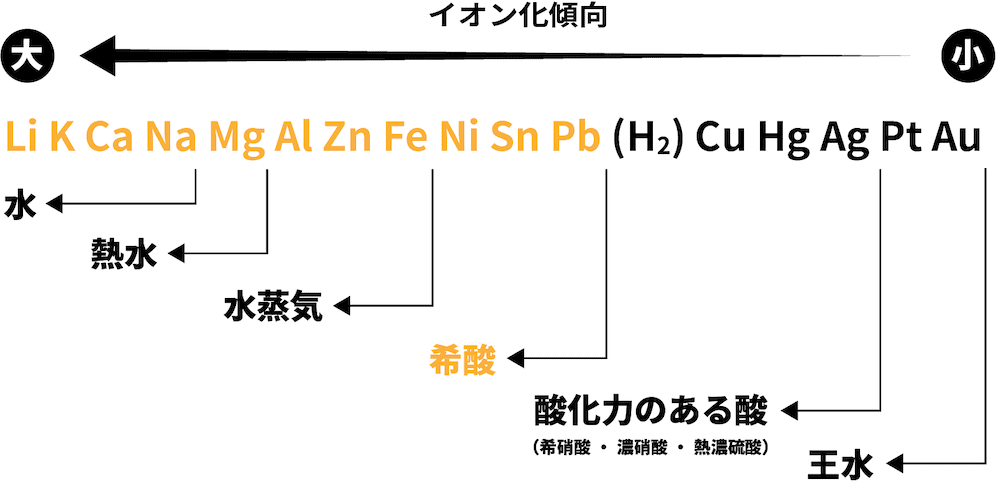
- Pbよりイオン化傾向が大きい金属は希酸(薄い酸)と反応して水素H2を生成する。
\[ \mathrm{Zn + H_{2}SO_{4} → ZnSO_{4} + H_{2}} \]
鉛と希酸
- 鉛Pbと希酸を反応させると、生成物であるPbSO4などがPbの表面を覆ってしまい、それ以上溶けなくなる。
\[\mathrm{Pb+H_{2}SO_{4} → PbSO_{4}+H_{2}}\]
- したがって、他の金属と比べてPbの希酸との反応性は極端に低くなっている。
❺ 酸化力のある酸と反応
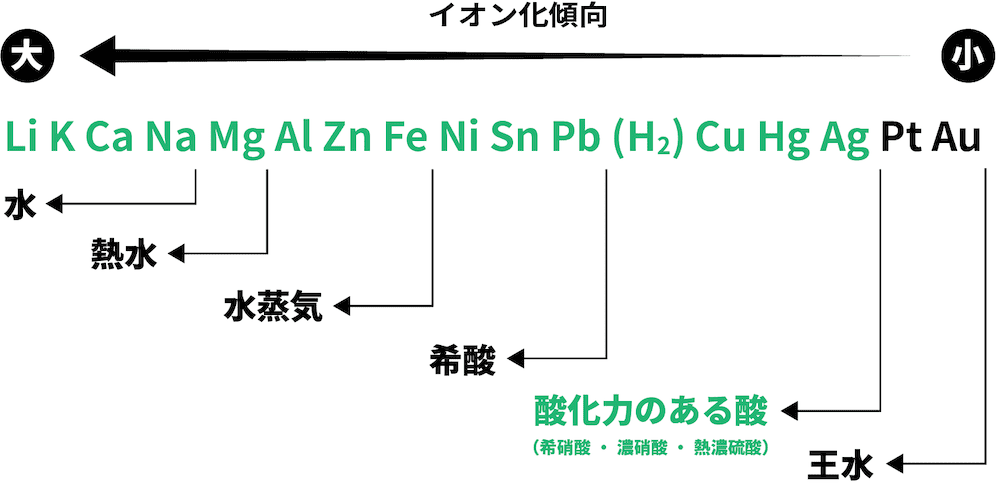
- Agよりイオン化傾向の大きい金属は酸化力のある酸(希硝酸・濃硝酸・熱濃硫酸)と反応する。
\[ \mathrm{Cu + 4HNO_{3} → Cu(NO_{3})_{2} + 2NO_{2} + 2H_{2}O} \]
不動態
- Fe・Ni・Alは濃硝酸に溶けない。
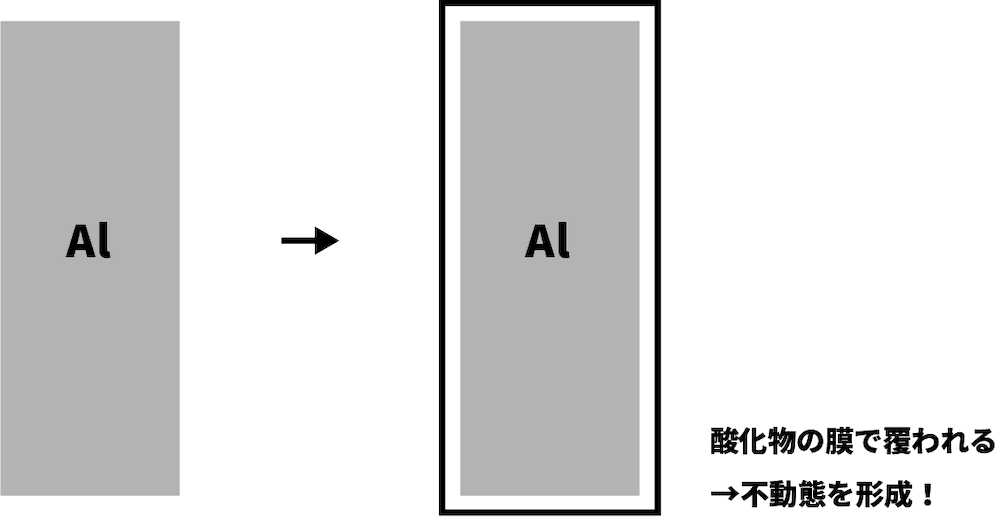
- これは、反応によって生じた酸化物の膜がすぐに金属全体を覆うためである。ちなみに、酸化物の膜によって覆われた金属は不動態とよばれる。
- 不動態について詳しくは次のページを参照のこと。
❻ 王水と反応
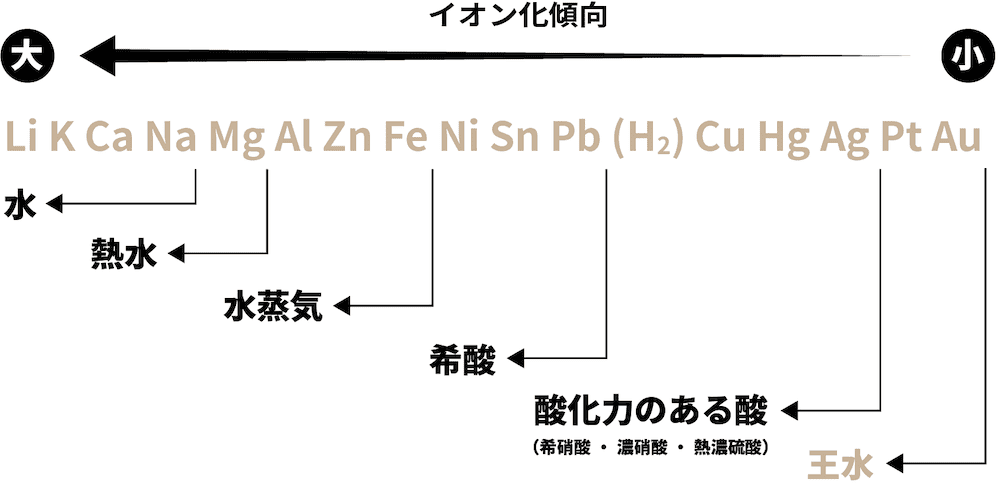
- PtとAuを含めた全ての金属は王水に溶ける。
- ちなみに、王水とは「濃硝酸と塩酸を1:3の割合で混合したもの」である。組成比まで正確に覚えておこう。














