MENU
中和滴定(器具・指示薬・滴定曲線・グラフ・原理など)
はじめに
【プロ講師解説】このページでは『中和滴定(器具・指示薬・滴定曲線・グラフ・原理など)』について解説しています。
中和滴定とは
- 酸塩基反応を利用し、濃度が既知の溶液(=標準液)を用いて、濃度未知の溶液(=試料)の濃度を求める操作を中和滴定という。
中和滴定で用いる実験器具
- 中和滴定で用いる実験器具を紹介する。
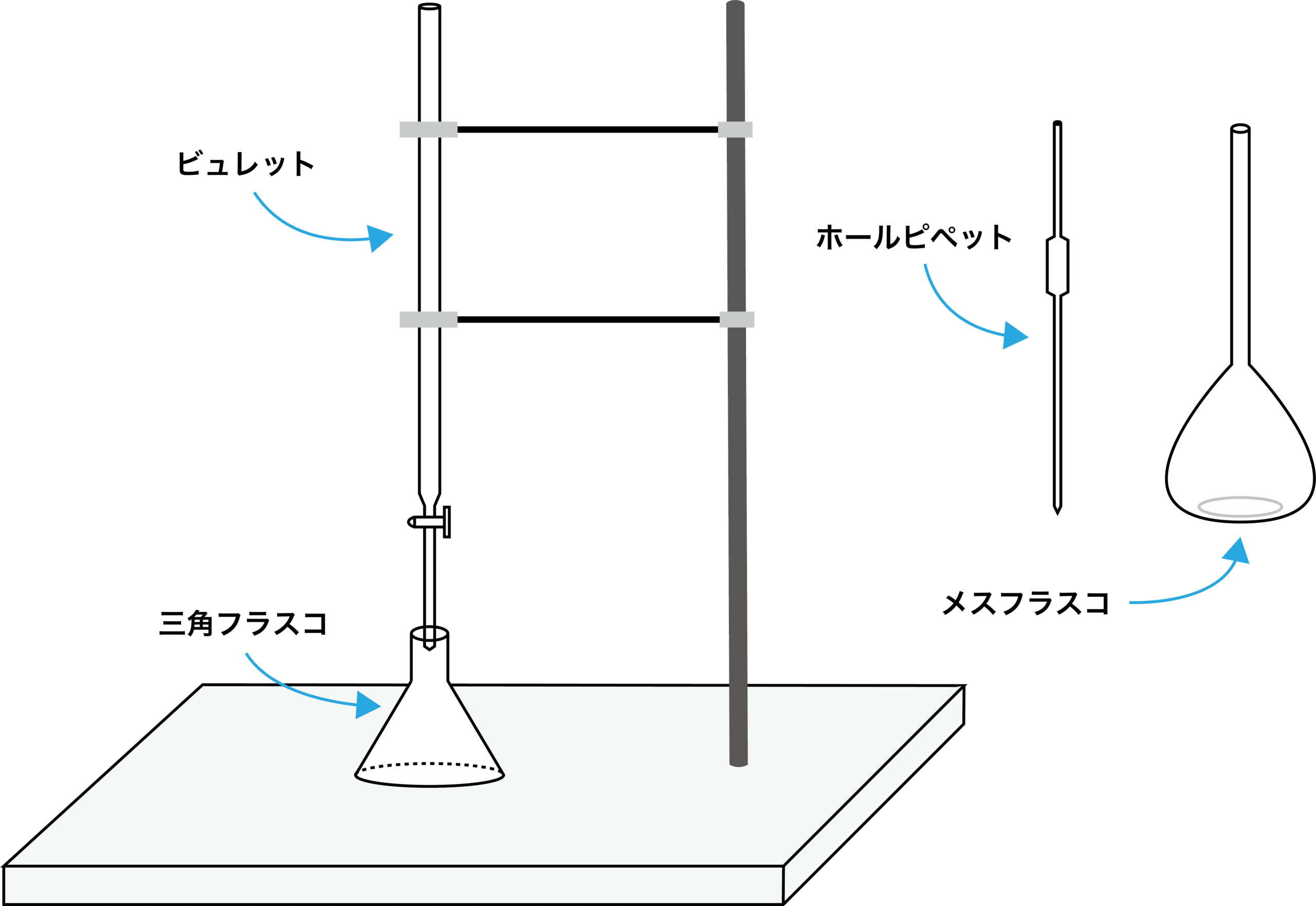
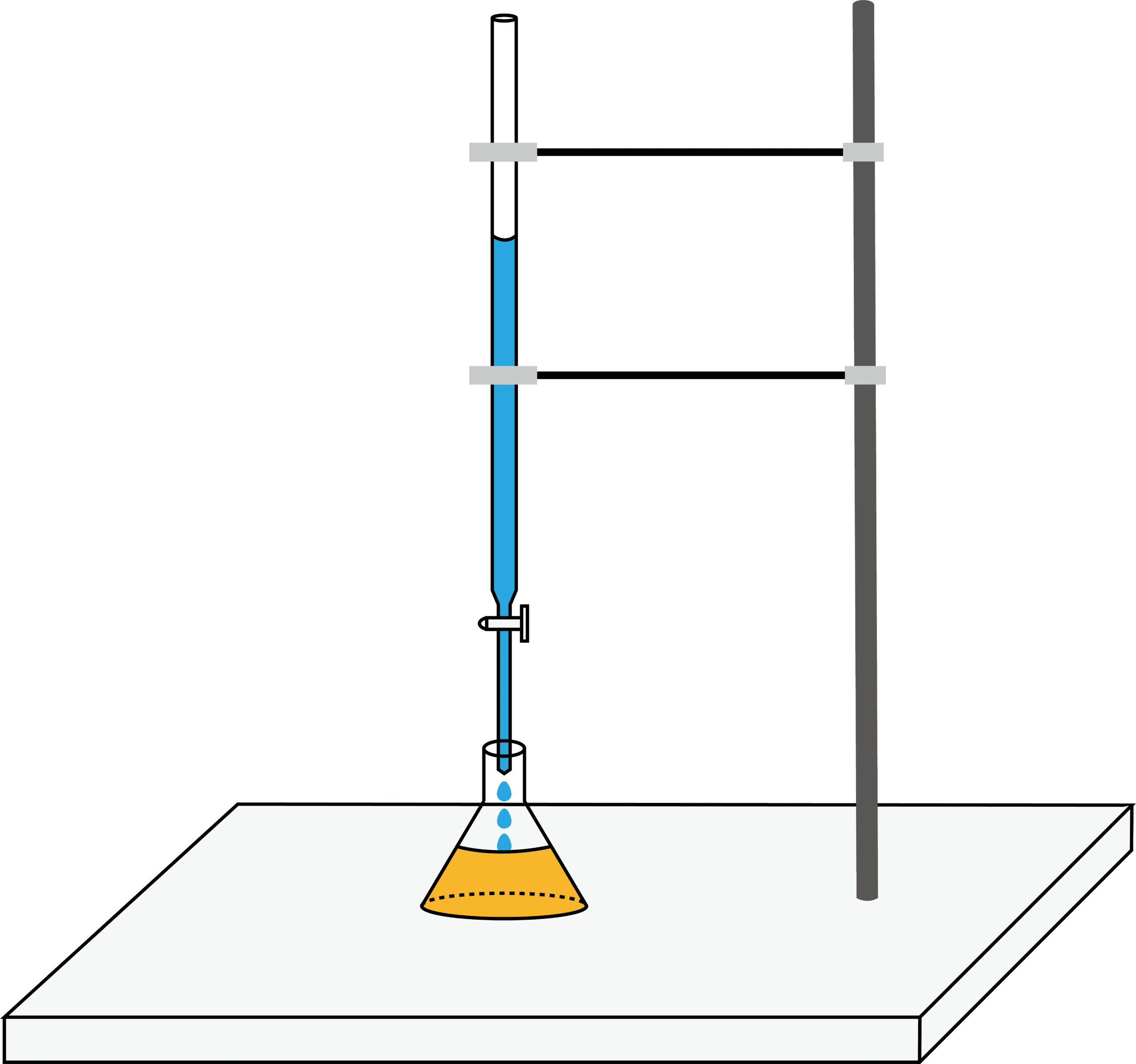
- 中和滴定は主に上の4種類の器具を用いて行われる。それぞれの役割等は次の通りである。
| 器具名 | 用途 | 洗い方 |
|---|---|---|
| メスフラスコ | 標準液を調整する | 純水で洗う→濡れたまま使用 |
| ホールピペット | 正確な量の溶液を計り取る | 純水で洗う→共洗い→濡れたまま使用 |
| ビュレット | 溶液を滴下し、滴下した体積を読み取る | 純水で洗う→共洗い→濡れたまま使用 |
| 三角フラスコ(コニカルビーカー) | 標準液と濃度未知の溶液を反応させる | 純水で洗う→濡れたまま使用 |
- 中和滴定で使用する4種類の器具、メスフラスコ・ホールピペット・ビュレット・三角フラスコ(コニカルビーカー)は、いずれも使用前は純水で洗浄する。その後、共洗いが必要なものは共洗いをし、共洗いが必要ないものは純水で濡れたまま使用する。
| 純水で濡れたまま使用 | メスフラスコ | 希釈をするときに結局純水を加えるため、共洗いをする必要はない |
| 三角フラスコ | 三角フラスコ内に含まれる酸・塩基の“物質量”に影響はないため、共洗いの必要はない | |
| 共洗いをしてから使用 | ホールピペット | 純水で濡れていると溶液の濃度が変化してしまうため、共洗いをする必要がある |
| ビュレット |
中和滴定の流れ
- 中和滴定の流れ・手順を解説する。

中和滴定の流れ
●STEP1
メスフラスコを用いて標準溶液を調製する。
●STEP2
ホールピペットを用いて標準溶液を三角フラスコに移動させる。
●STEP3
濃度不明の溶液をビュレットに入れる。
●STEP4
濃度不明の溶液を滴下する。
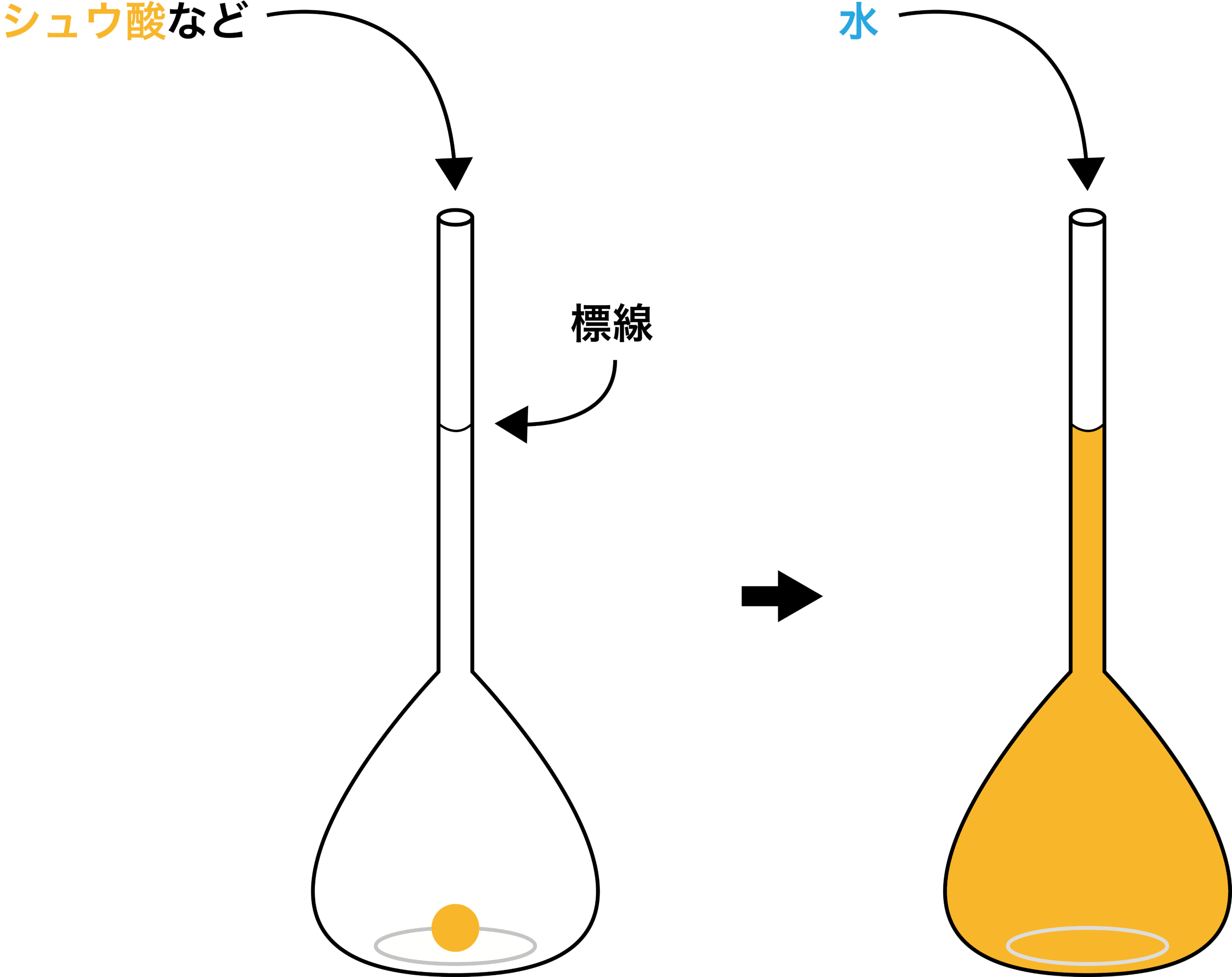
まずは、標準溶液を調製する。標準溶液とは”濃度既知の溶液”であり、中和滴定ではこれを使って”濃度未知の溶液”(=試料)の濃度を求める。標準溶液を調製するときはメスフラスコという道具を用いる。
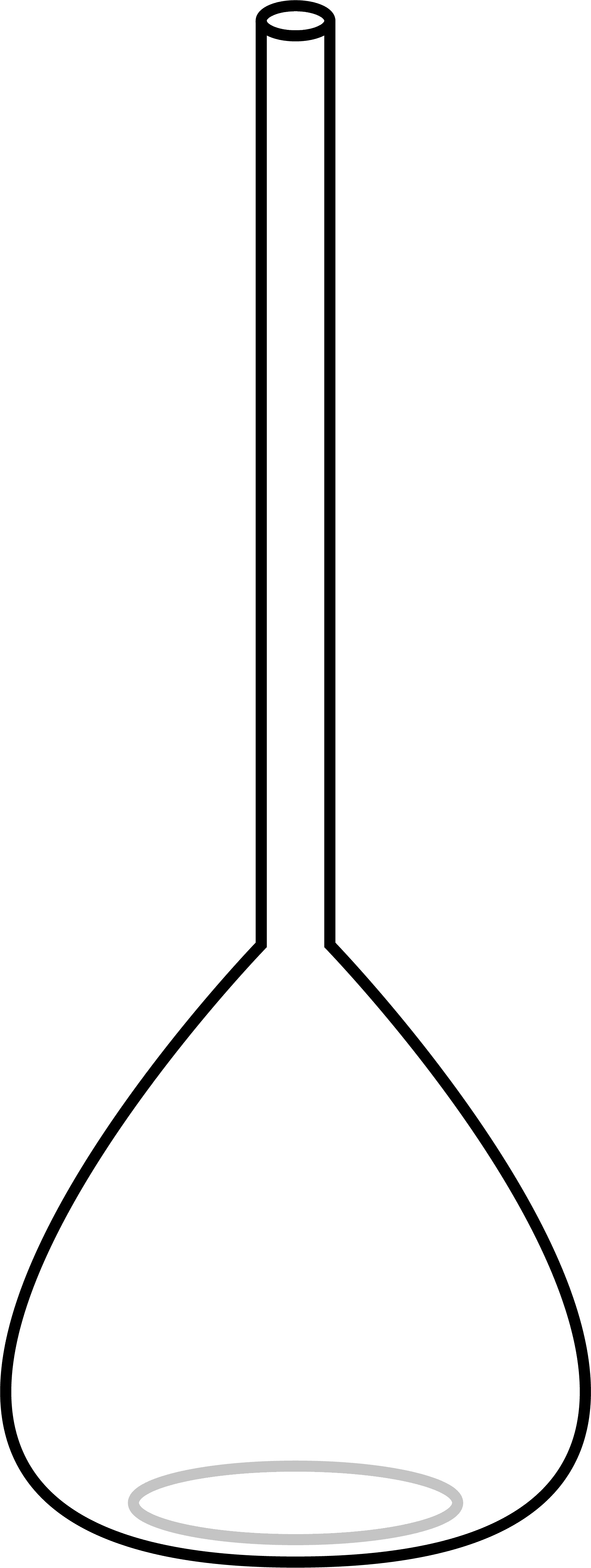
メスフラスコの細くなった先端部分には「標線」という線があり、一定量の化学物質を入れた後にこの線まで水を入れることで、作りたい濃度の溶液を普通のフラスコよりも正確に調製することができる。
次に、ホールピペットを用いて、STEP1で調整した標準溶液を三角フラスコに移動させる。
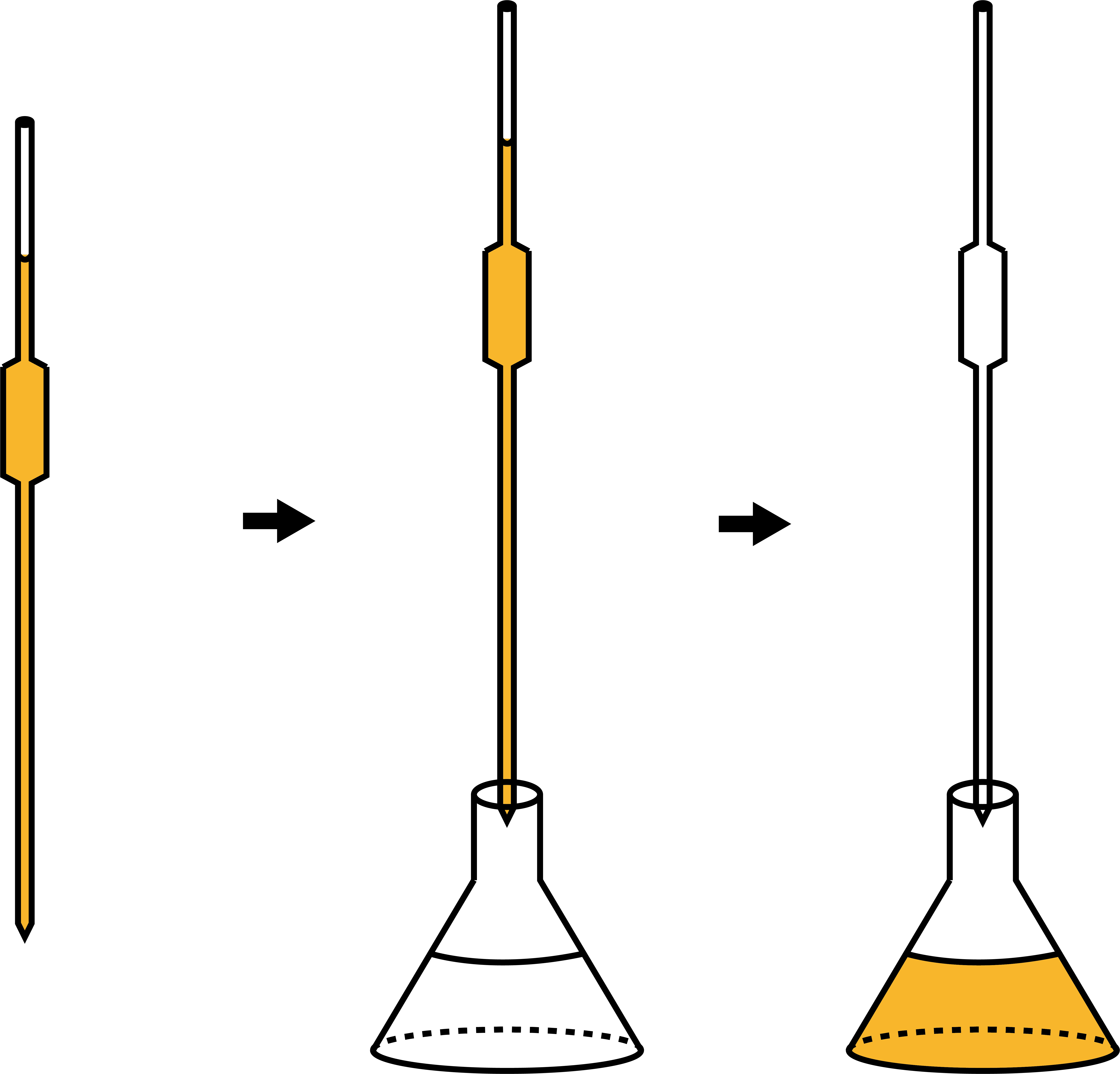
次に、濃度不明の溶液をビュレットに入れる。
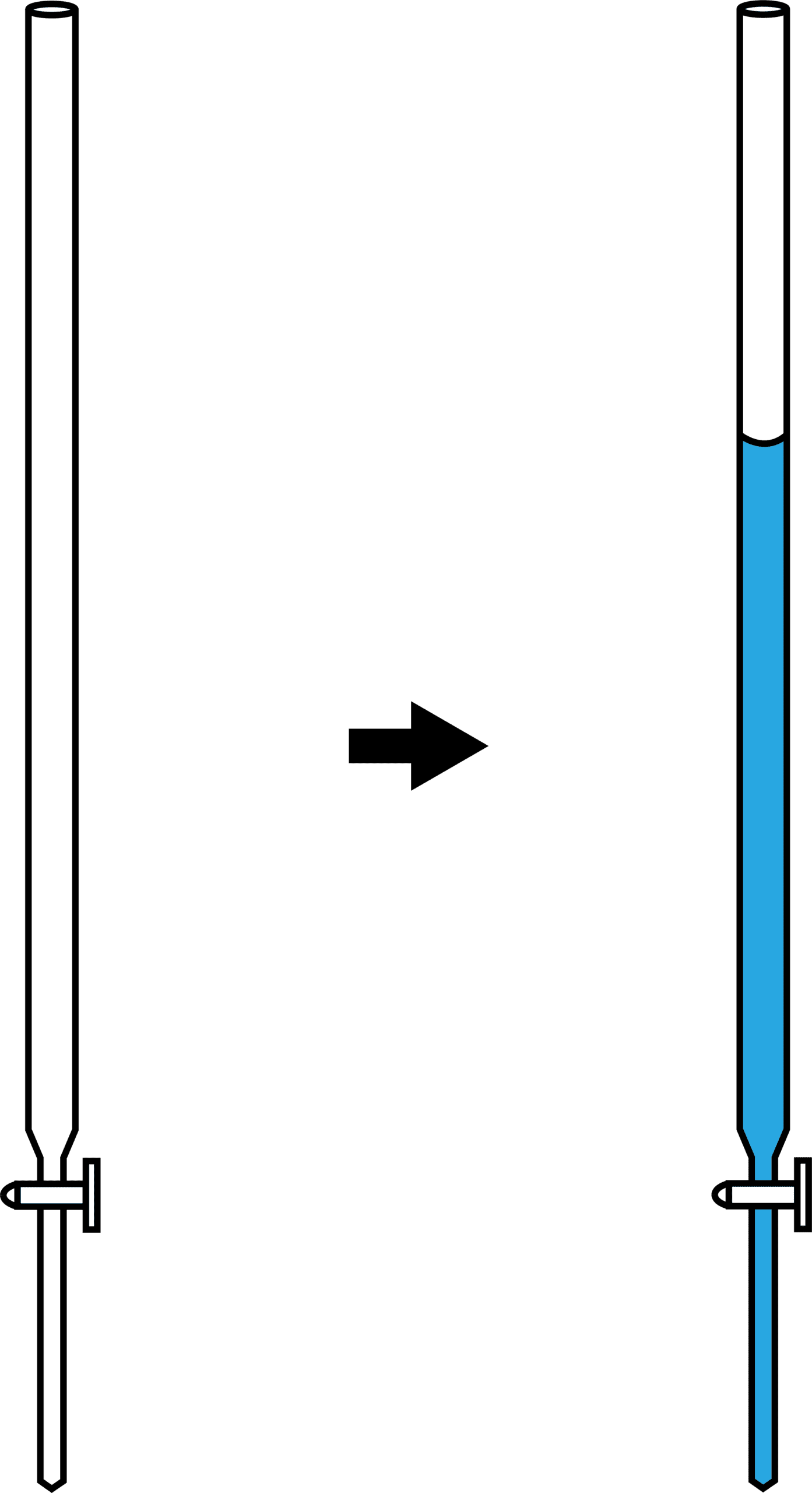
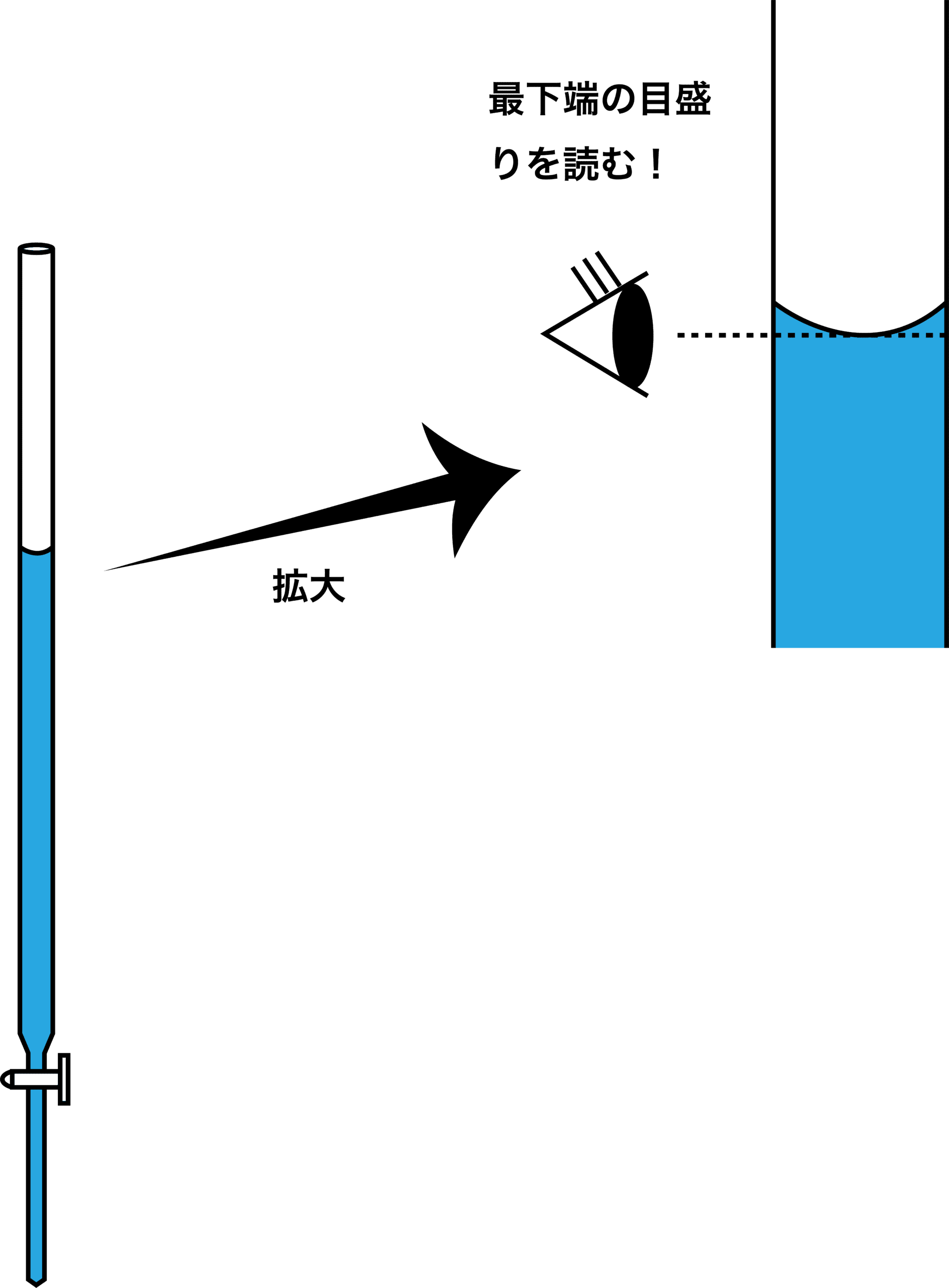
ちなみに、ビュレットの目盛りはボコっとなっている液面の一番下の位置を読むということに注意しよう。
中和滴定と指示薬
- 中和滴定において、単に滴定をしただけではいつ中和点に達したのかを目で見て判断することが難しい。
そこで、指示薬(特定のpHで色が変化する)を用いて、中和が完了したかどうかをチェックする。 - 高校化学でよく出てくる指示薬はフェノールフタレインとメチルオレンジの2種類である。
| 指示薬 | 色の変化 |
|---|---|
| フェノールフタレイン | 約pH8.3〜pH10に変色域をもっており、pHがこの範囲より酸性側だと無色、塩基性側だと赤色になる。 |
| メチルオレンジ | メチルオレンジは約pH3.1〜pH4.4に変色域をもっており、pHがこの範囲より酸性側だと赤色、塩基性側だと黄色になる。 |
中和滴定と滴定曲線
- 酸・塩基の滴下量に対して溶液のpHがどのように変化していくかを表したグラフを滴定曲線という。
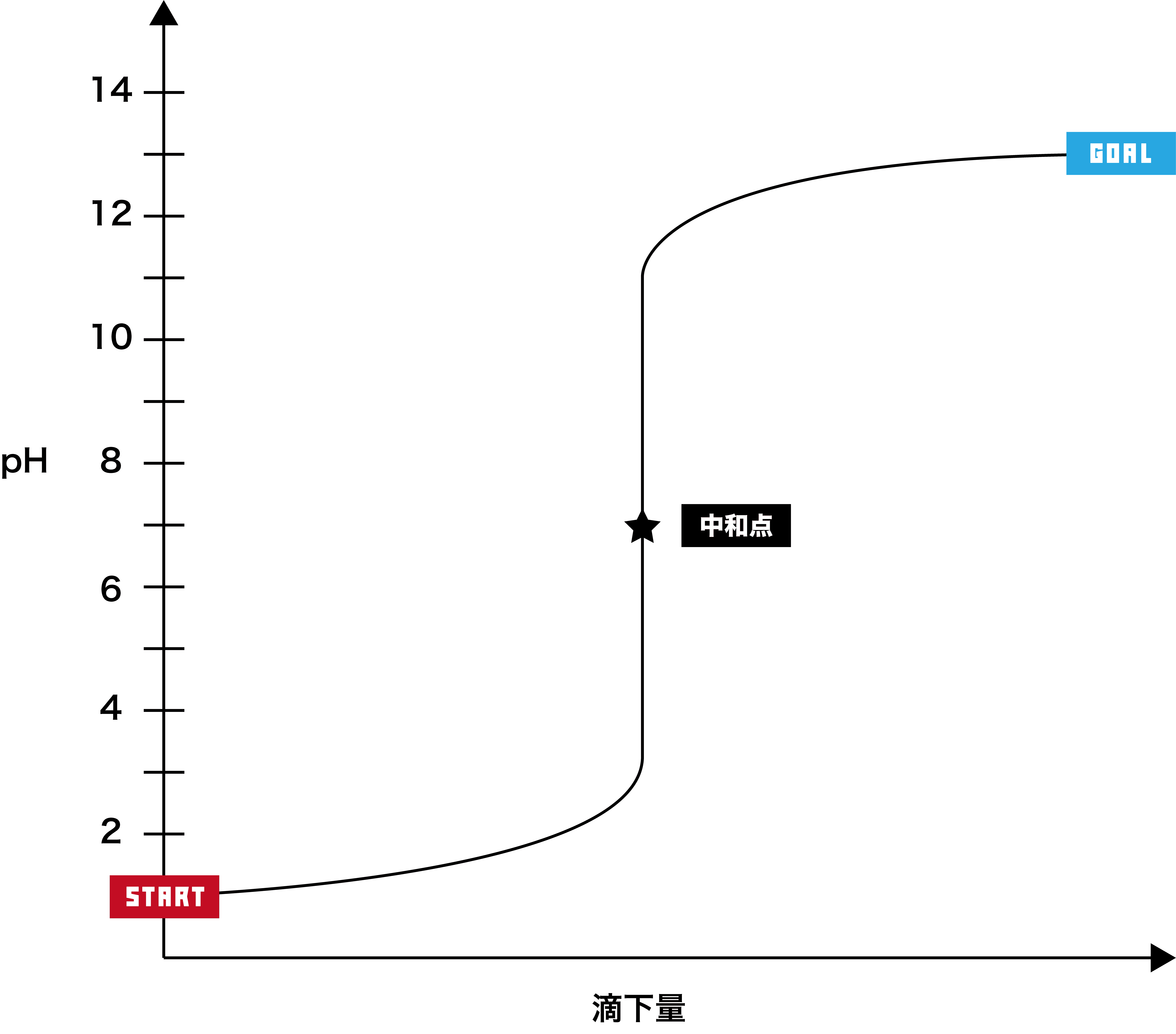
- 滴定曲線について、次の3STEPで解説する。
●STEP1
スタート時は酸しかないため、pHは7より低い。
●STEP2
塩基を加えると、徐々にpHが上昇する。
●STEP3
最終的にpH12前後で一定となる。
酸に塩基を滴下する場合
スタート時は酸しかないため、pHは7より低い。

次に、塩基を加えると、徐々にpHが上昇する。
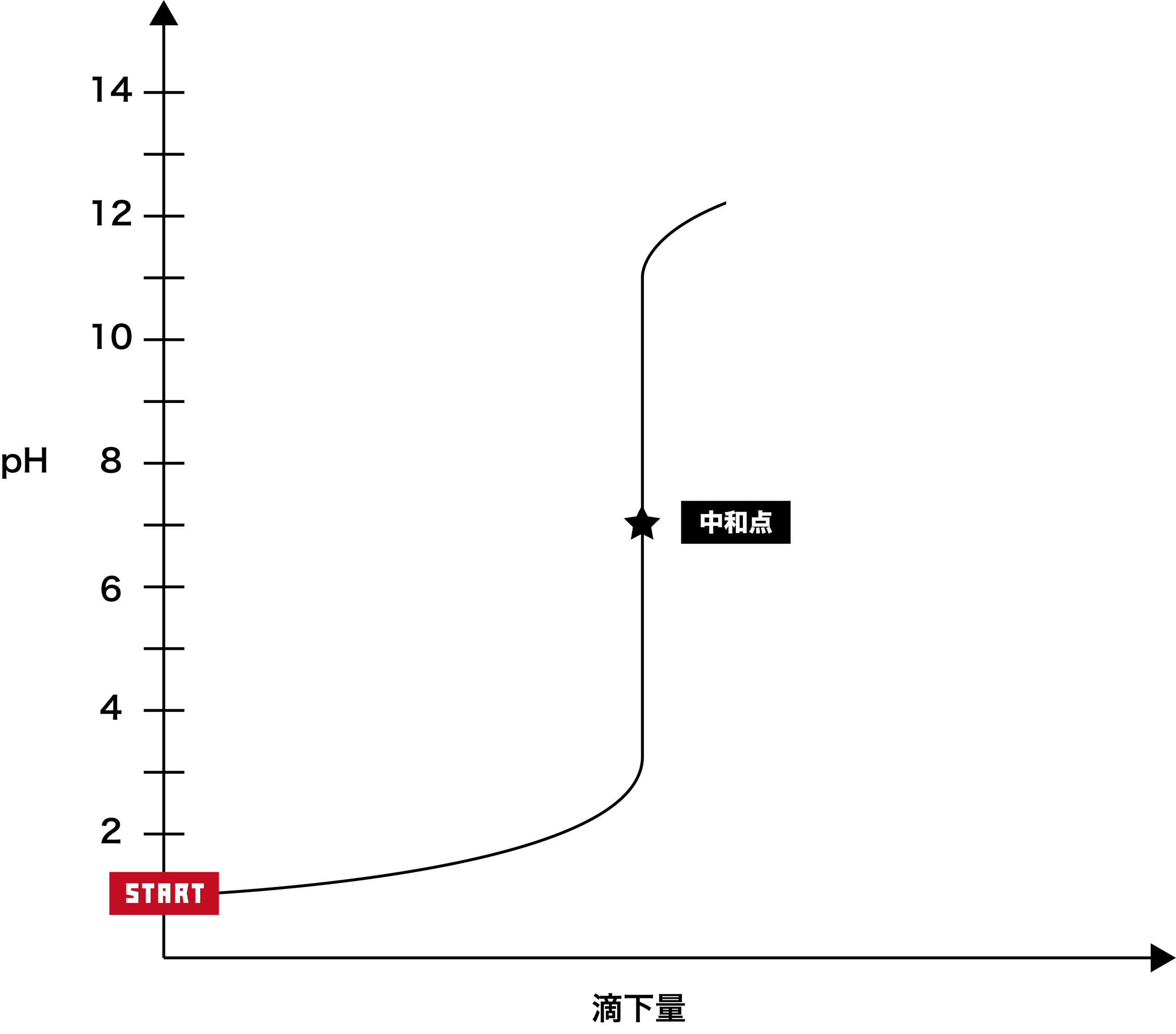
最終的にpH12前後で一定となる。

★の位置は中和点である。垂直な部分(pHが急激に上昇=pHジャンプしている部分)の中心部が中和点となる。
ここで、この滴定曲線を指示薬の変域と組み合わせる。
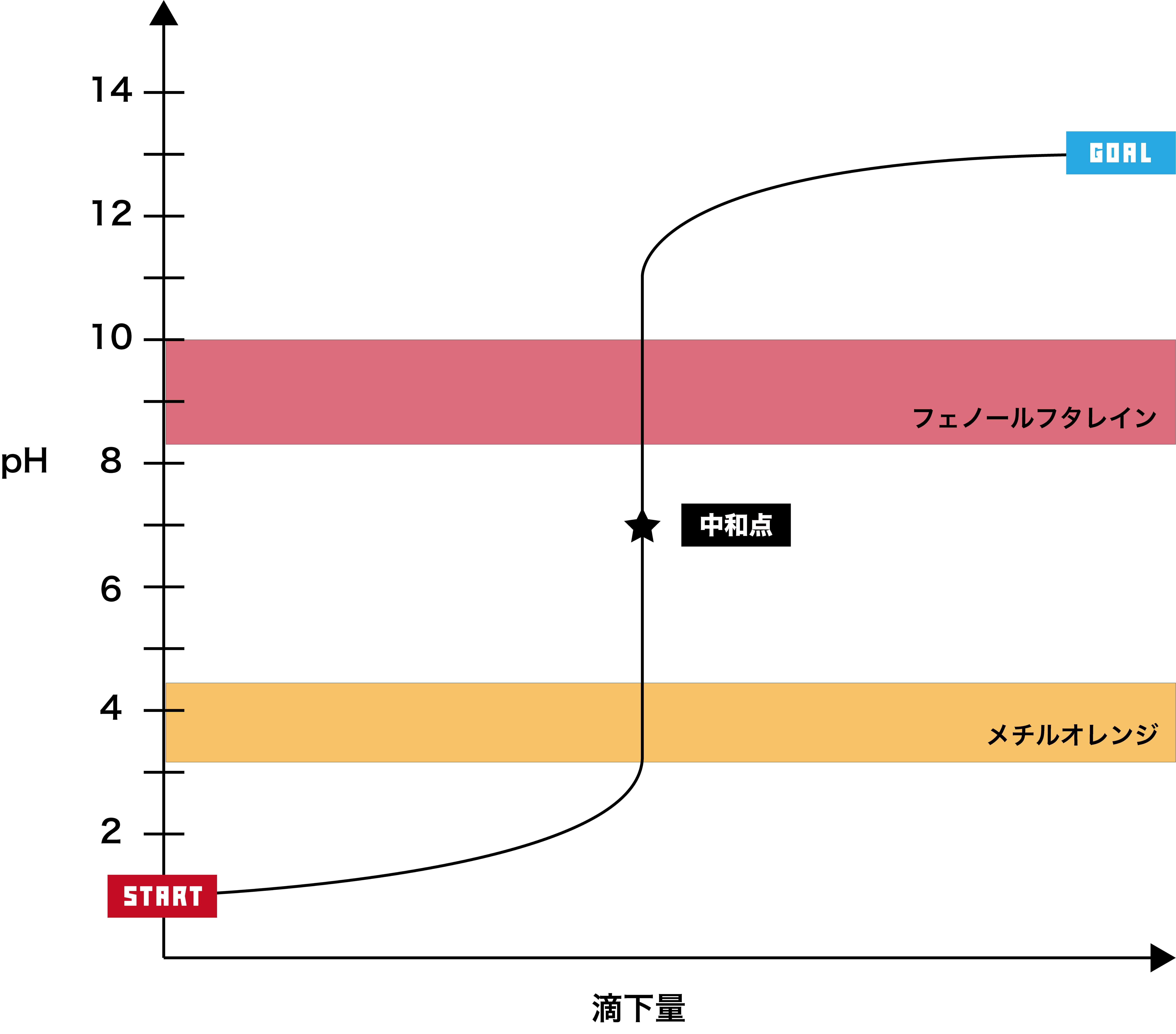
赤はフェノールフタレインの変色域であるpH8.3〜pH10、オレンジはメチルオレンジの変色域であるpH3.1〜pH4.4を表している。
指示薬の変色域の中にpHジャンプの部分が入っていればその指示薬を用いて中和点を確認することができるため、この滴定の場合、フェノールフタレイン・メチルオレンジともに使用可能である。
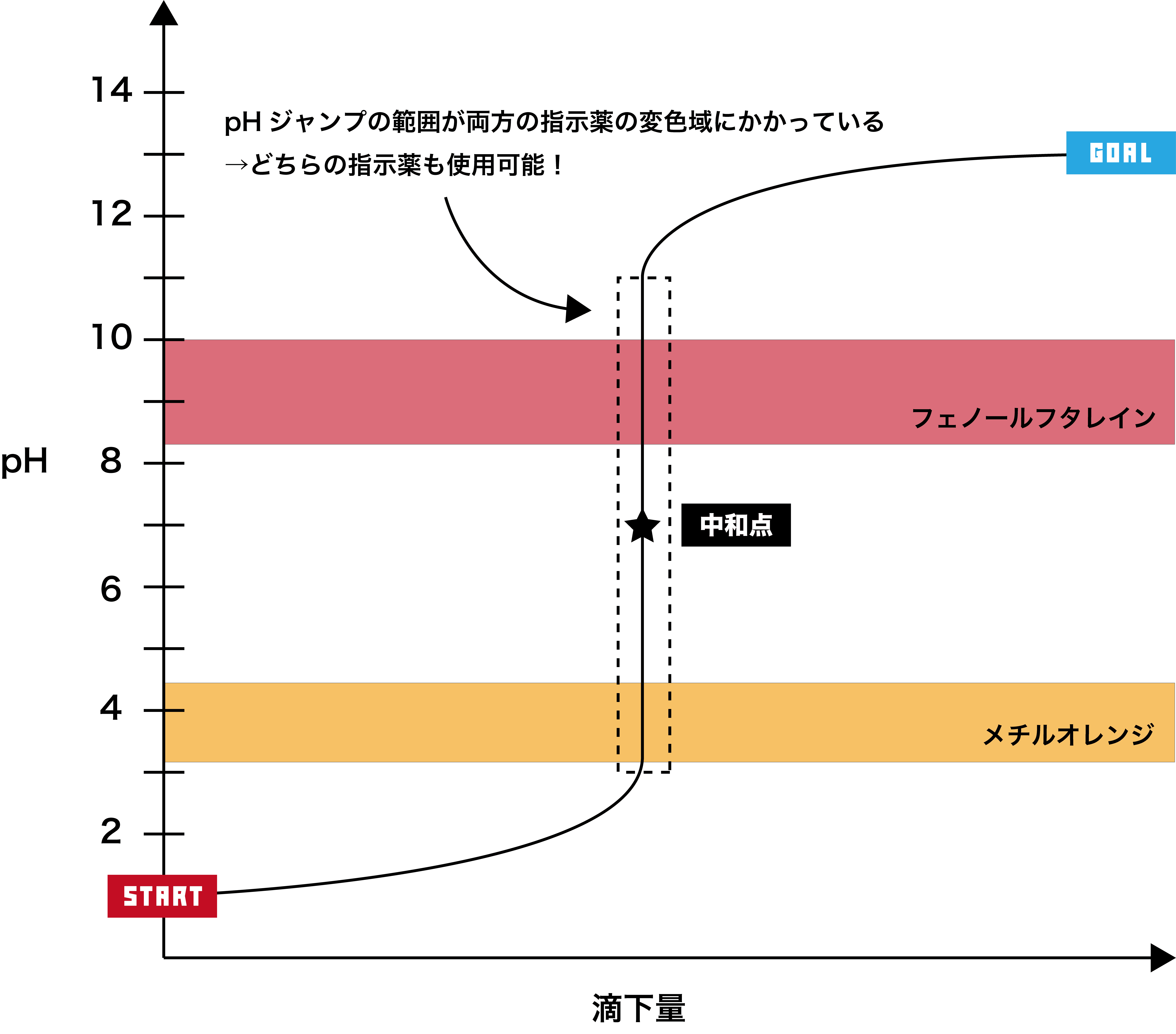
酸に塩基を加える場合の滴定曲線
- 酸に塩基を加える場合の滴定曲線を4種類紹介する。
強酸+強塩基

●STEP1
強酸は基本的にpHが2以下なので、そこからスタートする。
●STEP2
強塩基を加えると、徐々にpHが上昇する。
●STEP3
強塩基のpHは12程度なので、最終的にそのあたりで一定となる。
- このグラフでは、pHジャンプの範囲(=pHが急激に変化している範囲=垂直になっている範囲)が約pH3〜11で、フェノールフタレイン・メチルオレンジ両方の変色域を含むため、どちらの指示薬も使用できる。
強酸+弱塩基
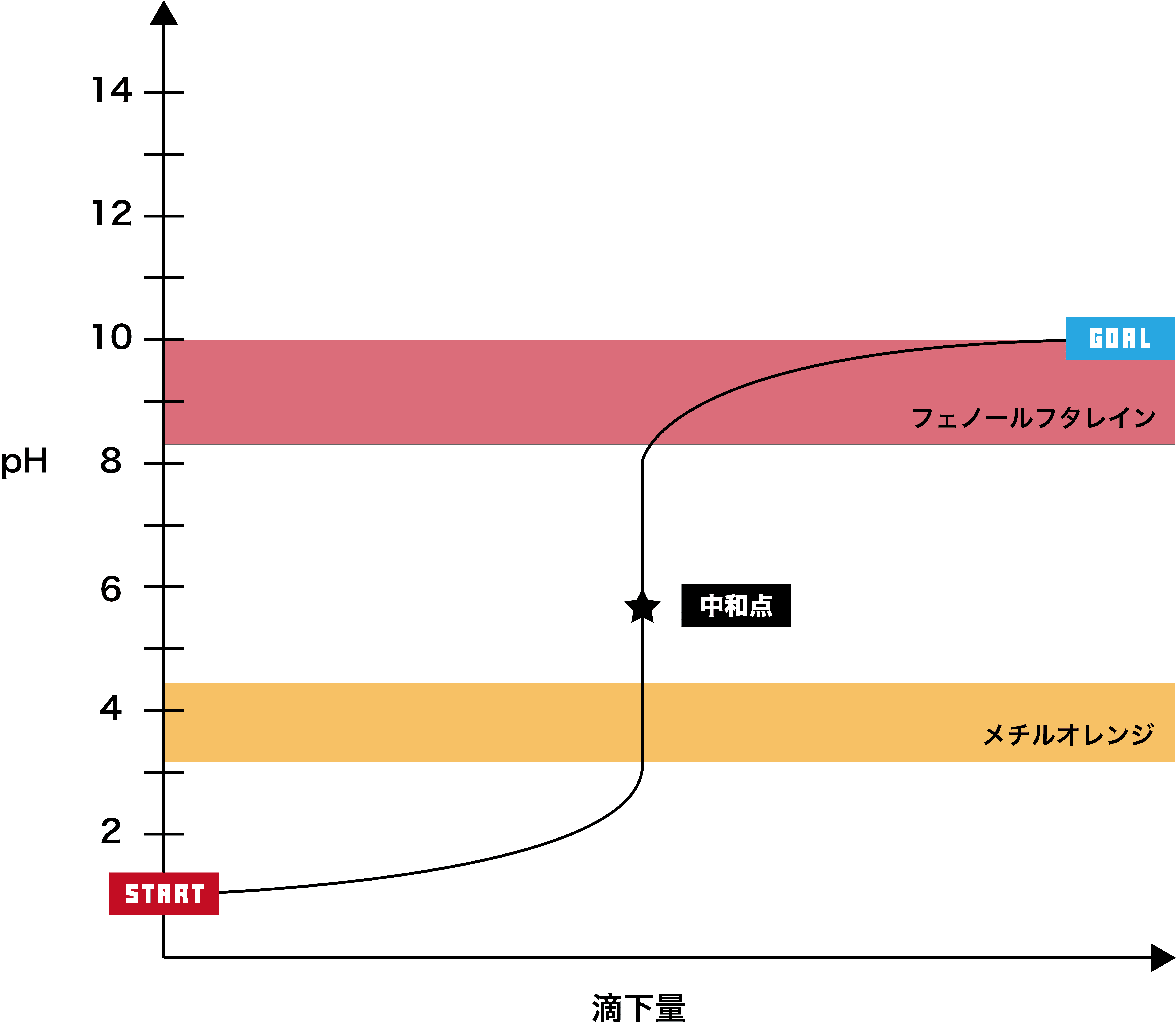
●STEP1
強酸は基本的にpHが2以下なので、そこからスタートする。
●STEP2
弱塩基を加えると、徐々にpHが上昇する。
●STEP3
弱塩基のpHは10程度なので、最終的にそのあたりで一定となる。
- このグラフでは、pHジャンプの範囲が約pH3〜8で、メチルオレンジの変色域を含むため、指示薬として用いるのはメチルオレンジである。
弱酸+強塩基
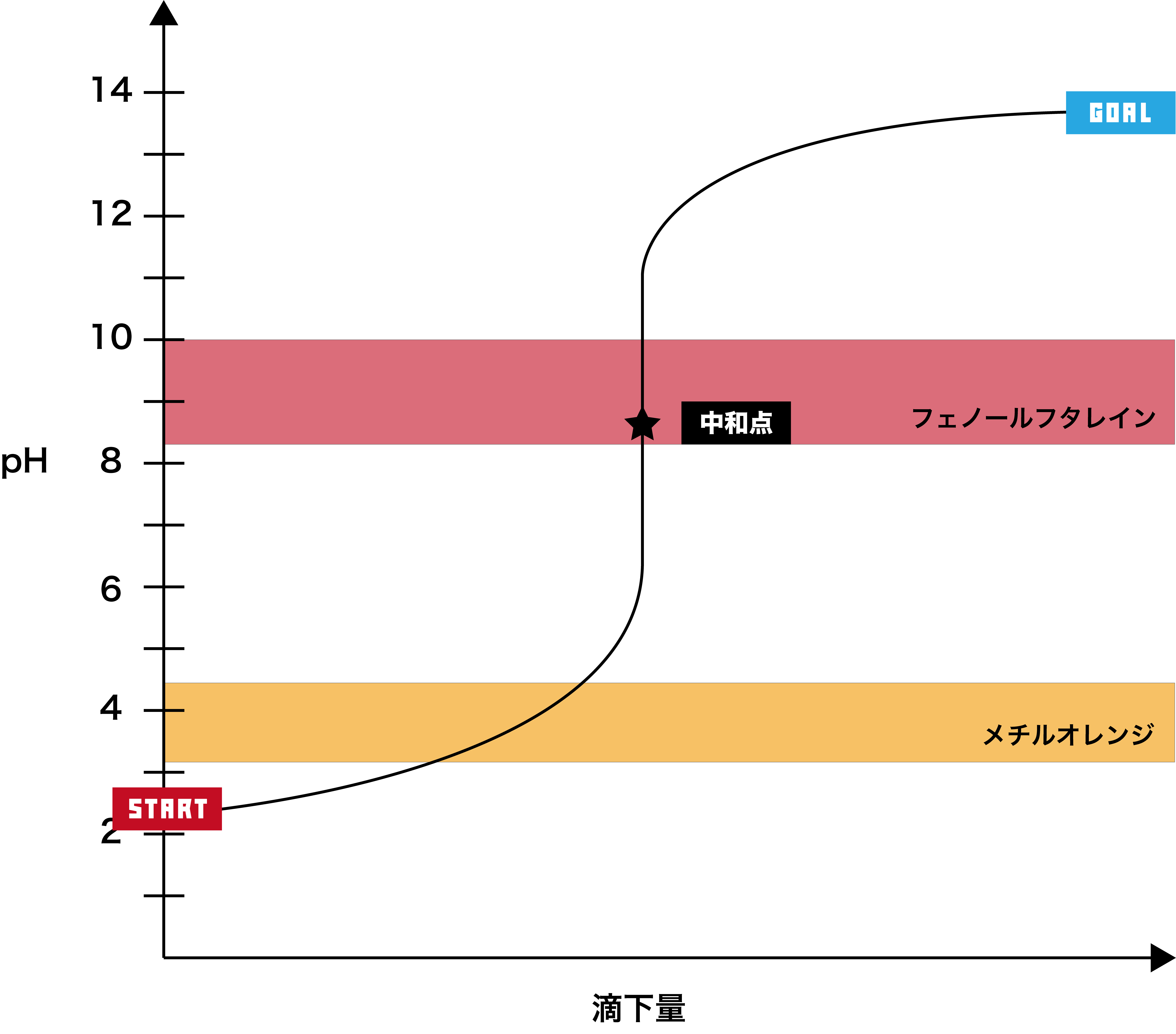
●STEP1
弱酸は基本的にpHが2以上なので、そこからスタートする。
●STEP2
強塩基を加えると、徐々にpHが上昇する。
●STEP3
強塩基のpHは12以上なので、最終的にそのあたりで一定となる。
- このグラフでは、pHジャンプの範囲が約pH6〜11で、フェノールフタレインの変色域を含むため、指示薬として用いるのはフェノールフタレインである。
弱酸+弱塩基
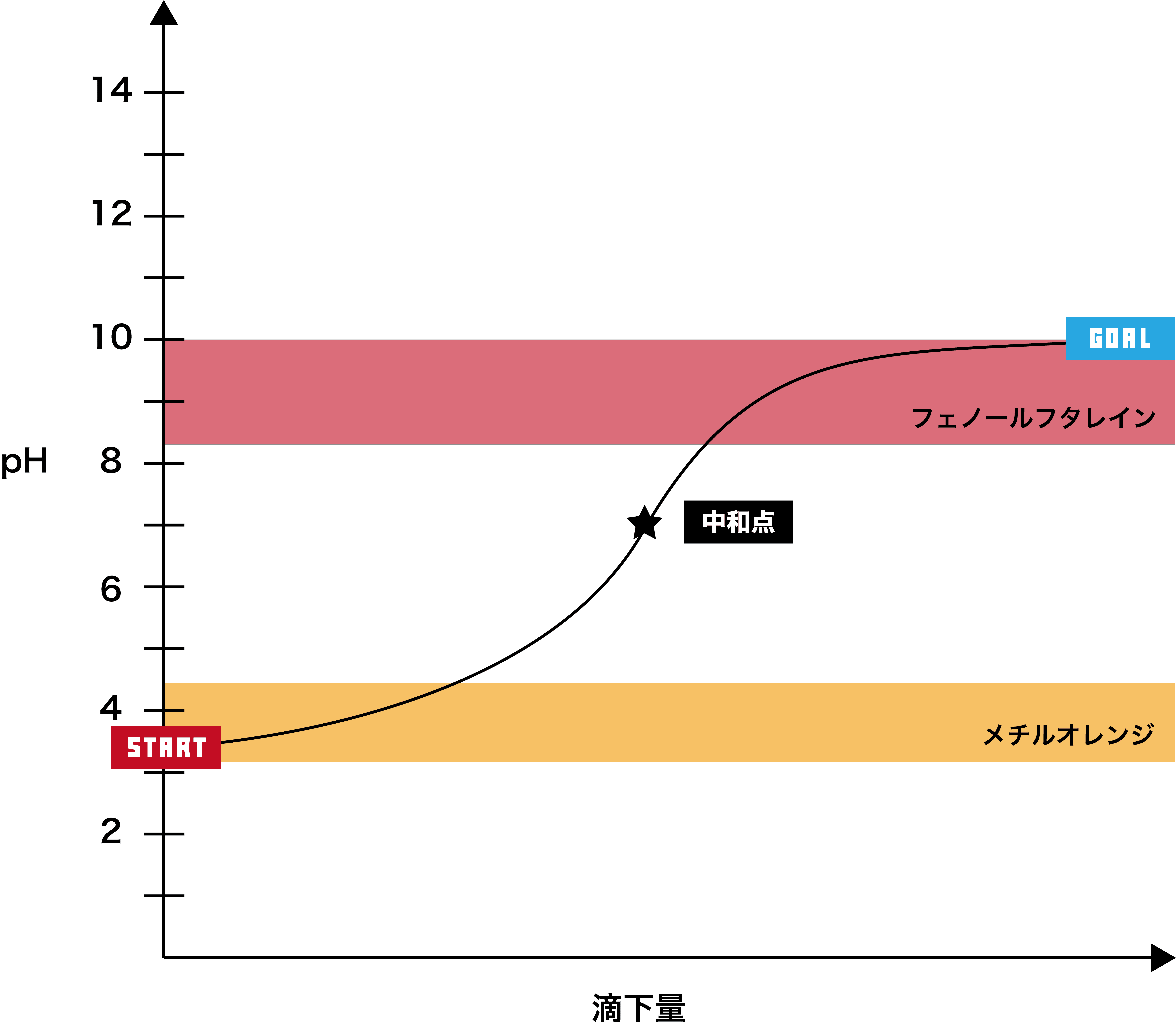
●STEP1
弱酸は基本的にpHが2以上なので、そこからスタートする。
●STEP2
弱塩基を加えると、徐々にpHが上昇する。
●STEP3
弱塩基のoHは10程度なので、最終的にそのあたりで一定となる。
- このグラフでは、グラフが垂直になっている部分はない。(なんとなく緩やかに上がっていく感じ)
- したがって、フェノールフタレイン・メチルオレンジどちらの指示薬も使うことができない。
- また、弱酸と弱塩基の中和滴定の中和点はpH7付近になるが、電離度の関係で7ちょうどにはならない。
塩基に酸を加える場合の滴定曲線
- 塩基に酸を加える場合の滴定曲線を4種類紹介する。
強塩基+強酸
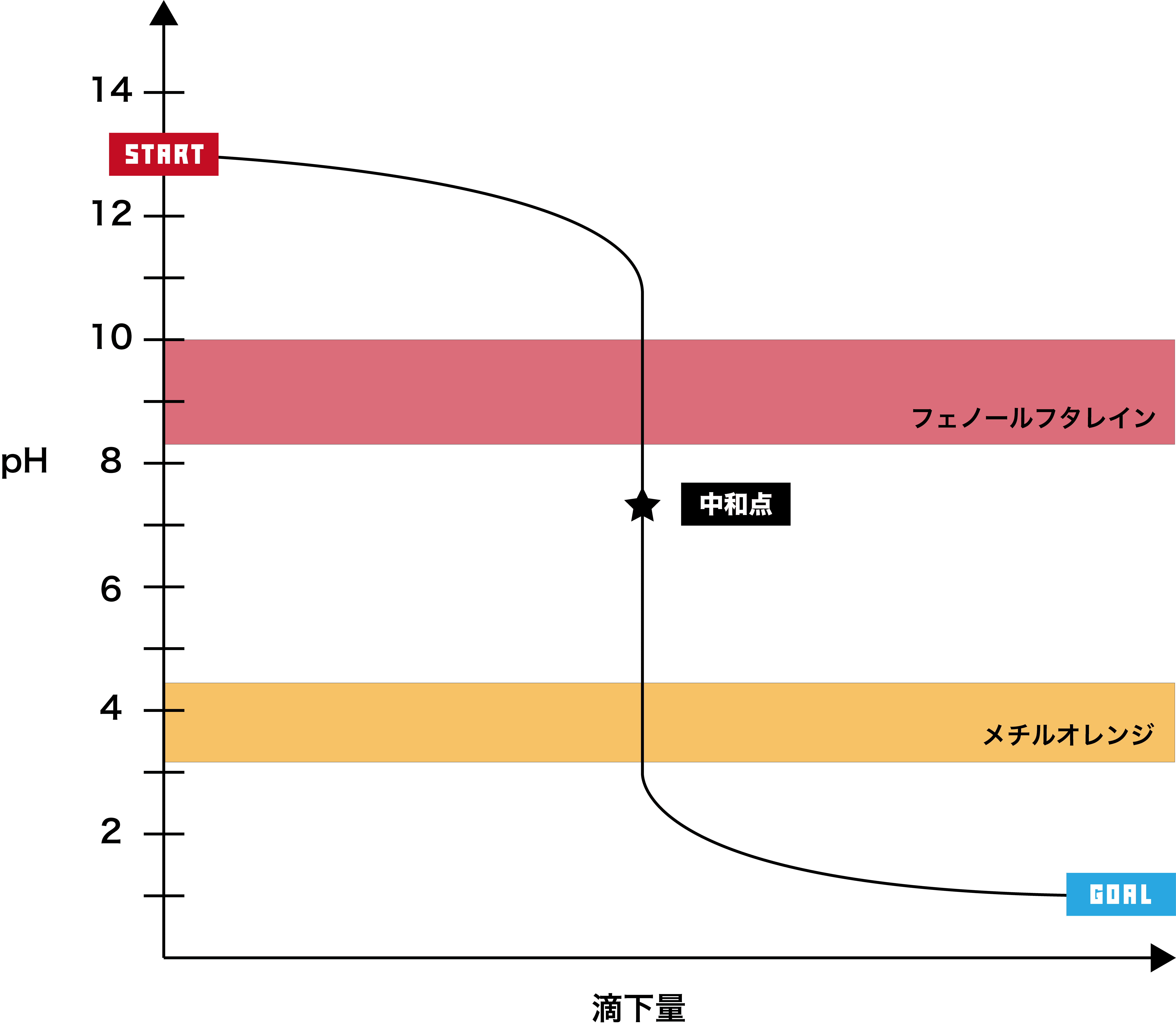
●STEP1
強塩基は基本的にpHが12以上なので、そこからスタートする。
●STEP2
強酸を加えると、徐々にpHが下降する。
●STEP3
強酸のpHは2以下なので、最終的にそのあたりで一定となる。
- このグラフでは、pHジャンプの範囲(=pHが急激に変化している範囲=垂直になっている範囲)が約pH3〜11で、フェノールフタレイン・メチルオレンジ両方の変色域を含むため、どちらの指示薬も使用できる。
強塩基+弱酸
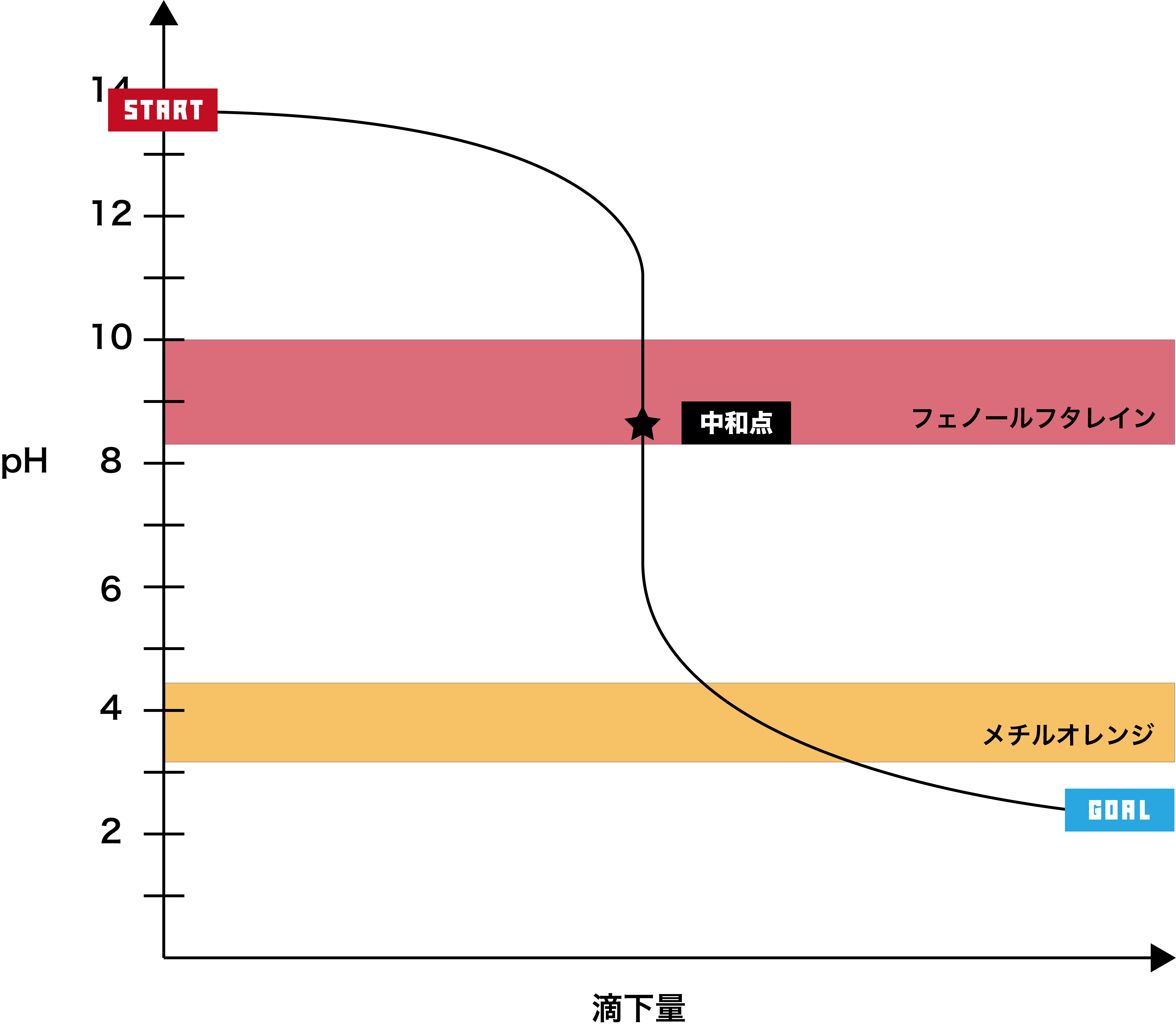
●STEP1
強塩基は基本的にpHが12以上なので、そこからスタートする。
●STEP2
弱酸を加えると、徐々にpHが下降する。
●STEP3
弱酸のpHは2以上なので、最終的にそのあたりで一定となる。
- このグラフでは、pHジャンプの範囲が約pH6〜11で、フェノールフタレインの変色域を含むため、指示薬として用いることができるのはフェノールフタレインである。
弱塩基+強酸
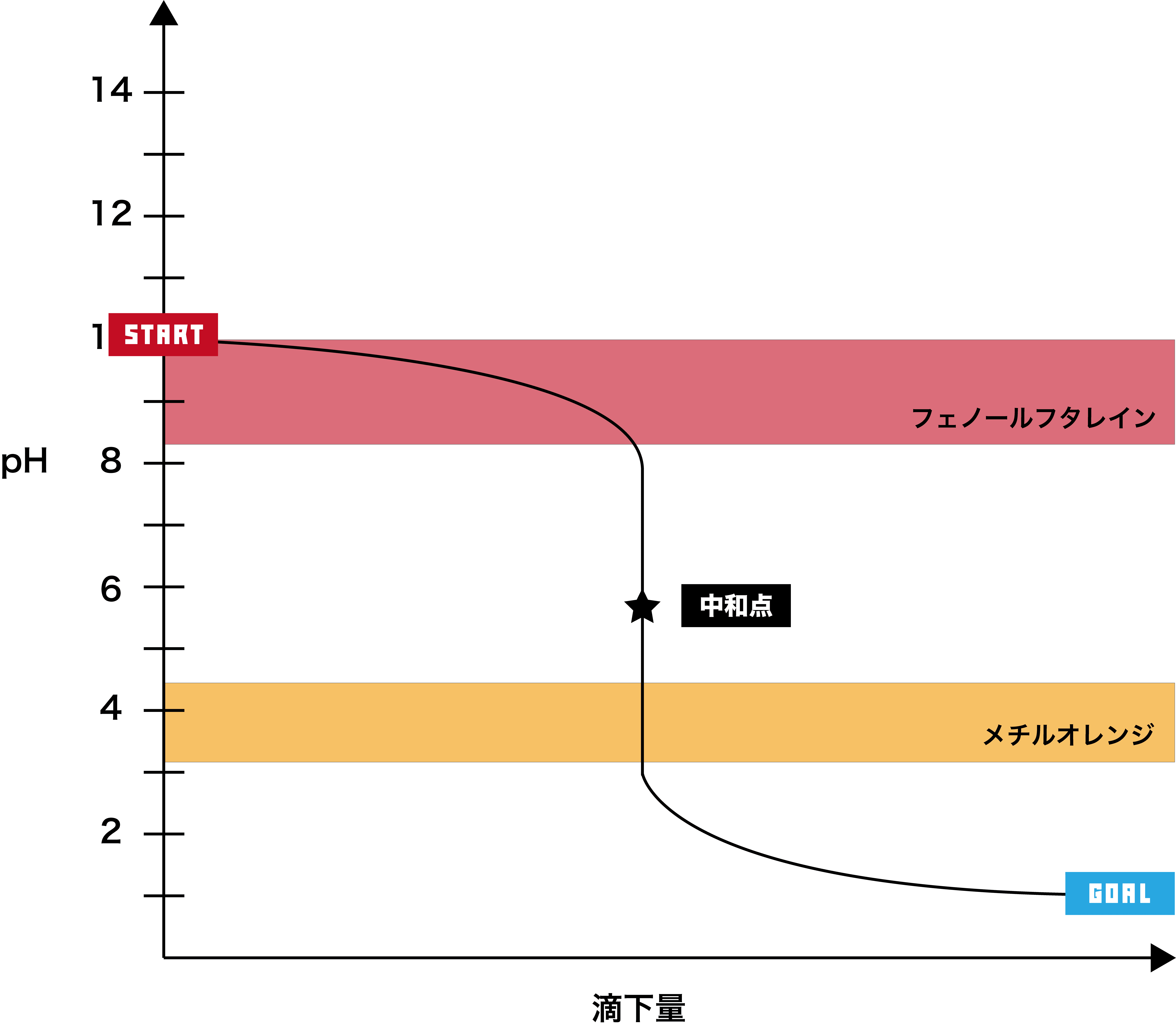
●STEP1
弱塩基は基本的にpHが10付近なので、そこからスタートする。
●STEP2
強酸を加えると、徐々にpHが下降する。
●STEP3
強酸のpHは2以下なので、最終的にそのあたりで一定となる。
- このグラフでは、pHジャンプの範囲が約pH3〜8で、メチルオレンジの変色域を含むため、指示薬として用いるのはメチルオレンジである。
弱塩基+弱酸
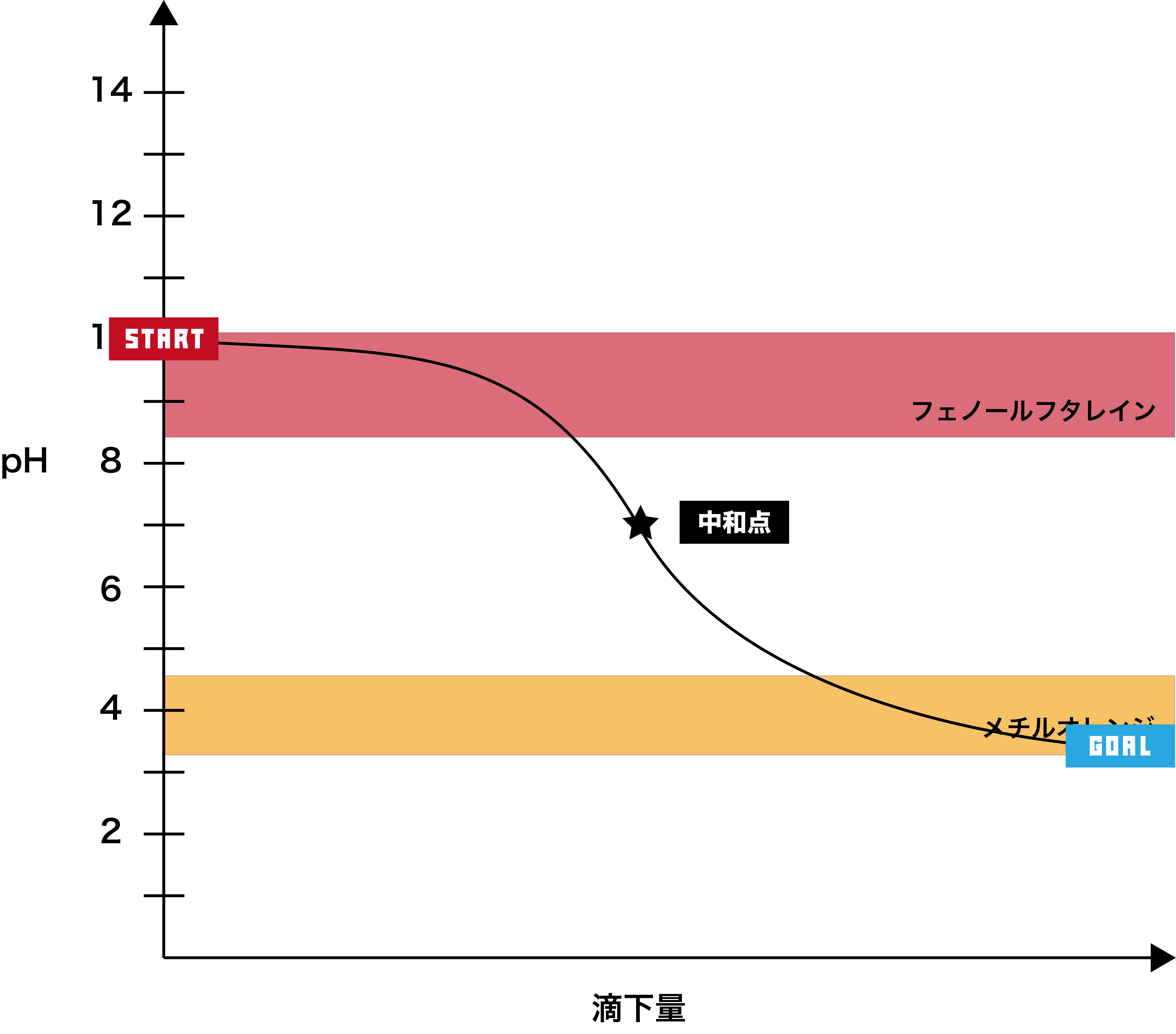
●STEP1
弱塩基は基本的にpHが10付近なので、そこからスタートする。
●STEP2
弱酸を加えると、徐々にpHが下降する。
●STEP3
弱酸のpHは2以上なので、最終的にそのあたりで一定となる。
- このグラフでは、グラフが垂直になっている部分はない。(なんとなく緩やかに上がっていく感じ)
- したがって、フェノールフタレイン・メチルオレンジどちらの指示薬も使うことができない。
- また、弱塩基と弱酸の中和滴定の中和点はpH7付近になるが、電離度の関係で7ちょうどにはならない。
中和滴定まとめ
この『中和滴定(器具・指示薬・滴定曲線・グラフ・原理など)』のページで解説した内容をまとめる。
- 酸塩基反応を利用し、濃度が既知の溶液(=標準液)を用いて、濃度未知の溶液(=試料)の濃度を求める操作を中和滴定という。
- 中和滴定に用いる器具の役割等は次の通りである。
| 器具名 | 用途 | 洗い方 |
|---|---|---|
| メスフラスコ | 標準液を調整する | 純水で洗う→濡れたまま使用 |
| ホールピペット | 正確な量の溶液を計り取る | 純水で洗う→共洗い→濡れたまま使用 |
| ビュレット | 溶液を滴下し、滴下した体積を読み取る | 純水で洗う→共洗い→濡れたまま使用 |
| 三角フラスコ(コニカルビーカー) | 標準液と濃度未知の溶液を反応させる | 純水で洗う→濡れたまま使用 |
- 中和滴定は次の流れで行われる。
●STEP1
メスフラスコを用いて標準溶液を調製する。
●STEP2
ホールピペットを用いて標準溶液を三角フラスコに移動させる。
●STEP3
濃度不明の溶液をビュレットに入れる。
●STEP4
濃度不明の溶液を滴下する。 - 中和滴定の代表的な指示薬は次の通りである。
| 指示薬 | 色の変化 |
|---|---|
| フェノールフタレイン | 約pH8.3〜pH10に変色域をもっており、pHがこの範囲より酸性側だと無色、塩基性側だと赤色になる。 |
| メチルオレンジ | メチルオレンジは約pH3.1〜pH4.4に変色域をもっており、pHがこの範囲より酸性側だと赤色、塩基性側だと黄色になる。 |
- 酸・塩基の滴下量に対して溶液のpHがどのように変化していくかを表したグラフを滴定曲線という。
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
酸塩基反応を利用し、濃度が既知の溶液(=標準液)を用いて、濃度未知の溶液(=試料)の濃度を求める操作を【1】という。
解答/解説:タップで表示
解答:【1】中和滴定
酸塩基反応を利用し、濃度が既知の溶液(=標準液)を用いて、濃度未知の溶液(=試料)の濃度を求める操作を中和滴定という。