MENU
結合エンタルピー(定義・計算問題の解き方など)
はじめに
このページでは『結合エンタルピー(定義・計算問題の解き方など)』について解説しています。
結合エンタルピーとは
- 原子間の共有結合を切断するとき、および原子間に共有結合を形成するとき、熱の出入りがある。
- 気体分子間の共有結合1molを切断するために必要なエネルギーを結合エンタルピーという。
- 例えば、1molの水素分子H2を2molの水素原子Hとするためには、436kJのエネルギーが必要となる。このとき、H2中のH-H結合の結合エンタルピーは436kJ/molと考えることができる。
\[ \mathrm{H_{2}(気) \longrightarrow 2H(気)}~~~ΔH = 436\mathrm{kJ} \]
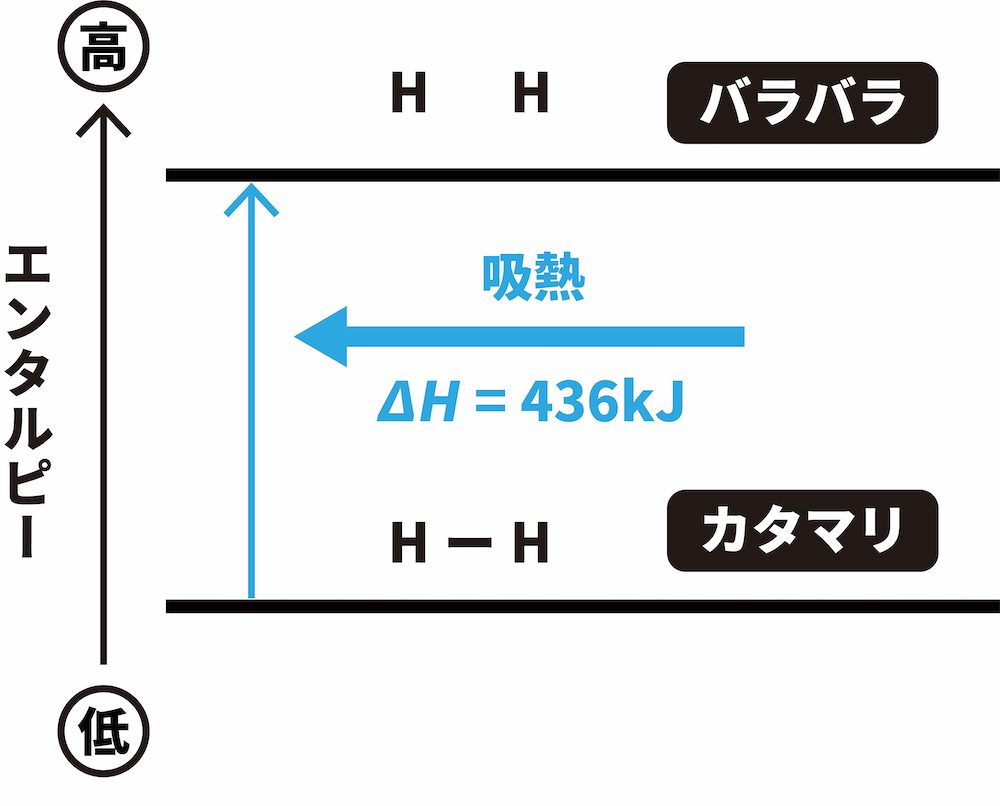
結合エンタルピーは結合を切断するために“必要な”エネルギーです。つまり、切断されるときにエネルギーが吸収されるので、結合を切断した後の“バラバラ”な状態のエンタルピーが、結合を切断する前の“カタマリ”の状態のエンタルピーよりも大きく、結合エンタルピーは正の値となります。
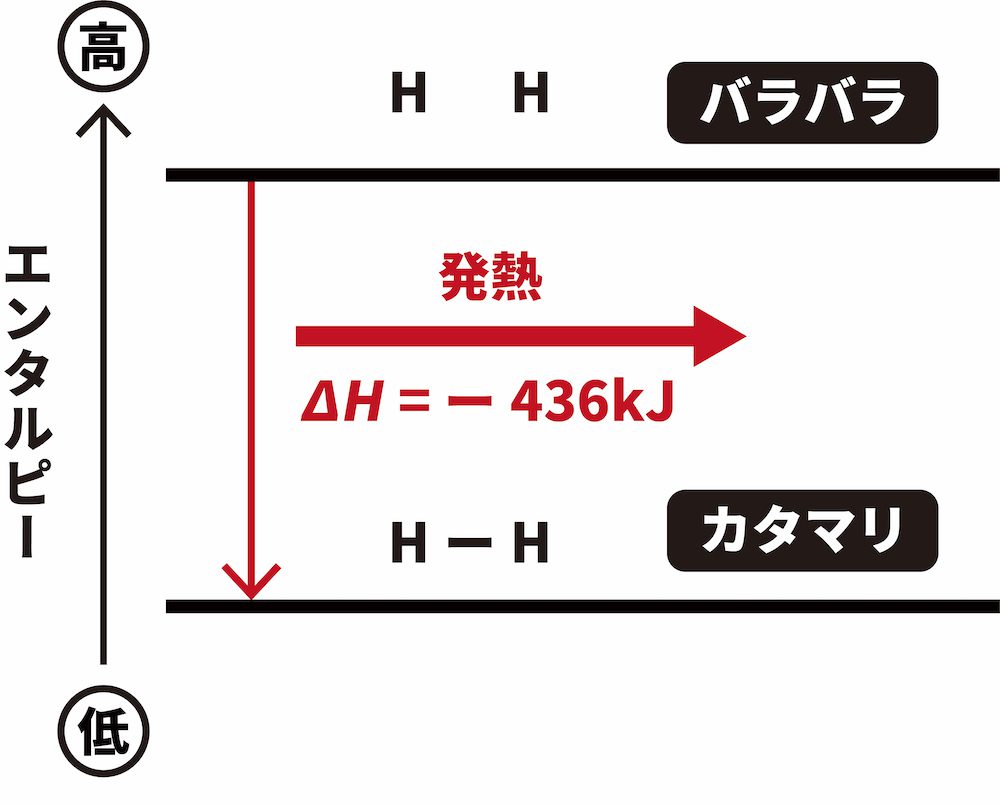
- 一方、2molのHが1molのH2となるときには、436kJのエネルギーが放出される。
\[ \mathrm{2H(気) \longrightarrow H_{2}(気)}~~~ΔH = -436\mathrm{kJ} \]
結合エンタルピーに関する計算問題
- 結合エンタルピーに関する計算問題の解き方について、例題を用いて解説する。
塩化水素HClの生成エンタルピーを求めよ。ただし、HーH、ClーCl、HーClの結合エンタルピーをそれぞれ432kJ/mol、239kJ/mol、428kJ/molとする。
●STEP1
求める反応熱をQkJとし、それを含む熱化学方程式を書く。
●STEP2
STEP1でつくった式を元に、エネルギー図を書く。
●STEP3
図に書き込んだ分子を「バラバラ」の状態にし、エネルギー図の上の位置に書く。
●STEP4
それぞれの結合を切るために必要なエネルギーを書き込む。
●STEP5
ヘスの法則を利用して方程式を作成し、それを解く。
求めたいのはHClの生成エンタルピーのため、HClの係数を1とし、他の物質の係数はそれに合わせる。また、求めたい熱量はQkJとする。
\[ \mathrm{\frac{ 1 }{ 2 }H_{2}(気)+\frac{ 1 }{ 2 }Cl_{2}(気) \longrightarrow HCl(気)}~~~ΔH = Q\mathrm{\mathrm{kJ}} \]
H2とCl2という2つの物質がまとまってHClという1つの物質になるため、より「バラバラ」であるH2とCl2の方がエネルギーが高い。したがって、より高い位置に書く。
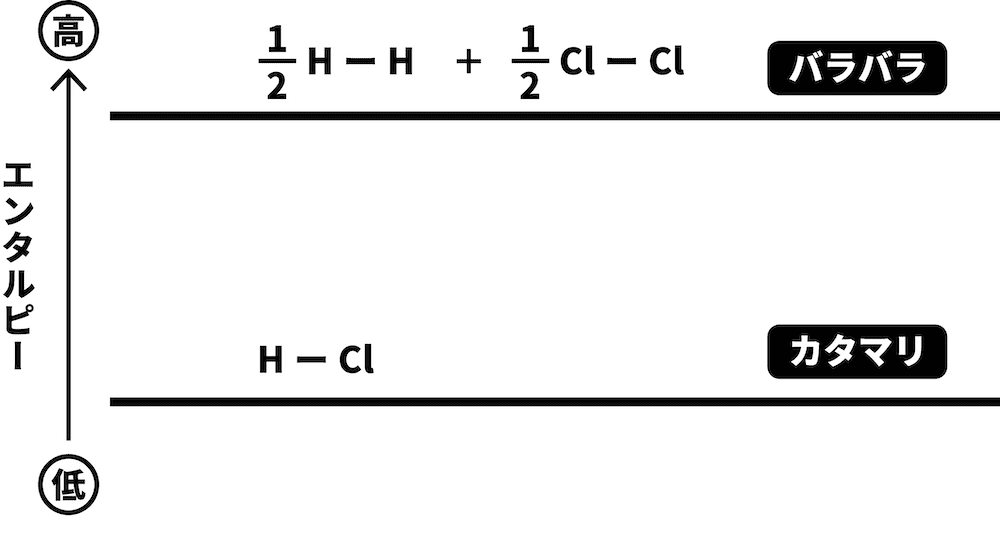
H2とCl2が、それぞれH原子とCl原子になった場合を考える。
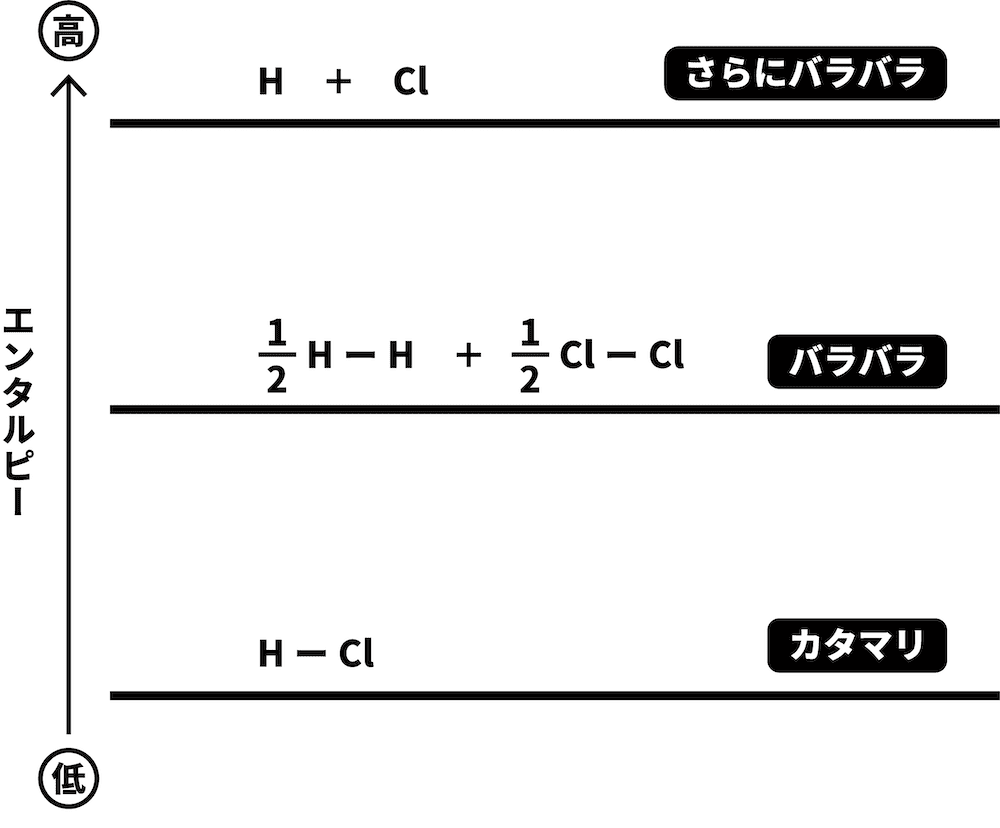
問題文に書いてあったHーH、ClーCl、HーCl結合の結合エネルギーを図中に書き込む。
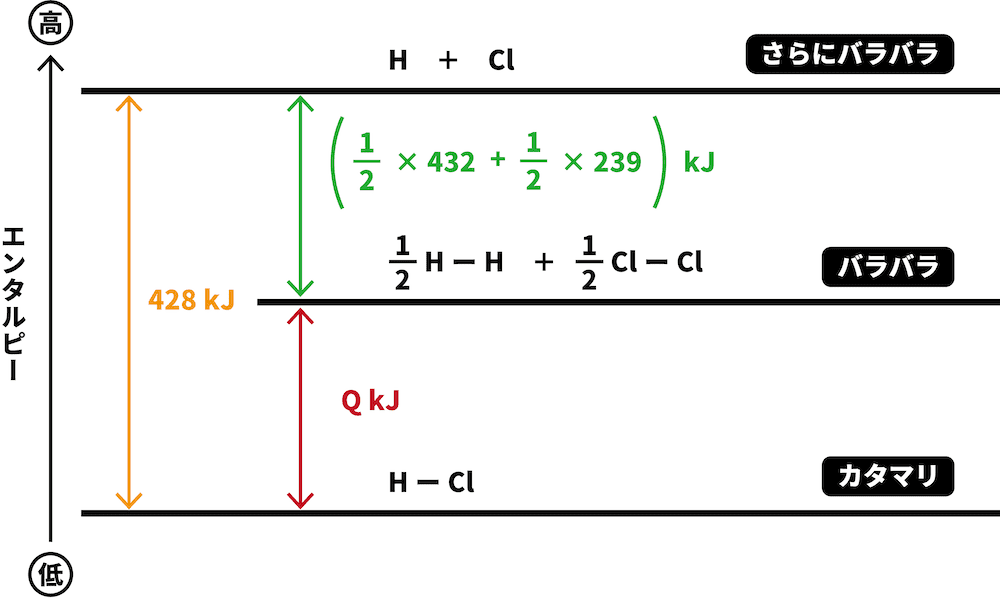
係数がついていた場合は、それをかけるのを忘れないように注意する。
ヘスの法則により、化学変化に伴う反応エンタルピーは、反応前後の状態で決まり、反応経路によって変化しない。
参考:ヘスの法則(定義・反応エンタルピーの計算問題の解き方)
これを利用することで、次の式をたてることができる。
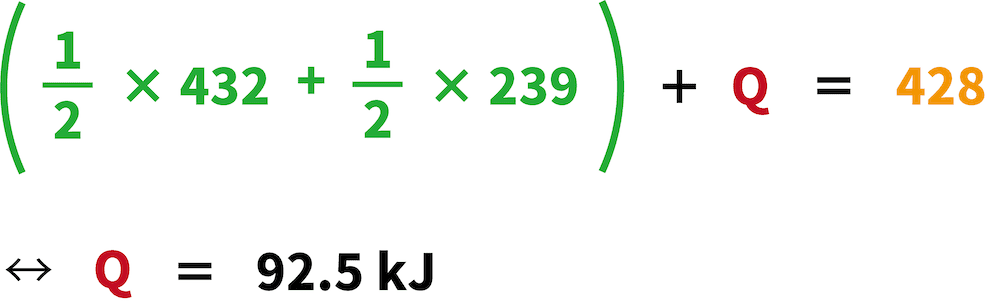
これが塩化水素HClの生成エンタルピーである。














