MENU
ダイヤモンドと黒鉛の違い(性質や構造など)
目次
はじめに
【プロ講師解説】このページでは『ダイヤモンドと黒鉛の違い(性質や構造など)』について解説しています。
ダイヤモンド
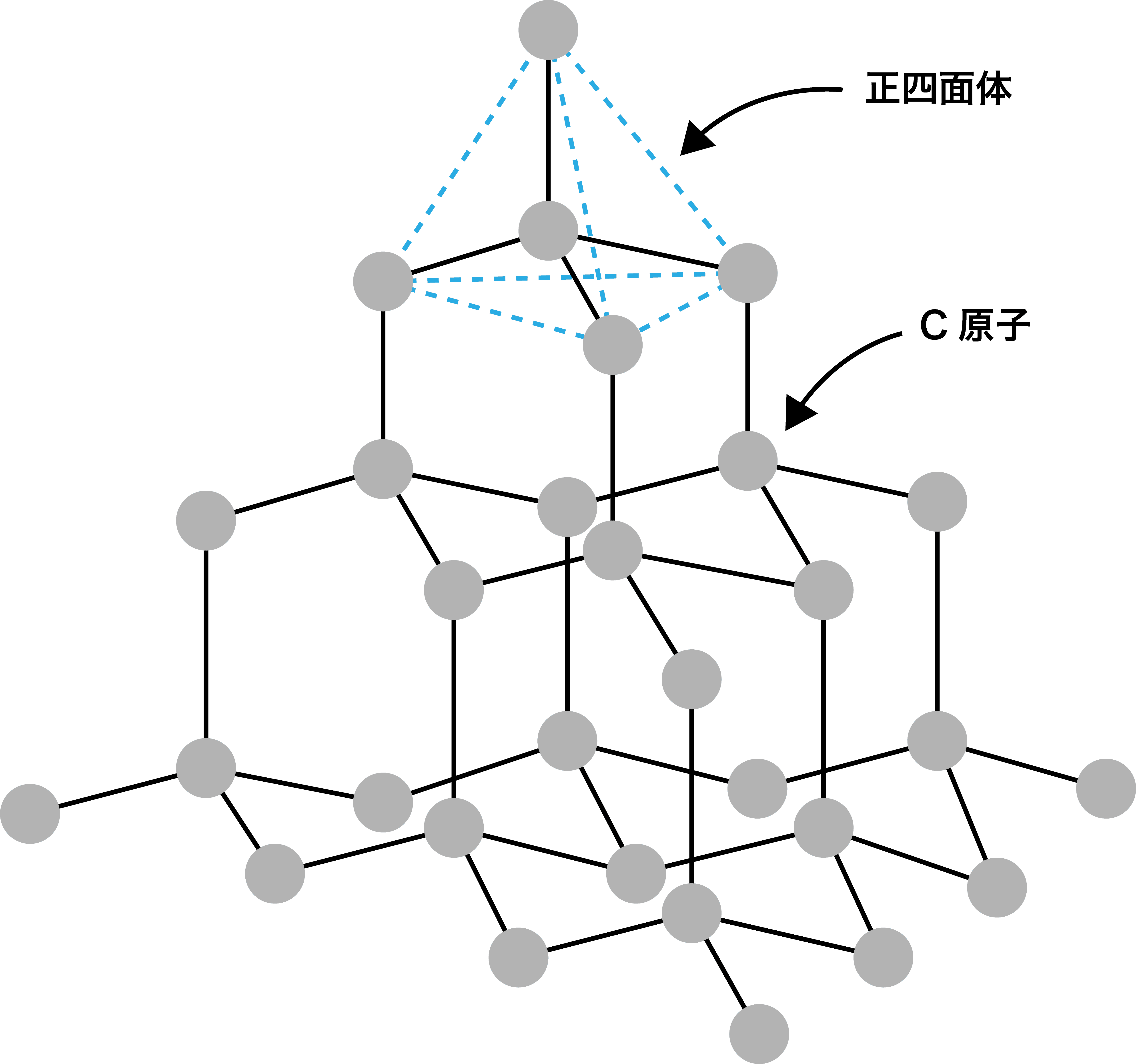
- したがって、ダイヤモンドは極めて硬く、融点も非常に高い。また、(伝導に必要な価電子が全て共有結合を作るために使われているので)電気伝導性も低く、(光を遮る価電子がなく可視光は全て通過するため)色は無色透明である。
- ちなみに、ダイヤモンドの共有結合結晶の単位格子は次のようになる。
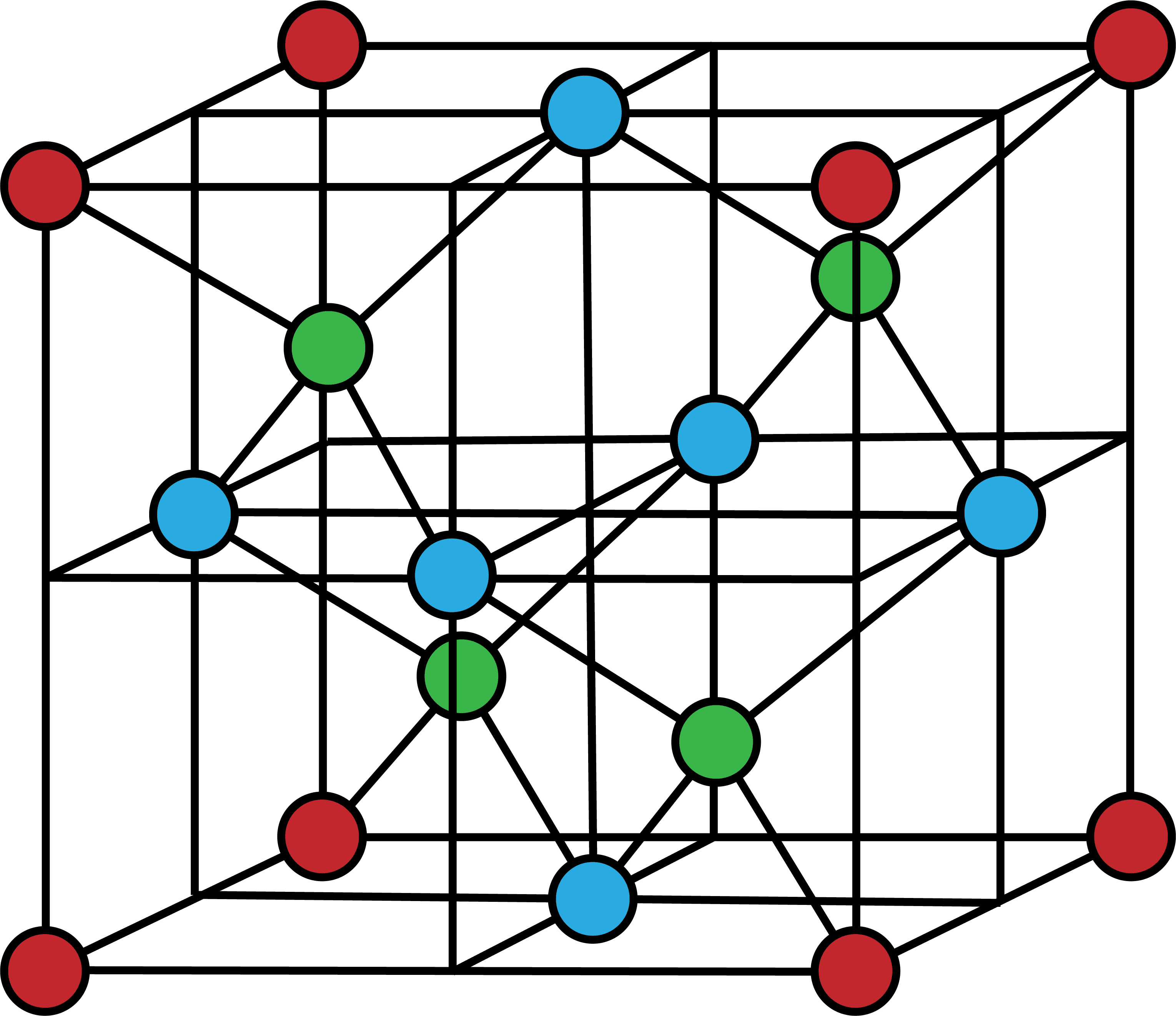
- 単位格子の頂点を占めるC原子(1/8)を赤、面上のC原子(1/2)を青、格子内部の丸々一個のC原子を緑で表している。
- 単位格子に含まれるC原子の数は…
\[ \mathrm{ \frac{ 1 }{ 8 }×8+\frac{ 1 }{ 2 }×6+1×4=8(個)} \]
- 8個となる。
- さらに、ダイヤモンドの単位格子の配位数は…
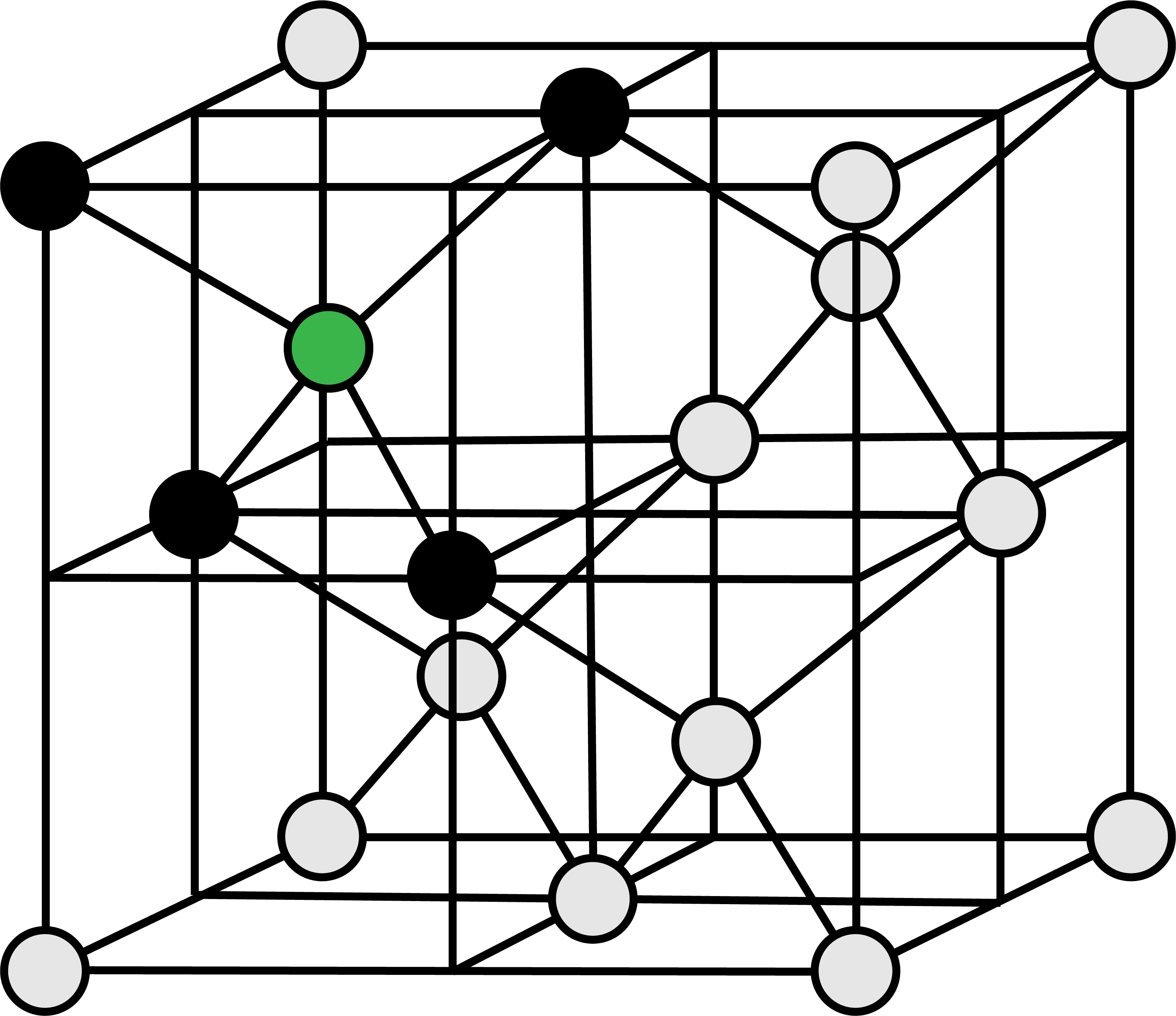
- C原子は周りの4個のC原子と接している。したがって、ダイヤモンドの単位格子における配位数は4となる。
黒鉛
- 黒鉛Cは、炭素原子がもつ4個の価電子のうち3個のみを使って隣り合う炭素原子の価電子と共有結合し、正六角形の構造が繰り返された平面層状構造をつくっている。また、この平面層状構造同士が分子間力によって緩く結合している。
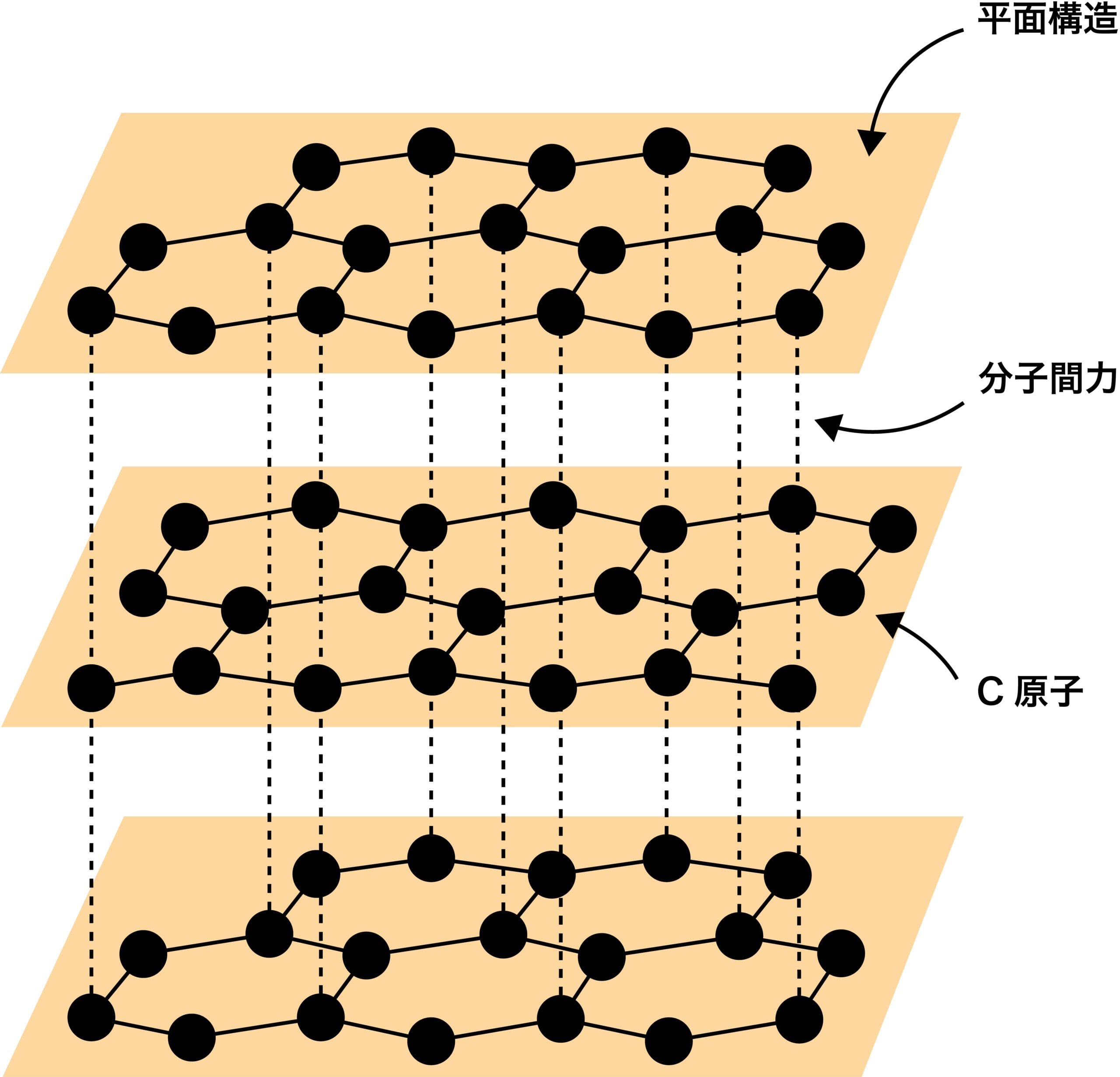
- したがって、黒鉛は比較的柔らかく、また層の部分から薄く剥がれやすい。また、(伝導に必要な価電子が1つ残っているため)電気伝導性があり、(光を遮る価電子が1個残っているため可視光は一部しか透過せず)色は黒色である。
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
問1
ダイヤモンドと黒鉛の違いについて、200文字以内で述べよ。ただし「立体網目状構造」「電気伝導性」「ファンデルワールス力」「価電子」の用語は必ず含めること。
解答/解説:タップで表示
解答:以下参照
ダイヤモンドは正四面体の構造が繰り返された立体網目状構造をしているため硬くで丈夫であるのに対し、黒鉛は正六角形の構造が繰り返されてできた平面層状構造がファンデルワールス力により結合しているため柔らかくてもろい。
また、ダイヤモンドは4コの価電子が全て結合に使われているため電気伝導性がないが、黒鉛は3コしか使われていないため余っている1コの価電子が自由電子の様に働くので電気伝導性がある。
問2
ダイヤモンドと黒鉛の色をそれぞれ答えなさい。また、なぜ色の違いが生じるのか100文字以内で述べなさい。
解答/解説:タップで表示
解答:以下参照
ダイヤモンド:無色透明(無色) 黒鉛:黒色
ダイヤモンドは4個の価電子が全て結合に使われているため、光を遮る価電子がなく可視光は全て通過し色は無色透明になる。黒鉛は1個価電子が余っているので可視光は一部しか透過せず色は黒色になる。














