MENU
逆滴定(例題・計算問題の解き方・原理など)
はじめに
【プロ講師解説】このページでは『逆滴定(例題・計算問題の解き方・原理など)』について解説しています。
逆滴定とは
- 気体(例:アンモニア)など、通常の中和滴定を行いにくい物質を滴定するための特殊な滴定法を逆滴定という。
アンモニアNH3の逆滴定
- 逆滴定の流れについて「アンモニアNH3の逆滴定」を例に解説する。
- まず、酸である硫酸H2SO4を大量に用意する。
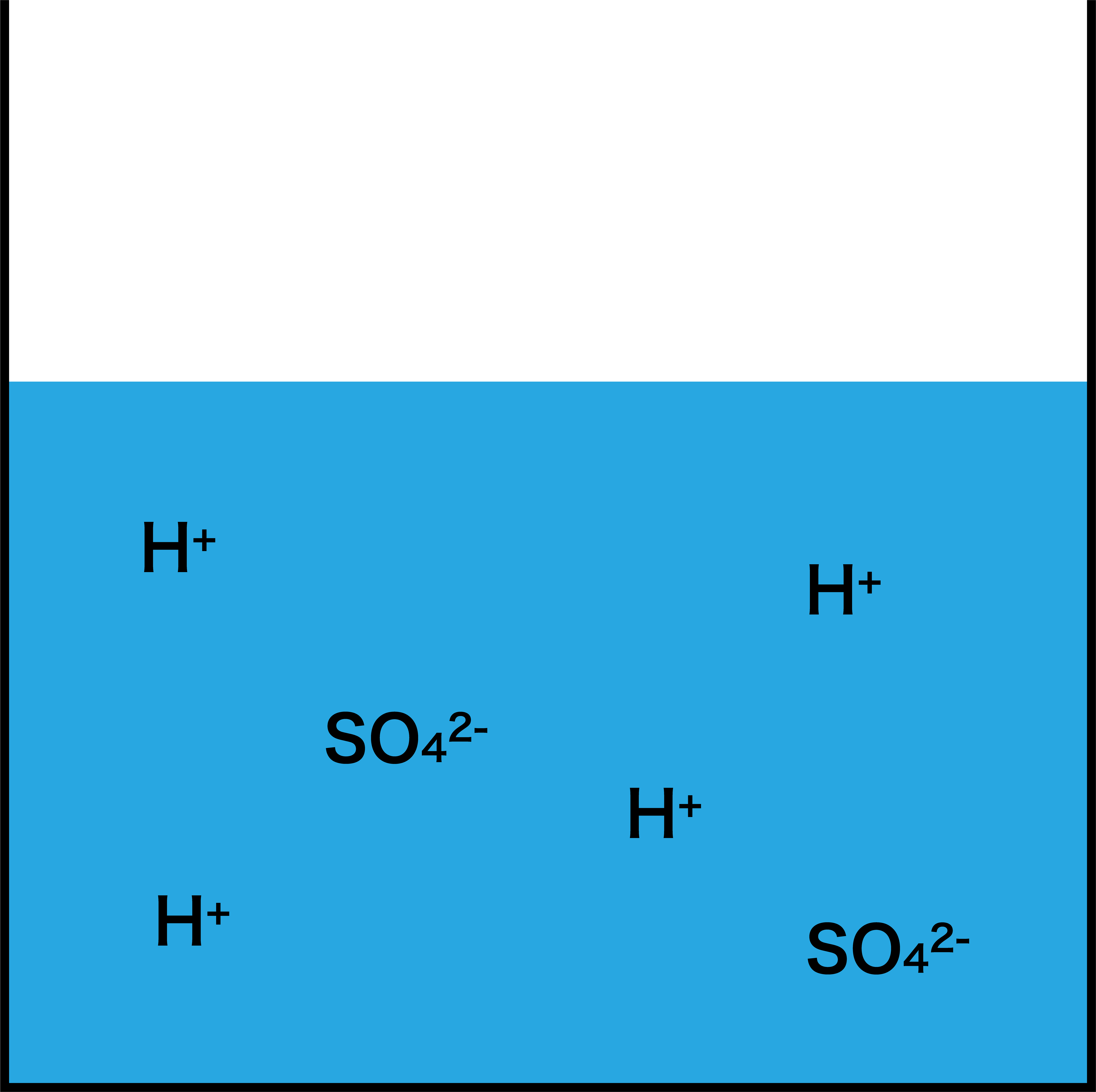
- ここにアンモニアNH3を完全に吸収させる。
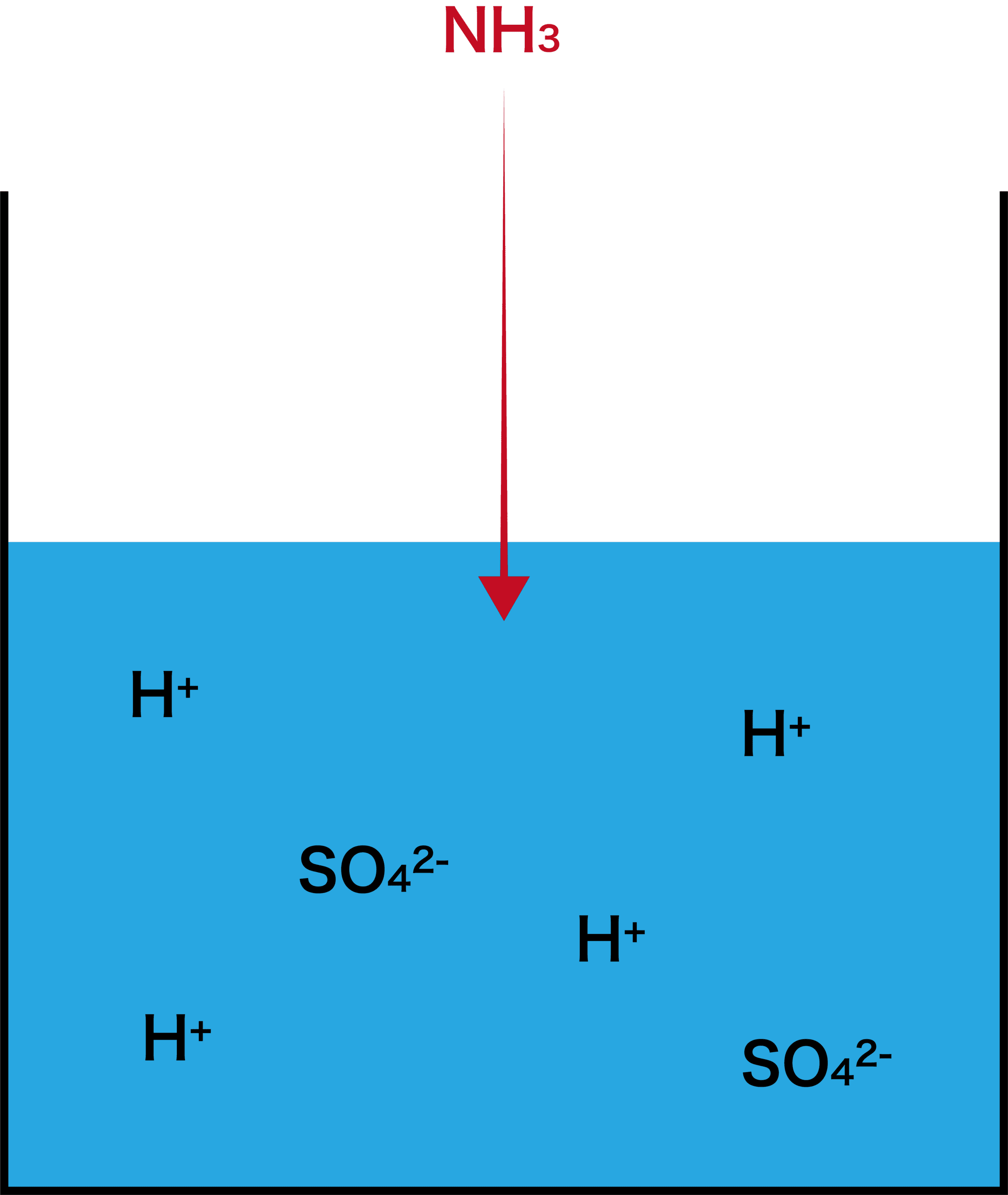
- すると、NH3は水中に存在するH+の一部と反応してNH4+になる。
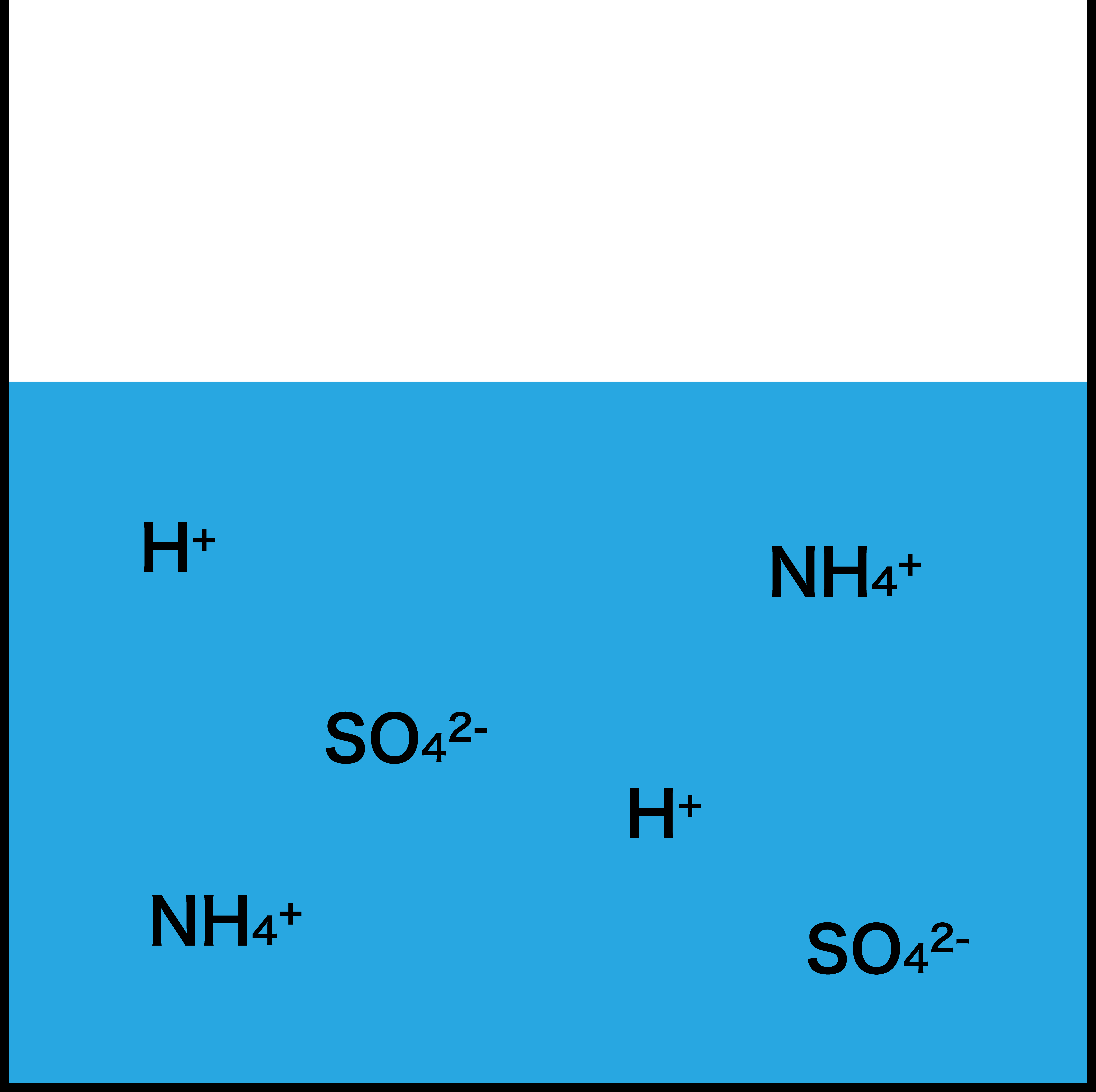
- ここに指示薬(メチルオレンジorメチルレッド)を入れ、先ほどNH3と反応しなかったH+を水酸化ナトリウムNaOHで滴定する。
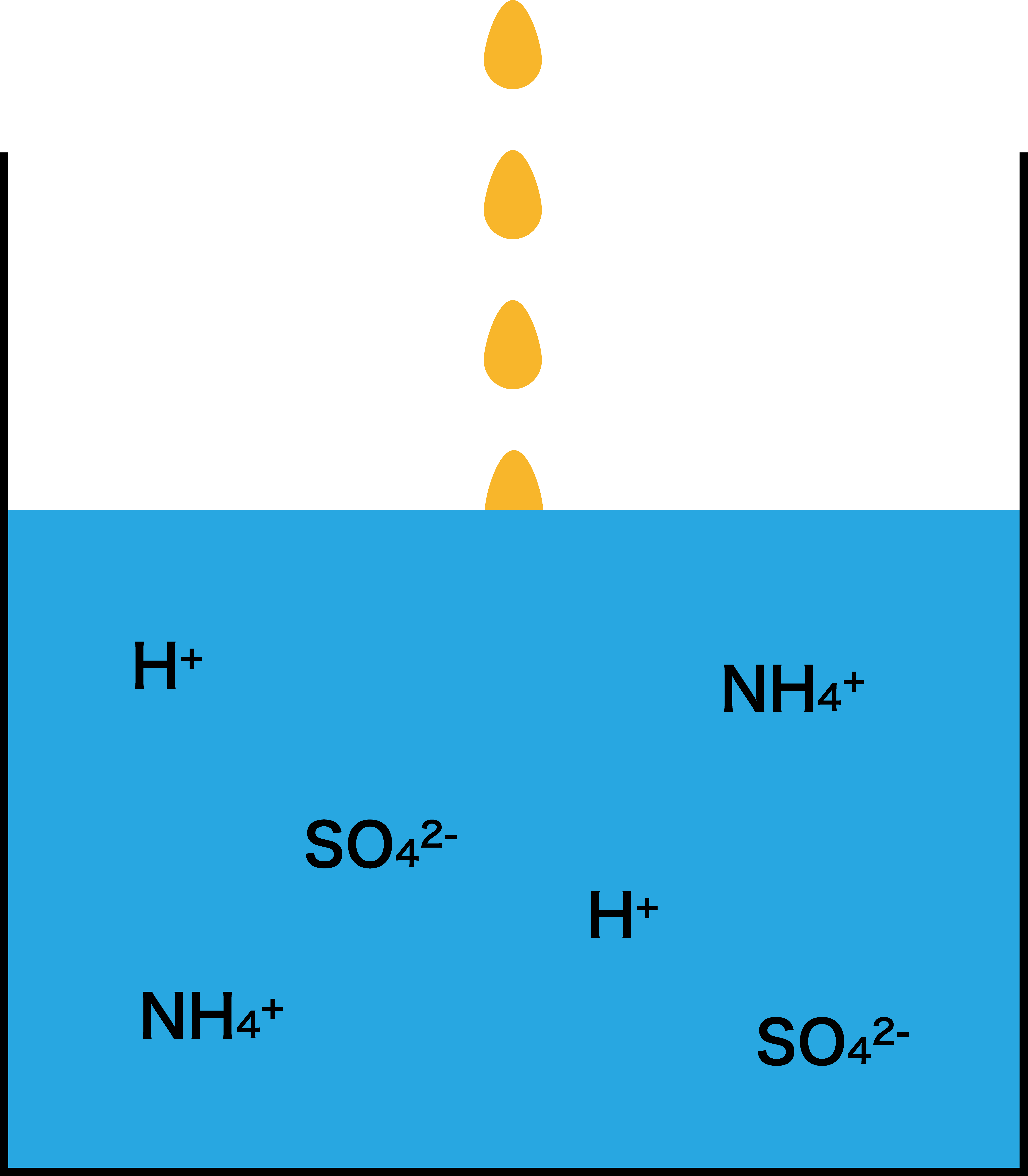
- 徐々に中和されていき…
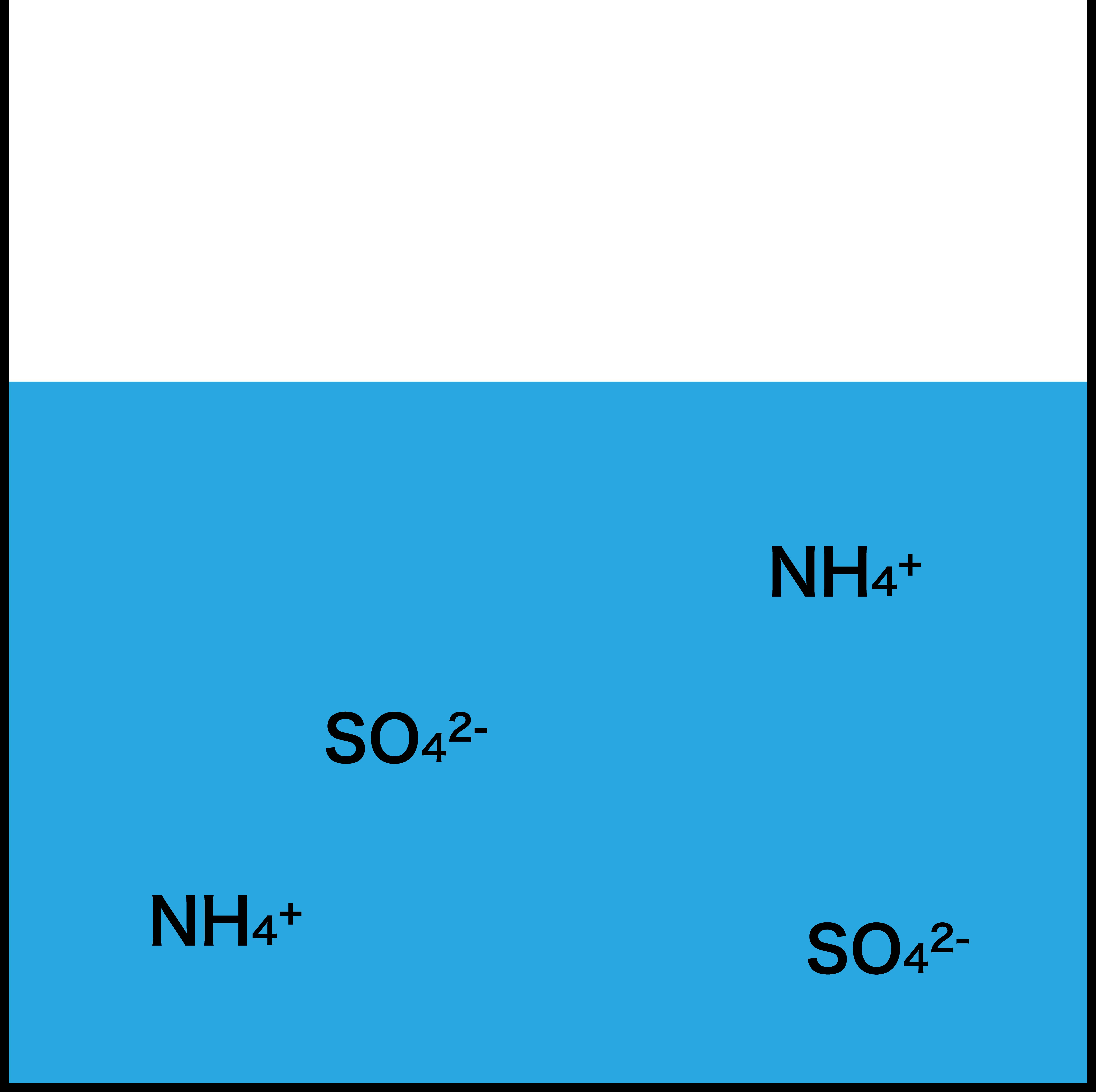
- 完全に中和したときこのような状態になる。H+はすべてOHーと合わさり水になっている。(Na+は省略)
- これが、逆滴定の流れである。要するに、酸である硫酸を2種類の塩基(NaOH、NH3)で滴定しているということである。
逆滴定計算の流れ
- 逆滴定の計算問題の解き方について、例を用いて解説する。
●STEP1
直線を書き数値を並べる。
●STEP2
中和計算をする。
0.10(mol/L)の硫酸H2SO42.0(L)を中和するために必要な0.20(mol/L)の水酸化ナトリウムNaOHは何(L)か。
まずは、直線を書き数値を並べる。
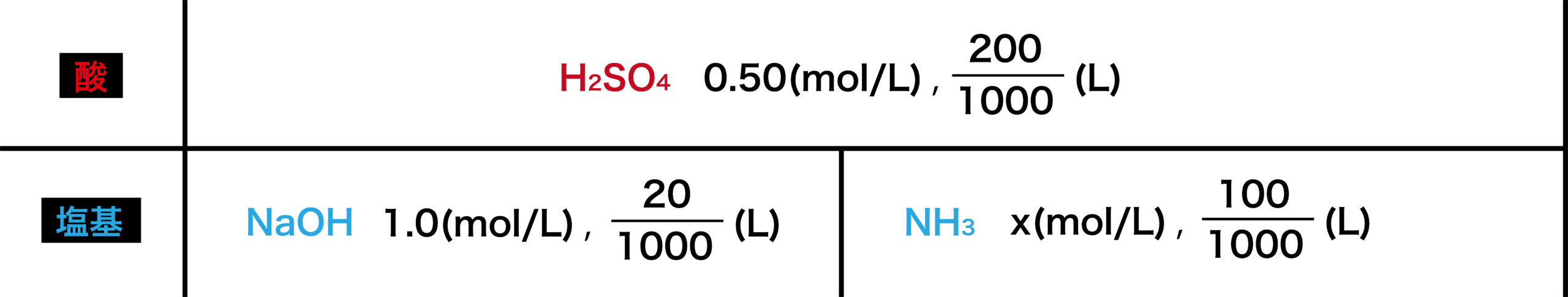
酸と塩基で上下に分けて、それぞれの物質とそのmol/L、Lを書き並べる。
【公式あり】中和計算を一瞬で解く方法を理由を交えて徹底解説!でやったように、中和点で酸と塩基のmol数が等しくなることを利用して計算式を立て、中和計算をする。
\[ \begin{align}&\underbrace{ \mathrm{0.50(mol/L) × \frac{ 200 }{ 1000 }(L) × 2} }
_{ \mathrm{H_{2}SO_{4}}\text{ の放出する }H^{+}\text{ のmol }}
=
\underbrace{ \mathrm{1.0(mol/L) × \frac{ 20 }{ 1000 }(L) × 1 }}
_{ \mathrm{NaOH}\text{ の受け取る }H^{+}\text{ のmol }}
+
\underbrace{ x\mathrm{(mol/L) × \frac{ 100 }{ 1000 }(L) × 1} }
_{ \mathrm{NH{3}}\text{ の受け取る }\mathrm{H^{+}}\text{ のmol }} \\
\\
&↔︎ x\mathrm{=1.8(mol/L)}\end{align} \]
逆滴定まとめ
この『逆滴定(例題・計算問題』のページで解説した内容をまとめる。
- 気体(例:アンモニア)など、通常の中和滴定を行いにくい物質を滴定するための特殊な滴定法を逆滴定という。
- 逆滴定は次の2STEPで行う。
●STEP1
直線を書き数値を並べる。
●STEP2
中和計算をする。
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
濃度不明のアンモニア400(ml)の濃度を調べるために以下の実験を行った。
【実験】1.0(mol/L)の硫酸200(ml)にアンモニアをすべて溶かした。その後、この溶液に0.50(mol/L)の水酸化ナトリウムを滴下した。すると、200(ml)加えたところで完全に中和した。
このときのアンモニアのモル濃度は何(mol/L)か。
解答/解説:タップで表示
解答:0.75mol/L
\[ \begin{align}&\underbrace{ \mathrm{1.0(mol/L) × \frac{ 200 }{ 1000 }(L) × 2} }
_{ \mathrm{H_{2}SO_{4}}\text{ の放出する }\mathrm{H^{+}}\text{ のmol }}
=
\underbrace{\mathrm{ 0.50(mol/L) × \frac{ 200 }{ 1000 }(L) × 1} }
_{ \mathrm{NaOH}\text{ の受け取る }\mathrm{H^{+}}\text{ のmol }}
+
\underbrace{ x\mathrm{(mol/L) × \frac{ 400 }{ 1000 }(L) × 1} }
_{ \mathrm{NH_{3}}\text{ の受け取る }\mathrm{H^{+}}\text{ のmol }} \\
\\
&↔︎ x\mathrm{=0.75(mol/L)}
\end{align} \]
濃度不明のアンモニア200(ml)の濃度を調べるために以下の実験を行った。
【実験】2.0(mol/L)の硫酸100(ml)にアンモニアをすべて溶かした。その後、この溶液に0.5(mol/L)の水酸化ナトリウムを滴下した。すると、40(ml)加えたところで完全に中和した。
このときのアンモニアの濃度は何(mol/L)か。
解答/解説:タップで表示
解答:1.9mol/L
\[ \begin{align}&\underbrace{ \mathrm{2.0(mol/L) × \frac{ 100 }{ 1000 }(L) × 2} }
_{ \mathrm{H_{2}SO_{4}}\text{ の放出する }\mathrm{H^{+}}\text{ のmol }}
=
\underbrace{ \mathrm{0.50(mol/L) × \frac{ 40 }{ 1000 }(L) × 1 }}
_{ \mathrm{NaOH}\text{ の受け取る }\mathrm{H^{+}}\text{ のmol }}
+
\underbrace{ x\mathrm{(mol/L) × \frac{ 200 }{ 1000 }(L) × 1} }
_{ \mathrm{NH_{3}}\text{ の受け取る }\mathrm{H^{+}}\text{ のmol }} \\
\\
&↔︎ x\mathrm{=1.9(mol/L)}
\end{align} \]














