MENU
中和(定義・塩・中和反応式の作り方など)
はじめに
【プロ講師解説】このページでは『中和(定義・塩・中和反応式の作り方など)』について解説しています。
中和とは
- 酸と塩基が反応すると、塩と水が生じる。この反応を中和という。
- 中和が起こると、酸・塩基ともにその性質が打ち消される。
塩酸HClと水酸化ナトリウムNaOH水溶液の反応
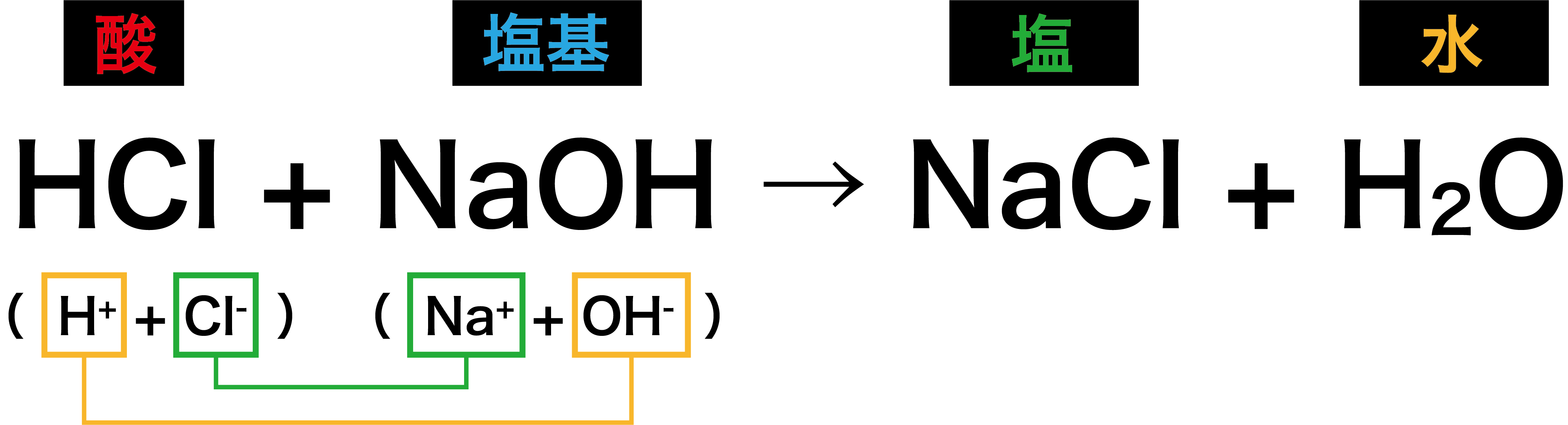
- 酸である塩酸HClから出た水素イオンH+と塩基である水酸化ナトリウムNaOHから出たOHーが合わさってH2Oが生じる。また、余った塩化物イオンClーとナトリウムイオンNa+がくっついて塩である塩化ナトリウムNaClが生じる。
- また、次のように”水が発生しない中和”も存在する。
塩化水素HClとアンモニアNH3の反応
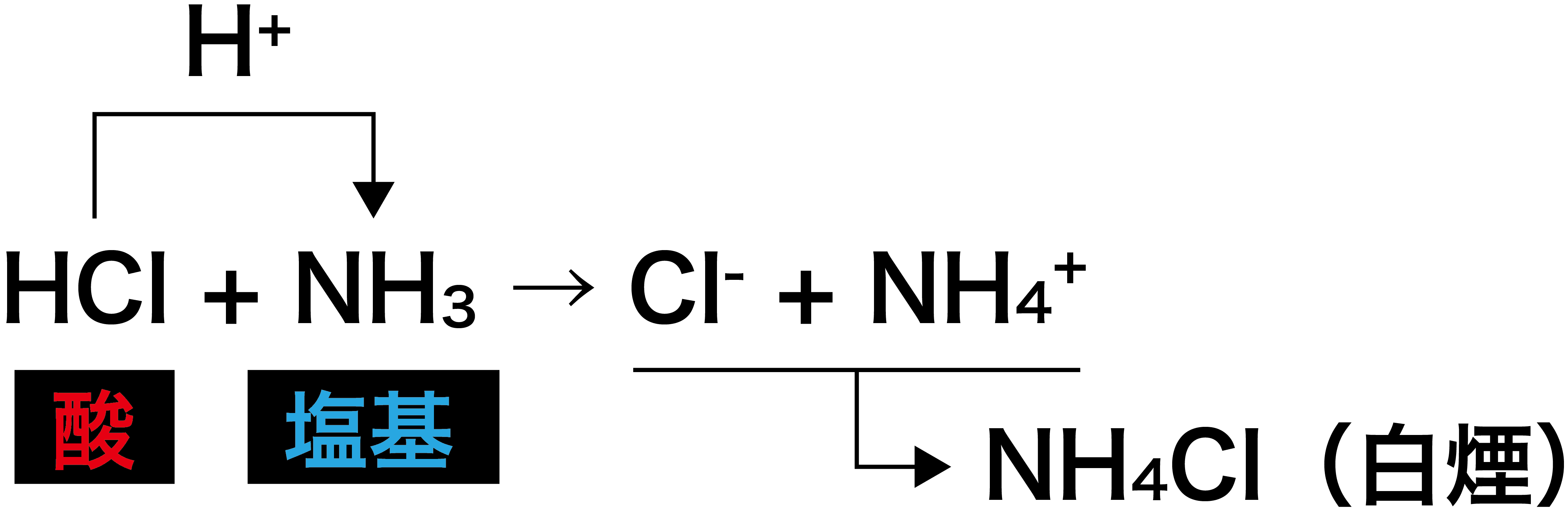
- 酸である塩化水素HClが水素イオンH+を出してClーとなり、塩基であるアンモニアNH3がH+を受け取ってNH4+になる。また、ClーとNH4+はくっついて塩化アンモニウムNH4Clの白煙となる。
中和と中性は違う
- 酸と塩基が打ち消されることを「中和」というが、似たような言葉の「中性」とは少し意味が異なる。このあたりについて詳しくは次のページを参照のこと。
中和の化学反応式の作り方
- 中和の化学反応式の作り方を、具体例を用いて解説する。
硫酸と水酸化ナトリウムの中和反応
まずは、酸である硫酸と塩基である水酸化ナトリウムの化学式を書く。
\[ \mathrm{H_{2}SO_{4}+NaOH} \]
次に、酸・塩基の係数を調節することで、H+とOHーの数を合わせる。
\[ \mathrm{H_{2}SO_{4}+2NaOH} \]
今回の場合、H2SO4に含まれるH+の数が2個のため、NaOHの係数を2にすればOK。
次に、H+とOHーの数だけ右辺にH2Oを書く。
\[ \mathrm{H_{2}SO_{4}+2NaOH→2H_{2}O} \]
今回は、STEP2でH+とOHーの数を2個で揃えたため、右辺にH2Oを2個書き込む。
最後に、左辺でまだ反応に使われていないイオンを右辺に塩として書く。
\[ \mathrm{H_{2}SO_{4} + 2NaOH → 2H_{2}O + Na_{2}SO_{4}} \]
今回は、左辺にSO42ーが1個、Na+が2個余っているため、右辺にはそれらを組み合わせた塩Na2SO4(硫酸ナトリウム)を書き込む。
塩酸と水酸化カルシウムの中和反応
まずは、酸である塩酸と塩基である水酸化カルシウムの化学式を書く。
\[ \mathrm{HCl + Ca(OH)_{2}} \]
次に、酸・塩基の係数を調節することで、H+とOHーの数を合わせる。
\[ \mathrm{2HCl + Ca(OH)_{2}} \]
今回の場合、Ca(OH)2に含まれるOHーの数が2個のため、HClの係数を2にすればOK。
次に、H+とOHーの数だけ右辺にH2Oを書く。
\[ \mathrm{2HCl + Ca(OH)_{2} → 2H_{2}O} \]
今回は、STEP2でH+とOHーの数を2個で揃えたため、右辺にH2Oを2個書き込む。
最後に、左辺でまだ反応に使われていないイオンを右辺に塩として書く。
\[ \mathrm{2HCl + Ca(OH)_{2} → 2H_{2}O + CaCl_{2}} \]
今回は、左辺にClーが2個、Ca2+が1個余っているため、右辺にはそれらを組み合わせた塩CaCl2(塩化カルシウム)を書き込む。
中和まとめ
この『中和(定義・塩・中和反応式の作り方など)』のページで解説した内容をまとめる。
- 酸と塩基が反応すると、塩と水が生じる。この反応を中和という。
- 「塩化水素HClとアンモニアNH3の反応」のように、水が生じない中和反応も存在する。
- 中和と中性は意味が異なる。
参考:中和と中性の違いって何?pH7が中和点とは限らない理由を解説!
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
酸と塩基が反応すると、塩と水が生じる。この反応を【1】という。
解答/解説:タップで表示
解答:【1】中和
酸と塩基が反応すると、塩と水が生じる。この反応を中和という。
中和反応では多くの場合【1】と【2】が生じる。塩酸HClと水酸化ナトリウムNaOHの反応では、酸であるHClから出た【3】と塩基であるNaOHから出た【4】が合わさって【1】が、また、余ったCl–とNa+がくっついて【2】の一種である【5】が生じる。
解答/解説:タップで表示
解答:【1】水H2O【2】塩【3】H+【4】OH–【5】塩化ナトリウムNaCl
中和反応では多くの場合水と塩が生じる。塩酸HClと水酸化ナトリウムNaOHの反応では、酸であるHClから出たH+と塩基であるNaOHから出たOHーが合わさって水が、また、余ったCl–とNa+がくっついて塩の一種である塩化ナトリウムNaClが生じる。
塩化水素HClとアンモニアNH3の中和反応では例外的に水H2Oが生じない。酸であるHClが【1】を出して【2】となり、塩基であるNH3が【1】を受け取って【3】となり、【2】と【3】が組み合わさって【4】の白煙となる。
解答/解説:タップで表示
解答:【1】H+【2】Cl–【3】NH4+【4】塩化アンモニウムNH4Cl
塩化水素HClとアンモニアNH3の中和反応では例外的に水H2Oが生じない。酸であるHClがH+を出してClーとなり、塩基であるNH3がH+を受け取ってNH4+となり、ClーとNH4+が組み合わさって塩化アンモニウムNH4Clの白煙となる。
硫酸と水酸化ナトリウムの中和反応の反応式を書け。
解答/解説:タップで表示
解答:H2SO4 + 2NaOH → 2H2O + Na2SO4
まずは、酸である硫酸と塩基である水酸化ナトリウムの化学式を書く。
\[ \mathrm{H_{2}SO_{4}+NaOH} \]
次に、酸・塩基の係数を調節することで、H+とOHーの数を合わせる。
\[ \mathrm{H_{2}SO_{4}+2NaOH} \]
今回の場合、H2SO4に含まれるH+の数が2個のため、NaOHの係数を2にすればOK。
次に、H+とOHーの数だけ右辺にH2Oを書く。
\[ \mathrm{H_{2}SO_{4}+2NaOH→2H_{2}O} \]
今回は、STEP2でH+とOHーの数を2個で揃えたため、右辺にH2Oを2個書き込む。
最後に、左辺でまだ反応に使われていないイオンを右辺に塩として書く。
\[ \mathrm{H_{2}SO_{4} + 2NaOH → 2H_{2}O + Na_{2}SO_{4}} \]
今回は、左辺にSO42ーが1個、Na+が2個余っているため、右辺にはそれらを組み合わせた塩Na2SO4(硫酸ナトリウム)を書き込む。
塩酸と水酸化カルシウムの中和反応の反応式を書け。
解答/解説:タップで表示
解答:2HCl + Ca(OH)2 → 2H2O + CaCl2
まずは、酸である塩酸と塩基である水酸化カルシウムの化学式を書く。
\[ \mathrm{HCl + Ca(OH)_{2}} \]
次に、酸・塩基の係数を調節することで、H+とOHーの数を合わせる。
\[ \mathrm{2HCl + Ca(OH)_{2}} \]
今回の場合、Ca(OH)2に含まれるOHーの数が2個のため、HClの係数を2にすればOK。
次に、H+とOHーの数だけ右辺にH2Oを書く。
\[ \mathrm{2HCl + Ca(OH)_{2} → 2H_{2}O} \]
今回は、STEP2でH+とOHーの数を2個で揃えたため、右辺にH2Oを2個書き込む。
最後に、左辺でまだ反応に使われていないイオンを右辺に塩として書く。
\[ \mathrm{2HCl + Ca(OH)_{2} → 2H_{2}O + CaCl_{2}} \]
今回は、左辺にClーが2個、Ca2+が1個余っているため、右辺にはそれらを組み合わせた塩CaCl2(塩化カルシウム)を書き込む。














