MENU
共有結合結晶(例・特徴・性質・組成式・融点・電気伝導性など)
はじめに
【プロ講師解説】このページでは『共有結合結晶(例・特徴・性質・組成式・融点・電気伝導性など)』について解説しています。
共有結合結晶とは
- 炭素Cやケイ素Siは原子価が4(=最大)のため、多数の原子が共有結合で結びつき、大きな結晶をつくることができる。このように、多数の原子が共有結合によって繋がってできる結晶を共有結合結晶という。
- 共有結合結晶は1つの“巨大分子”とみなすことができる。
- 共有結合結晶の代表例としてはダイヤモンドC・黒鉛C・ケイ素Si・二酸化ケイ素SiO2などがあり、これらの物質は構成元素の種類と割合を最も簡単な整数比で表した“組成式”で表される。
- 共有結合結晶には、次のような特徴がある。
●共有結合結晶の特徴
- 原子間が強固な共有結合で繋がれているため、非常に硬く、融点が高い。
- 価電子が全て共有結合に使われているため、電気伝導性がない。(黒鉛は例外)
- 分子やイオンに分かれないため、溶解性が低い。
共有結合には方向性があるため、共有結合によってできる共有結合結晶の配位数は比較的小さいです。したがって、共有結合結晶の密度は(硬さや融点などから高いと思われがちですが)あまり高くありません。
- 以降、代表的な共有結合結晶を紹介する。
ダイヤモンド
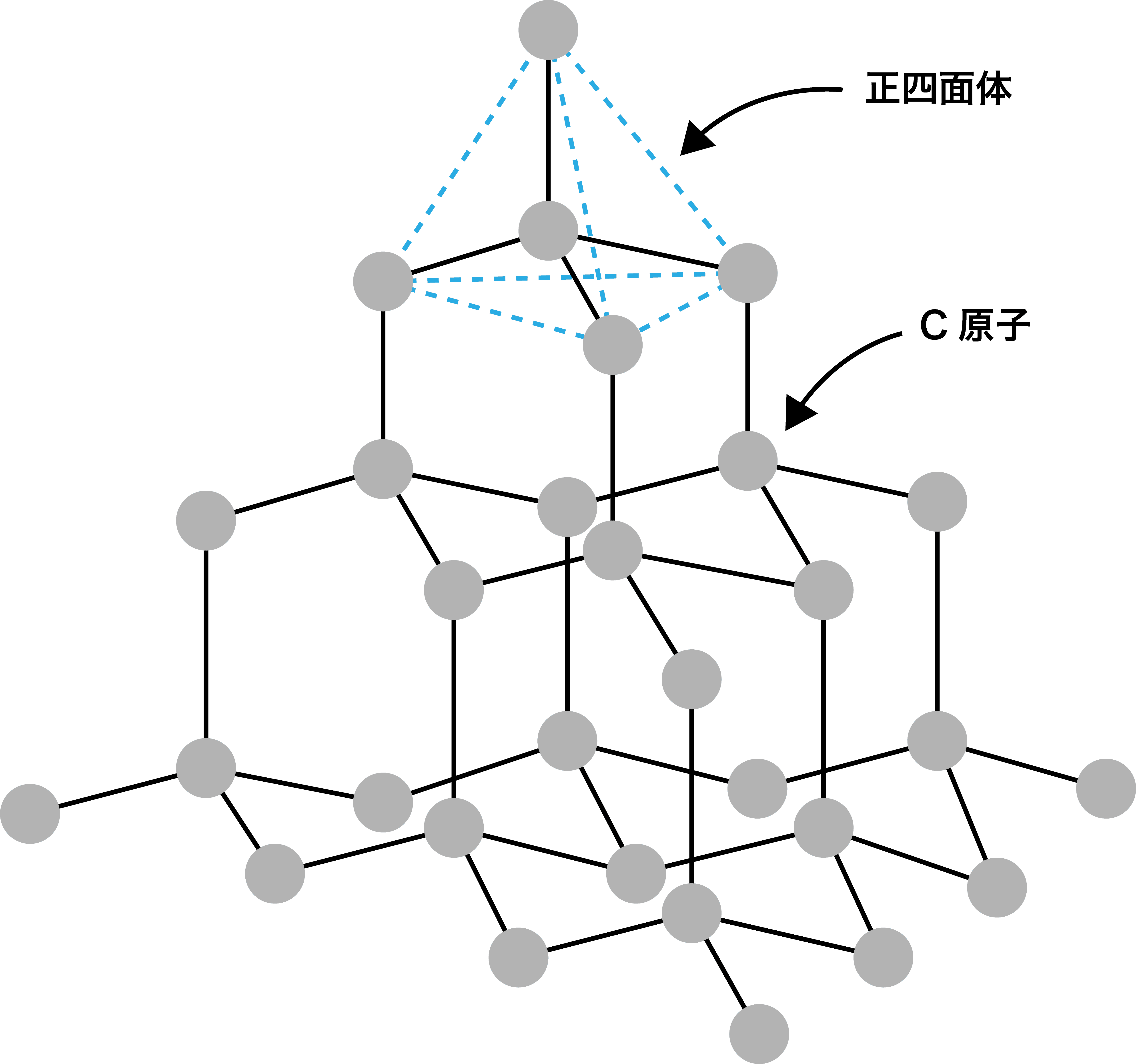
- ダイヤモンドは綿密な立体網目状構造であり、したがって極めて硬く、融点も非常に高い。
- 伝導に必要な価電子が全て共有結合に使われているため、電気伝導性がない。
- 可視光を全て透過するため、色は無色透明である。
ダイヤモンドの単位格子に含まれるC原子の数
- 次の図は、ダイヤモンドの共有結合結晶の単位格子を表す。
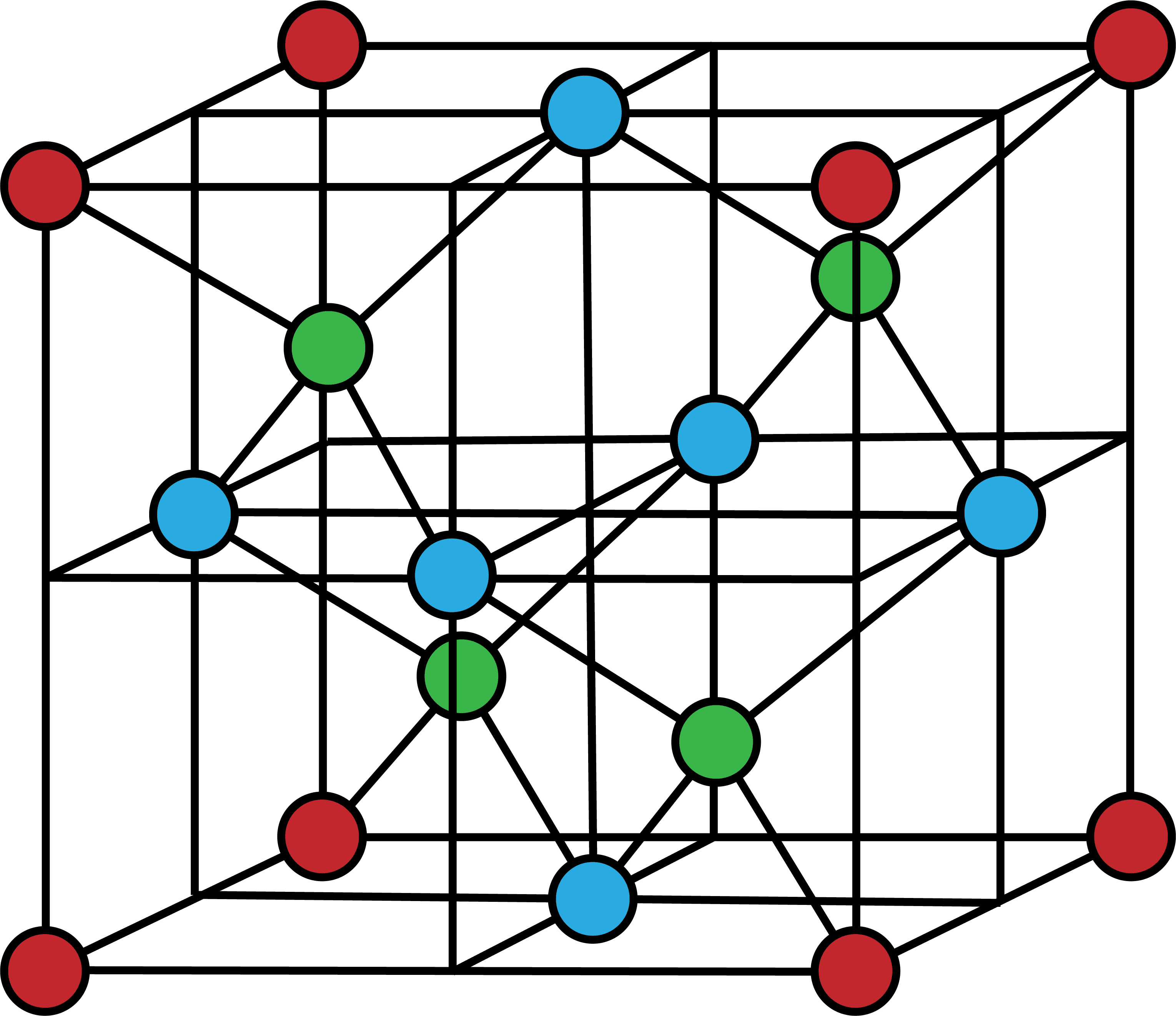
- 単位格子の頂点を占めるC原子(1/8)を赤、面上のC原子(1/2)を青、格子内部の丸々1個のC原子を緑で表している。
- 単位格子に含まれるC原子の数は8個である。
\[
\mathrm{\frac{ 1 }{ 8 }×8+\frac{ 1 }{ 2 }×6+1×4=8(個)}
\]
配位数
- C原子は周りの4個のC原子と接している。したがって、ダイヤモンドの単位格子における配位数は4である。
黒鉛
- 黒鉛Cは、C原子がもつ4個の価電子のうち3個のみを使って隣り合う炭素原子の価電子と共有結合し、正六角形の構造が繰り返された平面層状構造をつくっている。また、この平面層状構造同士が分子間力によって緩く結合している。
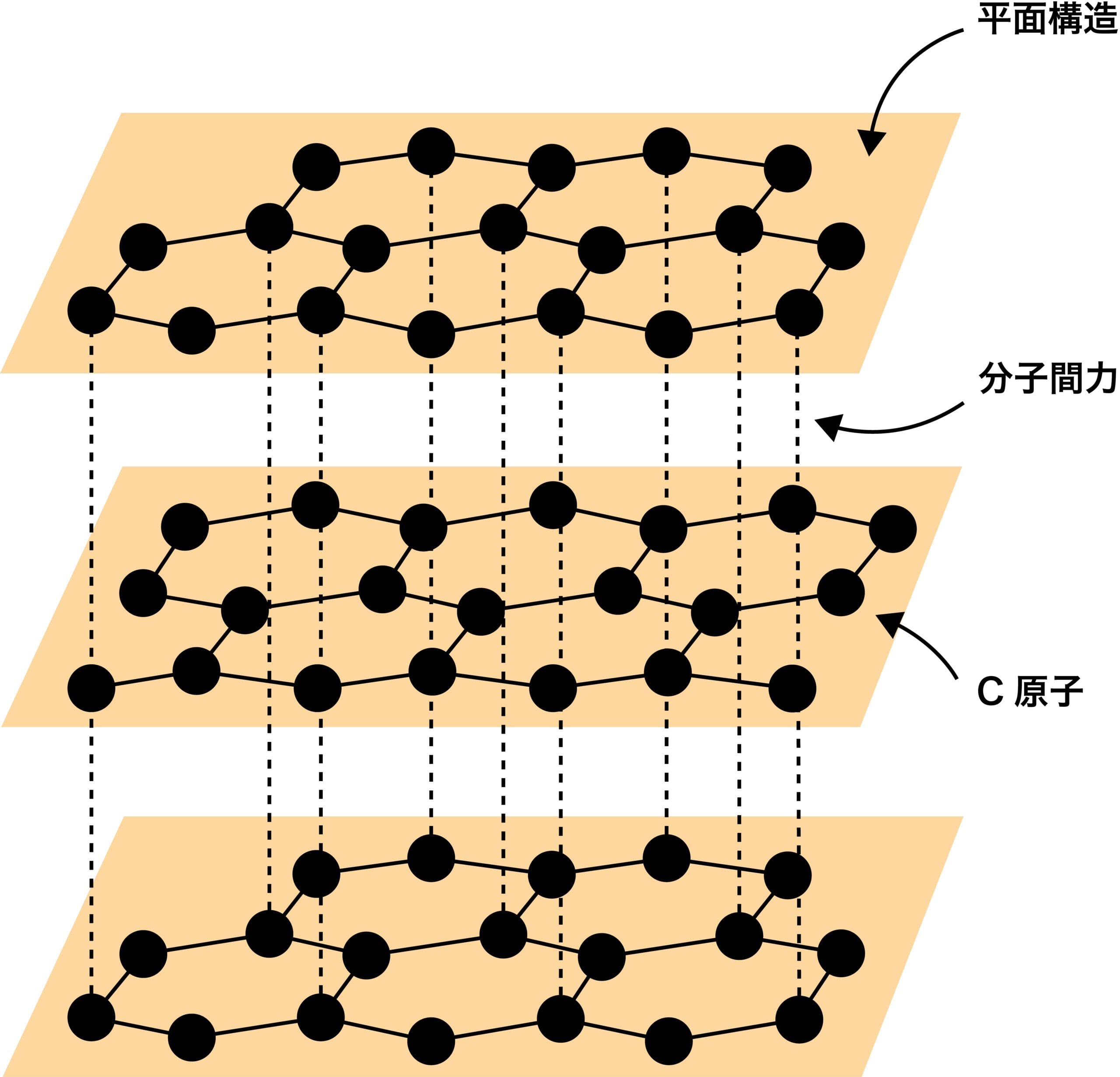
- 黒鉛は結合が弱いため柔らかく、また層の部分から薄く剥がれやすい。
- 伝導に必要な価電子が1個残っているため、電気伝導性がある。
- 光を遮る価電子が1個残っているため可視光は一部しか透過せず、色は黒色である。
ケイ素
- ケイ素Siも炭素同様14族元素なので、4個の価電子を持っている。
- したがって、ダイヤモンドのように正四面体構造が繰り返された共有結合結晶を形成する。
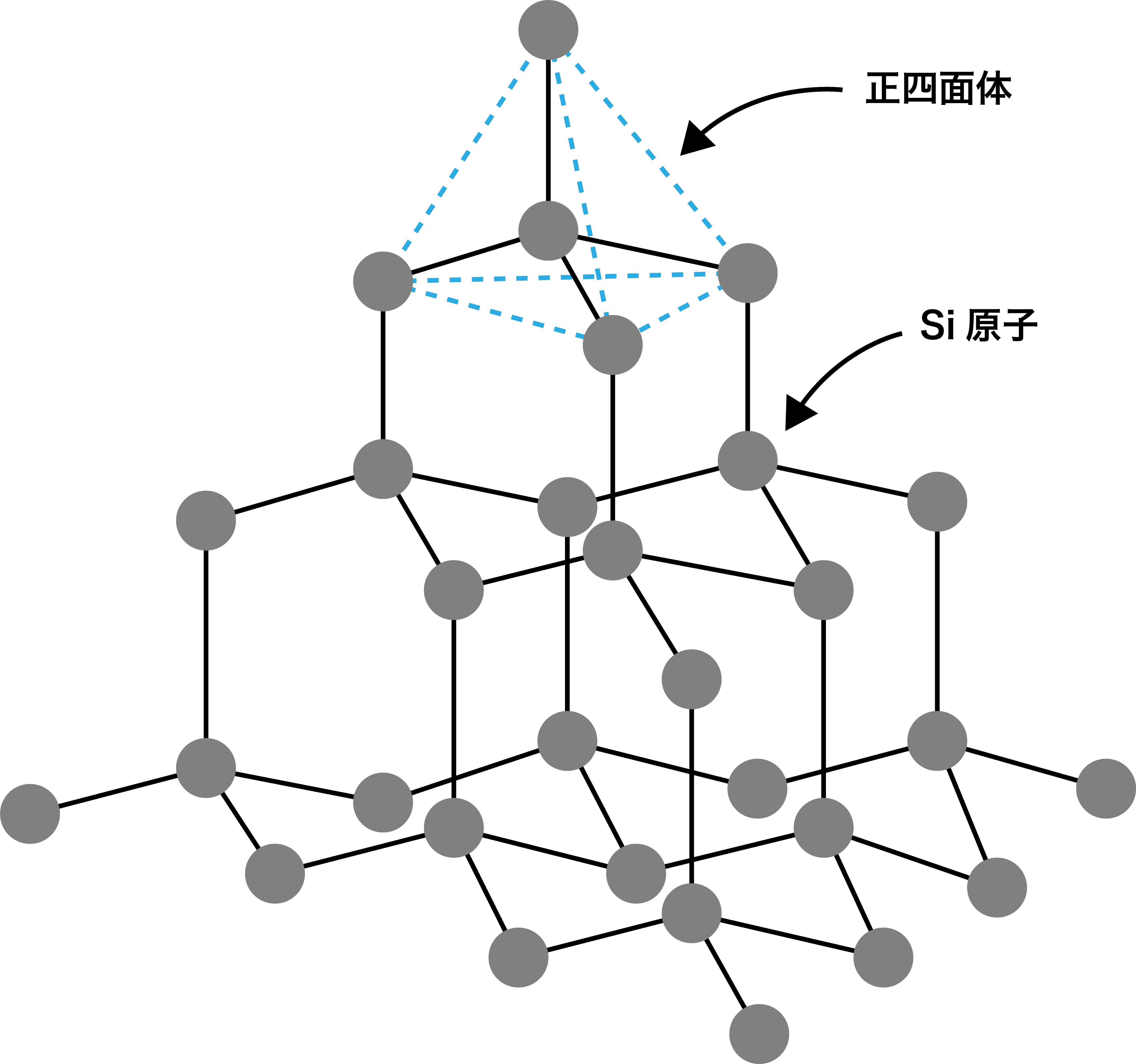
- Si-Si結合は、ダイヤモンドのC-C結合に比べて弱く切れやすいので、ケイ素はやや電気を通す。(=半導体↔︎ダイヤモンドは絶縁体)
- 半導体の性質を生かし、純度の高いケイ素はパソコン関係の部品や太陽光発電のパネルなどに用いられる。
二酸化ケイ素
- 二酸化ケイ素SiO2の共有結合結晶は、ケイ素Siの共有結合結晶に酸素O原子を組み込んだ構造になっている。
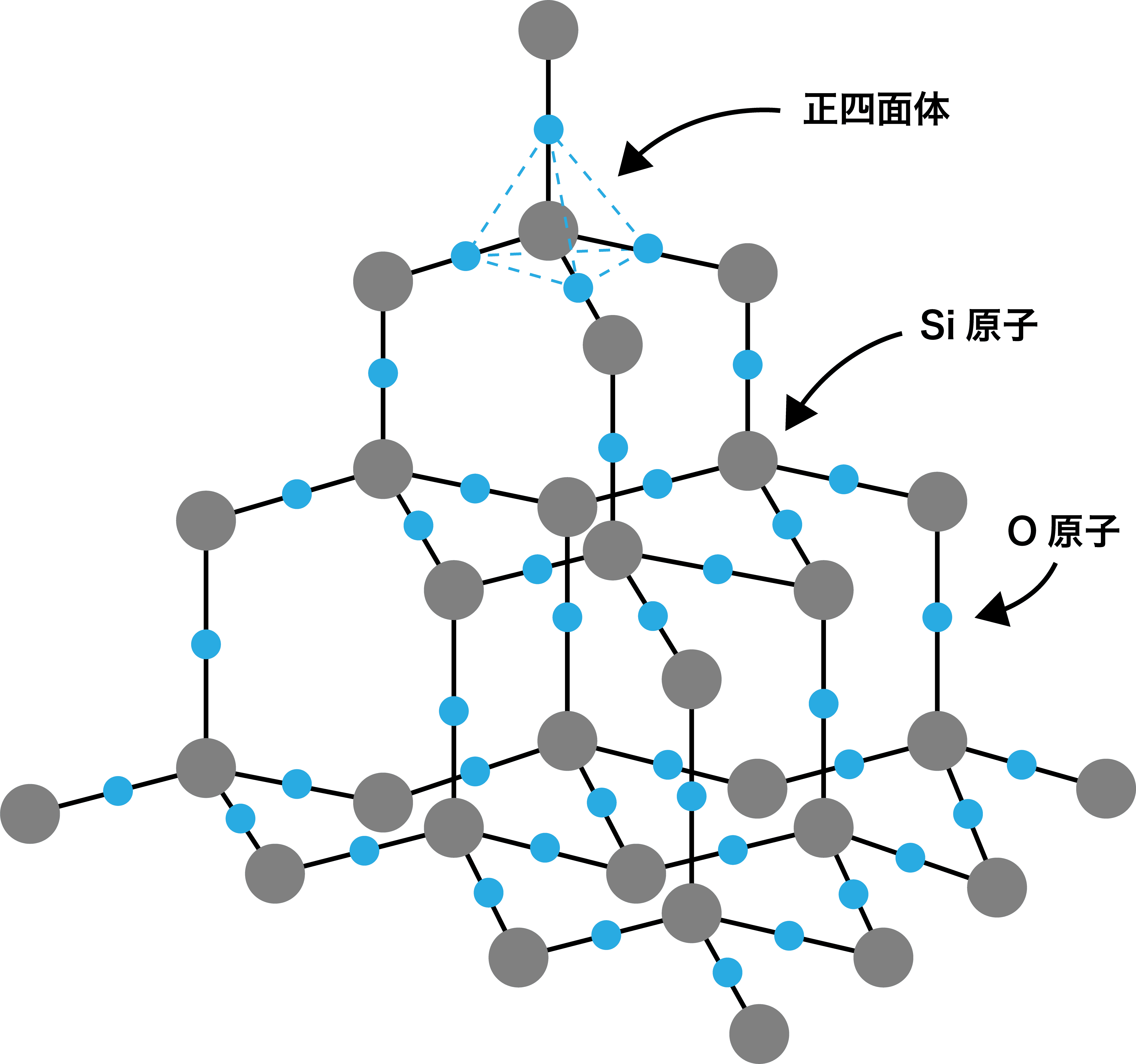
- Si原子の正四面体構造のなかに、SiO4の正四面体構造が収まっているようなイメージである。
- 二酸化ケイ素SiO2は、ダイヤモンド同様、硬くて融点が高く、電気も通さない。
天然に水晶や石英として存在し、その多くは光ファイバーや時計の部品などとして利用される。
共有結合結晶まとめ
この『共有結合結晶(例・特徴・性質・組成式・融点・電気伝導性など)』のページで解説した内容をまとめる。
- 多数の原子が共有結合によって繋がってできた結晶を共有結合結晶という。
- 共有結合結晶の代表例として、ダイヤモンドC・黒鉛C・ケイ素Si・二酸化ケイ素SiO2などがある。
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
多数の原子が共有結合によって繋がってできる結晶を【1】という。
解答/解説:タップで表示
解答:【1】共有結合結晶
多数の原子が共有結合によって繋がってできる結晶を共有結合結晶という。
共有結合結晶は構成元素の種類と割合を最も簡単な整数比で示した【1】で表される。
解答/解説:タップで表示
ダイヤモンドCでは、炭素C原子がもつ【1】個の価電子が、隣り合うC原子の価電子と共有結合している。
解答/解説:タップで表示
解答:【1】4
ダイヤモンドCでは、炭素C原子がもつ4個の価電子が、隣り合うC原子の価電子と共有結合している。
ダイヤモンドの融点は非常に【1(高 or 低)】い。
解答/解説:タップで表示
解答:【1】高
ダイヤモンドは綿密な立体網目状構造であり、したがって極めて硬く、融点も非常に高い。
ダイヤモンドは電気伝導性が【1(ある or ない)】。
解答/解説:タップで表示
解答:【1】ない
ダイヤモンドでは、伝導に必要な価電子が全て共有結合に使われているため、電気伝導性がない。
ダイヤモンドの単位格子に含まれるC原子の数は【1】個である。
解答/解説:タップで表示
解答:【1】8
次の図は、ダイヤモンドの共有結合結晶の単位格子を表す。

単位格子の頂点を占めるC原子(1/8)を赤、面上のC原子(1/2)を青、格子内部の丸々1個のC原子を緑で表している。
単位格子に含まれるC原子の数は8個である。
\[
\frac{ 1 }{ 8 }×8+\frac{ 1 }{ 2 }×6+1×4=8(個)
\]
ダイヤモンドの単位格子における配位数は【1】である。
解答/解説:タップで表示
解答:【1】4
C原子は周りの4個のC原子と接している。したがって、ダイヤモンドの単位格子における配位数は4である。

黒鉛では、C原子がもつ4個の価電子のうち【1】個が共有結合に使われている。
解答/解説:タップで表示
解答:【1】3
黒鉛は、C原子がもつ4個の価電子のうち3個のみを使って隣り合う炭素原子の価電子と共有結合し、正六角形の構造が繰り返された平面層状構造をつくっている。また、この平面層状構造同士が分子間力によって緩く結合している。

黒鉛は電気伝導性が【1(ある or ない)】。
解答/解説:タップで表示
解答:【1】ある
黒鉛では、伝導に必要な価電子が1個残っているため、電気伝導性がある。
黒鉛は【1】色である。
解答/解説:タップで表示
解答:【1】黒
黒鉛では、光を遮る価電子が1個残っているため可視光は一部しか透過せず、色は黒色である。
ダイヤモンドは【1(絶縁体 or 半導体)】、ケイ素は【2(絶縁体 or 半導体)】である。
解答/解説:タップで表示
解答:【1】絶縁体【2】半導体

Si-Si結合は、ダイヤモンドのC-C結合に比べて弱く切れやすいため、ケイ素はやや電気を通す(半導体)。この性質を生かし、純度の高いケイ素はパソコン関係の部品や太陽光発電のパネルなどに用いられる。
二酸化ケイ素SiO2の共有結合結晶は、ケイ素Siの共有結合結晶に【1】原子を組み込んだ構造になっている。
解答/解説:タップで表示
解答:【1】酸素O
二酸化ケイ素SiO2の共有結合結晶は、ケイ素Siの共有結合結晶に酸素O原子を組み込んだ構造になっている。

Si原子の正四面体構造のなかに、SiO4の正四面体構造が収まっているようなイメージである。














