MENU
イオン結合(例・共有結合との違い・特徴・強さなど)
目次
はじめに
【プロ講師解説】このページでは『イオン結合(例・共有結合との違い・特徴・強さなど)』について解説しています。
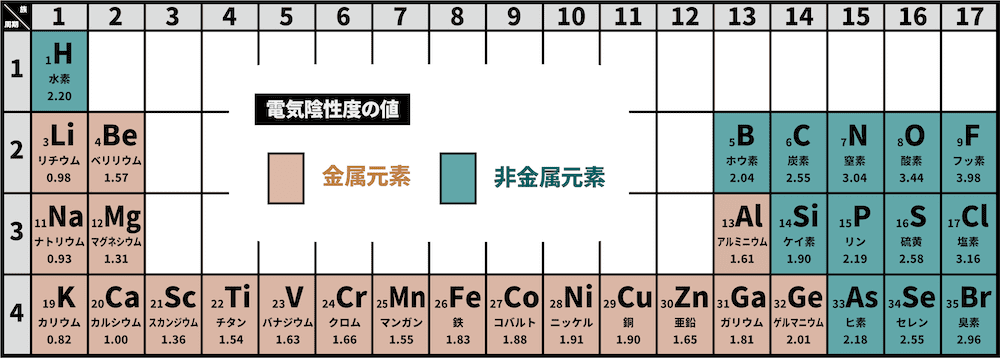
イオン結合とは
- 金属元素と非金属元素の間にできる結合をイオン結合という。
- 例として、ナトリウムNaと塩素Clのイオン結合を確認する。
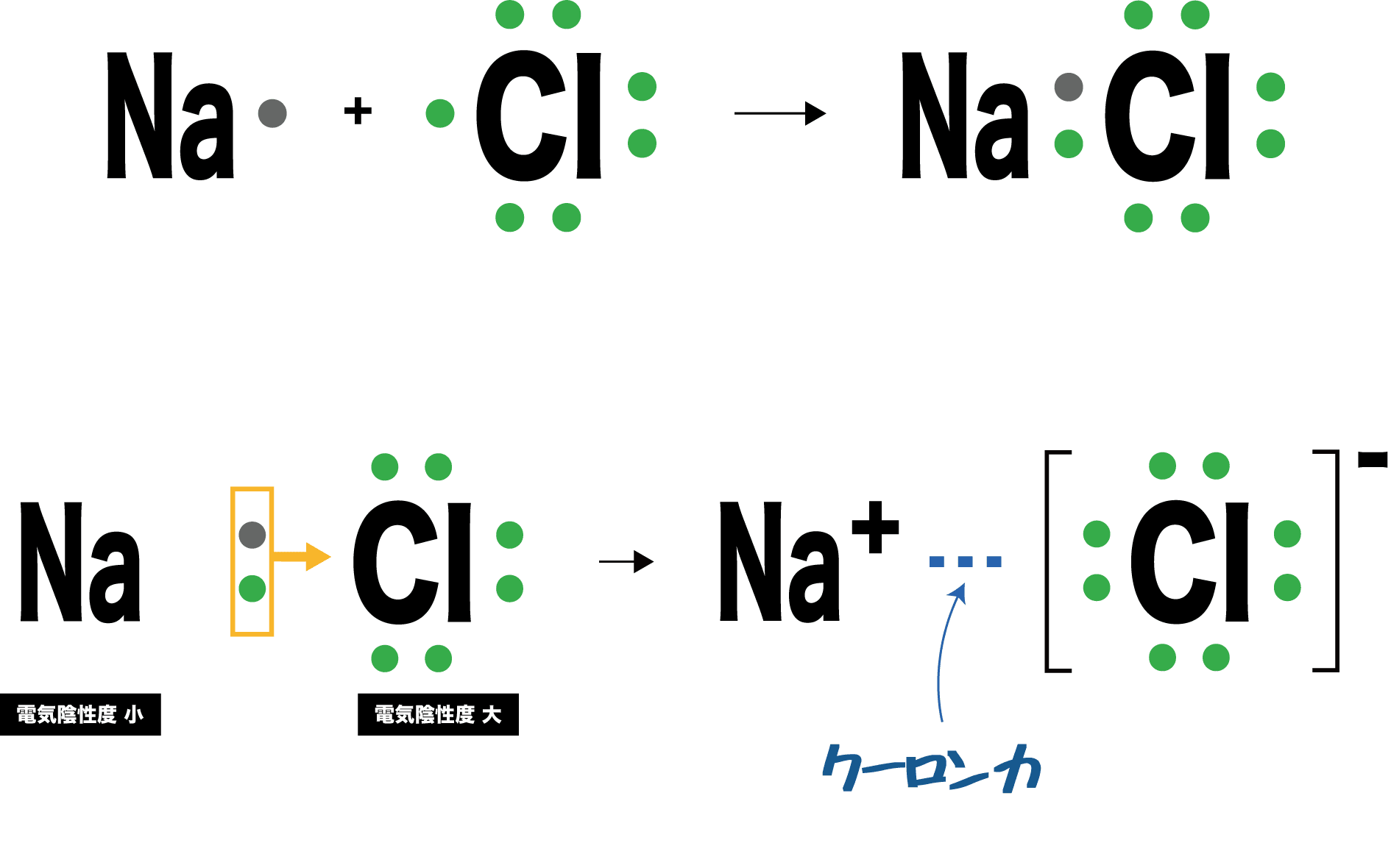
- どんな結合も不対電子の共有ではじまる。金属のNaは電気陰性度が小さく、非金属のClは電気陰性度が大きいため、電子対は完全にCl原子のものとなる。
- よって、NaはナトリウムイオンNa+に、Clは塩化物イオンClーに変化し、静電引力(クーロン力)で結びつく。
- このような、金属元素由来の陽イオンと、非金属元素由来の陰イオンのクーロン力による結合をイオン結合という。
イオン結合は連続的に結合する
- イオン結合はプラスとマイナスの間に発生するクーロン力によってつくられるものなので、隣り合う陽イオンと陰イオンが連続的に結合する(共有結合と異なる)。
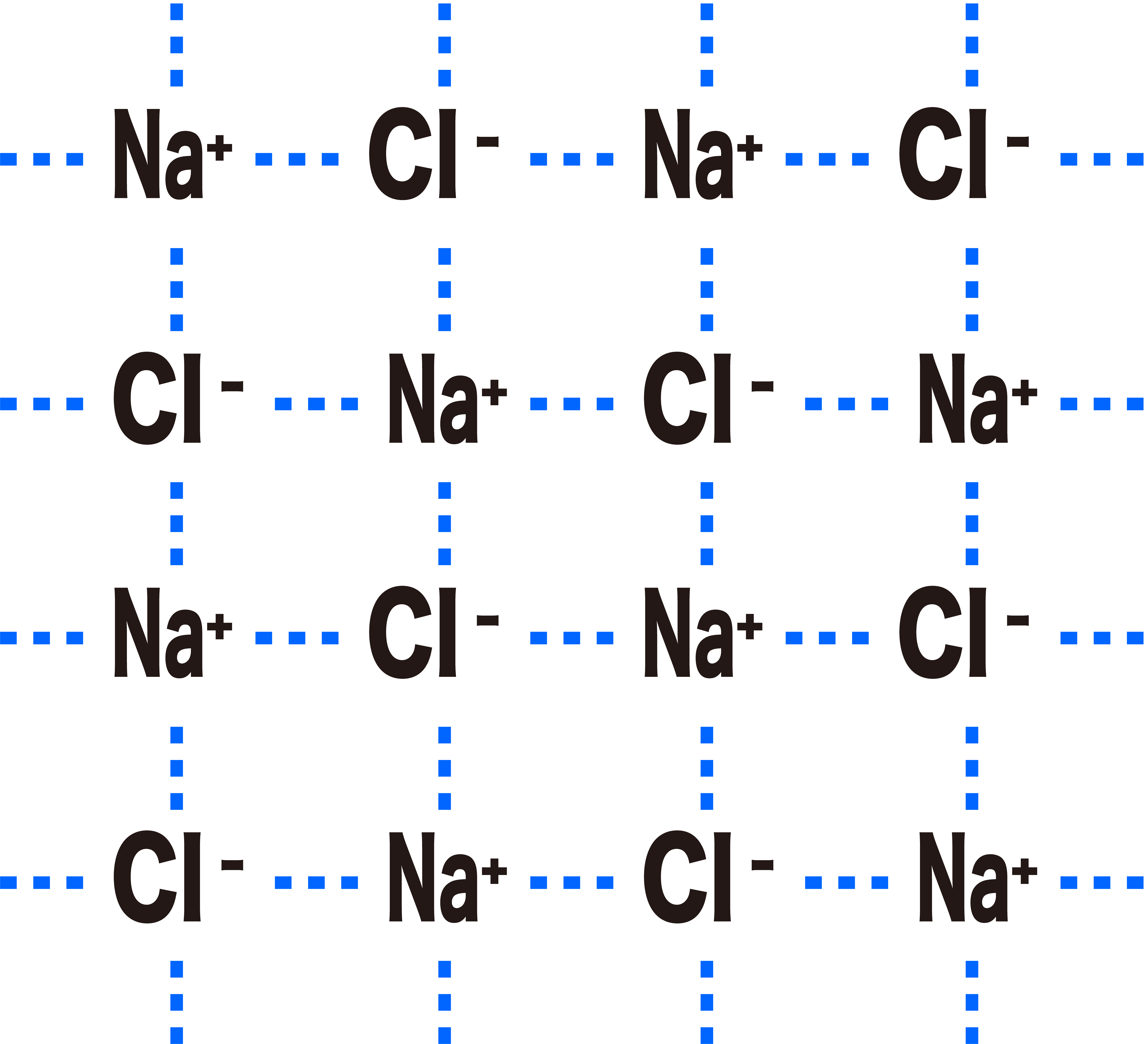
イオン結晶
- 粒子が規則正しく並んでできた固体を結晶といい、特にイオン結合によってできた結晶をイオン結晶という。イオン結晶には以下のような特徴がある。
水に溶けてイオンになる
- イオン結晶の物質は水に溶けてイオンになる。
- このように、物質がイオンに分かれることを電離といい、水に溶けて電離する物質を電解質という。
- 一方、水に溶けても電離しない物質を非電解質という。
- ほとんどのイオン結晶の物質は電解質である。
※塩化銀AgCl、硫酸バリウムBaSO4、炭酸カルシウムCaCO3など、沈殿を形成し易いものはイオン結晶であっても電離しない。
参考:陽イオン・陰イオン(違い・一覧・イオン式・価数・多原子イオンなど)
参考:水に難溶なイオン結晶(水酸化物・硫化物・塩化物・硫酸・クロム酸・炭酸イオン)
固体は電気を通さないが液体(融解液・水溶液)は電気を通す
- 固体の状態ではイオン同士がイオン結合で結びつき、動くことができないため、電気を通さない。
- しかし、水に溶かして水溶液にしたり、融点まで加熱して融解液にしたりすると、イオンが自由に動くことができるようになるため、電気を通す。
硬いがもろい
- 陽イオンと陰イオンは強く引き合うため、イオン結合は比較的強い結合である。したがって、イオン結晶は融点が高く、硬い性質をもつ。
- しかし、外部から力が加わると陽イオンと陰イオンの配列がずれて同符号のイオンが接近、反発し合うので簡単に割れる。(もろい)
- 各イオン結晶について詳しくは次のページを参照のこと。
イオン結合と組成式
- イオン結合とそれを表現する”組成式”について解説する。
組成式とは
- イオン結合によってつくられた物質は、陽イオンと陰イオンの数を最も簡単な整数比にした組成式で表される。
\[ \begin{align}&\mathrm{Na:Cl=1:1}\\
&\mathrm{→NaCl}\\
&\mathrm{Cu:Cl=1:2}\\
&\mathrm{→CuCl_{2}}\end{align}\]
- 塩化ナトリウムは、Na1個に対して1個のCl、つまりNaとClが「1:1」の割合で結合しているため「NaCl」、塩化銅(Ⅱ)はCu1個に対して2個のCl、つまりCuとClが「1:2」の割合で結合しているため「CuCl2」となる。
今回登場した”組成式”と共有結合で使われる”分子式」”を区別できるようにしましょう。分子式であるHClは「H1つとCl1つがくっついている」ことを、組成式であるNaClは「Na+とCl–が大量にくっついており、その比が1:1」であることを表しています。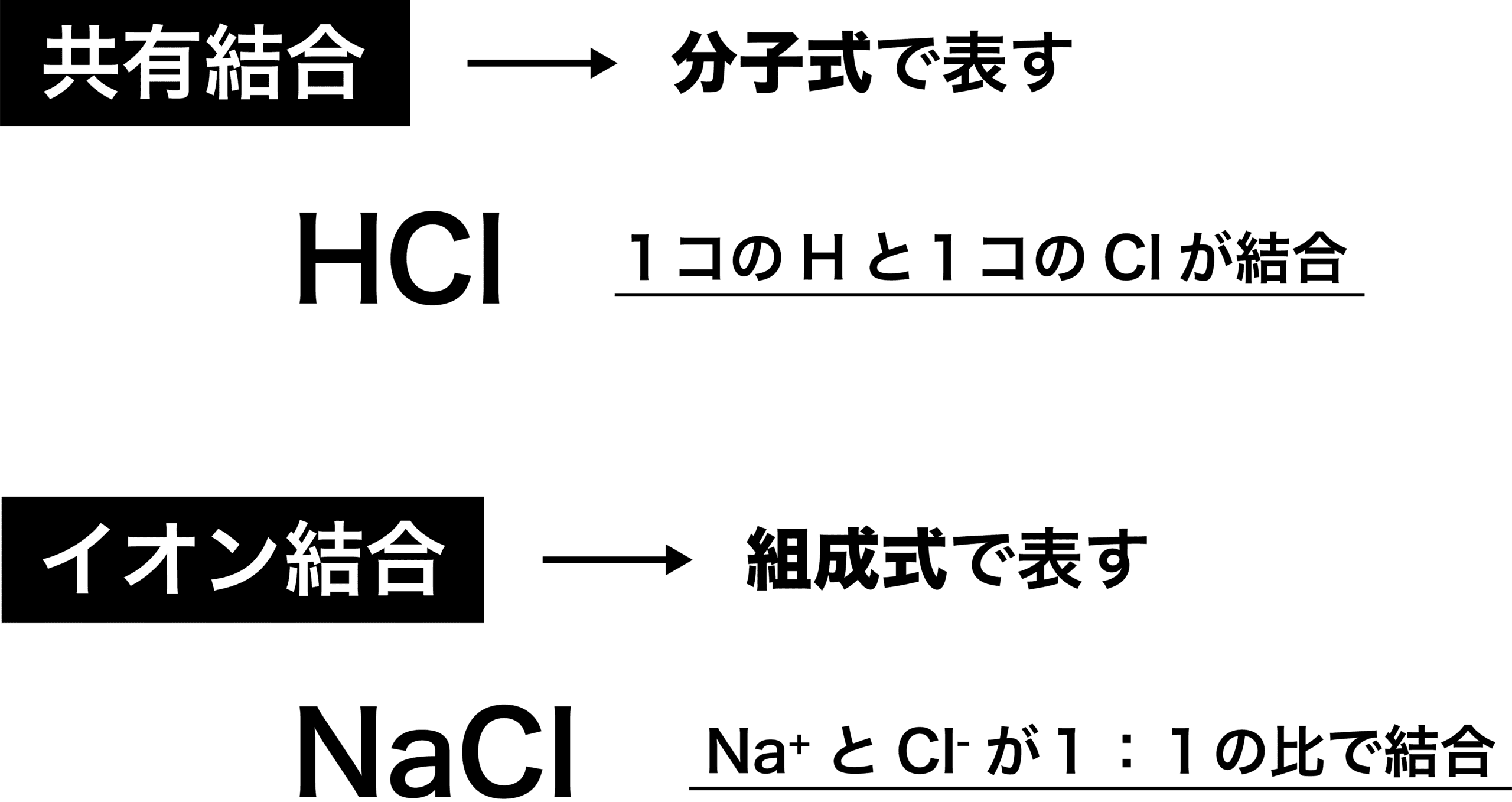
組成式のつくり方
- 組成式のつくり方について、Al2(SO4)3を例に次の手順で解説する。
●STEP1
陽イオンと陰イオンの価数比を求める。
●STEP2
たすき掛けをする。
STEP
陽イオンと陰イオンの価数比を求める。
まず、陽イオンと陰イオンの価数比を求める。
アルミニウムイオンの価数は「+3」、硫酸イオンの価数は「ー2」である。
したがって、価数比は次のようになる。
\[ \mathrm{Al^{3+}:SO_{4}^{2-}=3:2} \]
プラス・マイナスの符号は無視しましょう。
STEP
たすき掛けをする。
次に、STEP1で得た価数をもとに、たすき掛けをする。
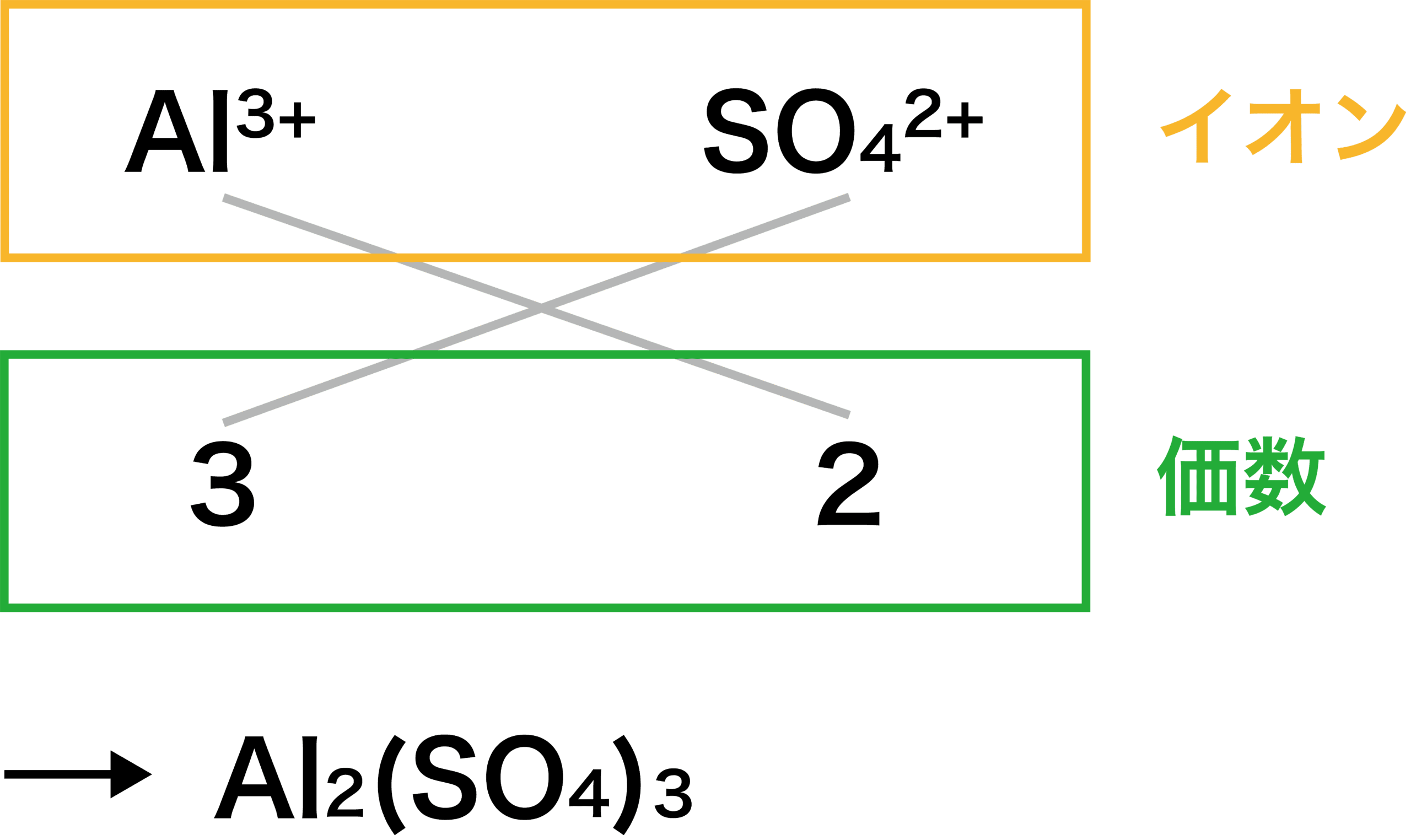
これにより、2つのAl3+と3つのSO42ーを組み合わせて「Al2(SO4)3」となる。