MENU
陽イオン・陰イオン(違い・一覧・イオン式・価数・多原子イオンなど)
目次
はじめに
【プロ講師解説】このページでは『陽イオン・陰イオン(違い・一覧・イオン式・価数・多原子イオンなど)』について解説しています。
陽イオン・陰イオン
- 原子は希ガスと同じ電子配置になったとき、安定化する。したがって、希ガス以外の原子は、電子を放出したり受け取ったりして、希ガスと同じ電子配置になろうとする。
- このとき生じるのがイオンである。
陽イオン
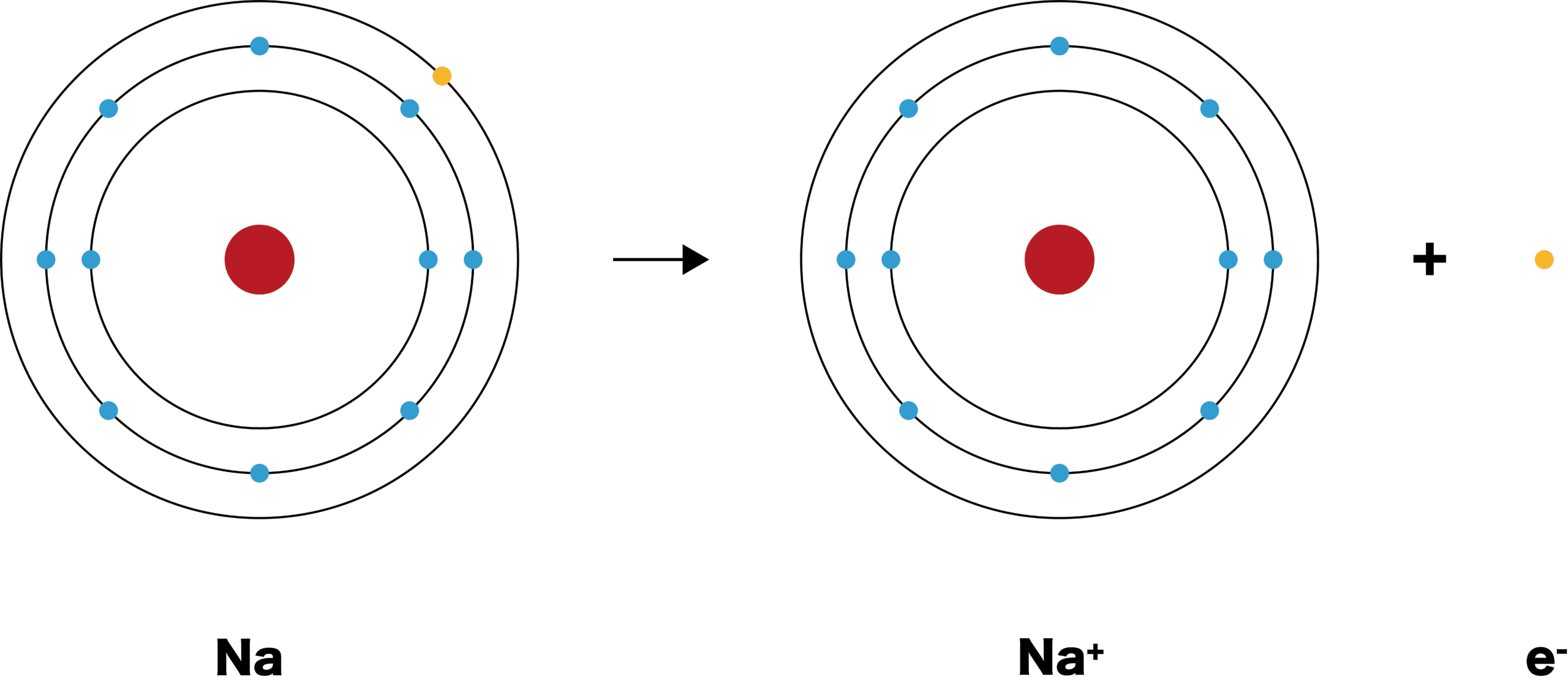
- 電子を放出し、全体として正の電荷をもつイオンを陽イオンという。
- ナトリウムNaは価電子を1個放出し、陽イオンであるナトリウムイオンNa+となる。
- ナトリウムイオンNa+の電子配置は、原子番号の近い希ガス、ネオンNeと同じである。
陰イオン
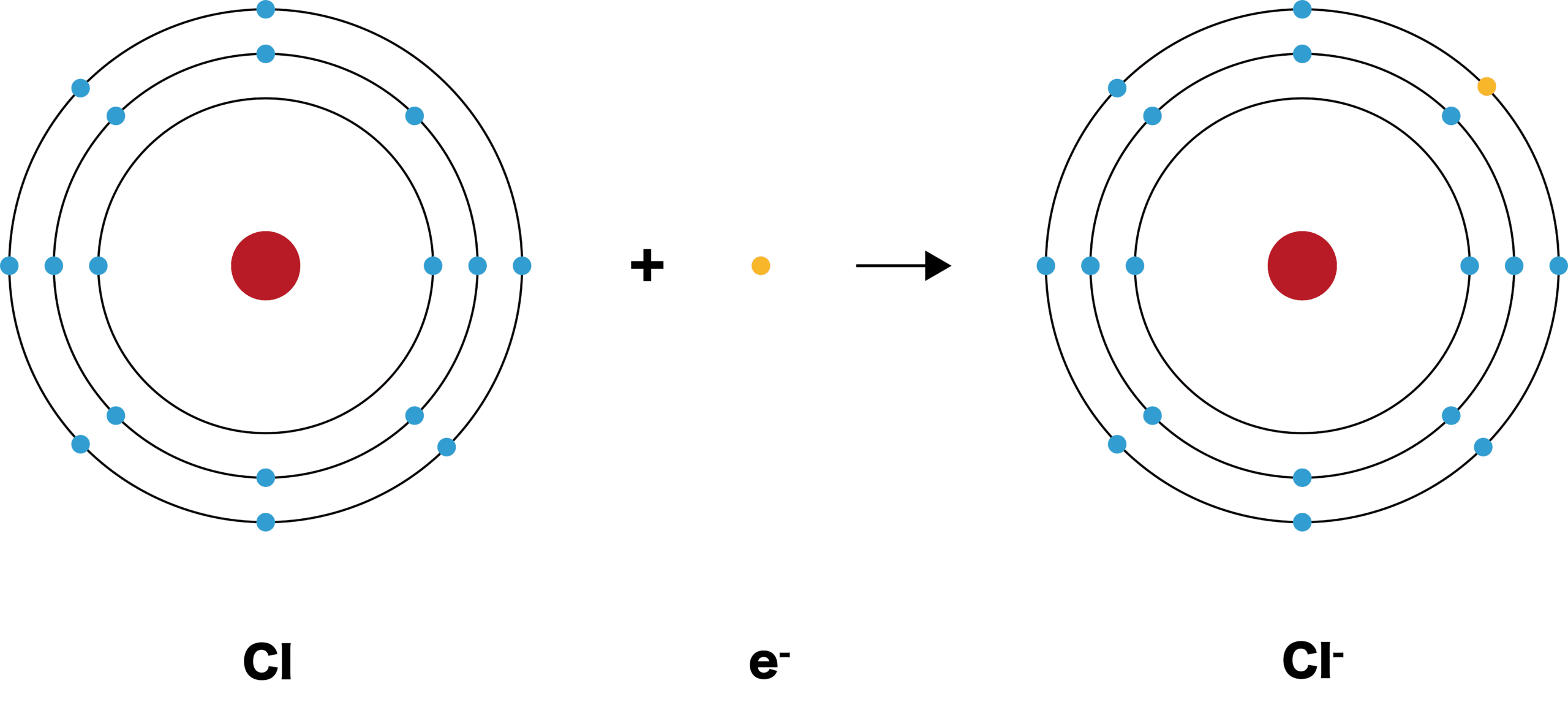
- 電子を受け取り、全体として負の電荷をもつイオンを陰イオンという。
- フッ素Fは最外殻に電子を1個取り込み、陰イオンであるフッ化物イオンF-となる。
- フッ化物イオンF-の電子配置は、原子番号の近い希ガス、ネオンNeと同じである。
イオン式・価数
- Na+やF-など、1個の原子からなるイオンを単原子イオンという。
- 単原子イオンは元素記号の右上に電荷を書いたイオン式で表す。
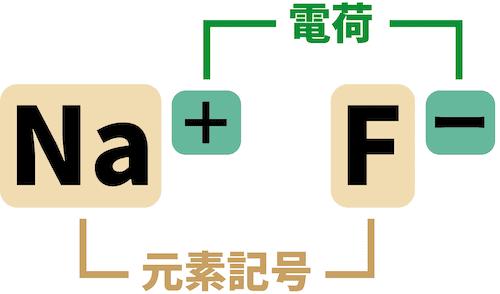
- このとき書いた電荷を、そのイオンの価数という。Na+は1価の陽イオン、 F-は1価の陰イオンである。
陽性・陰性
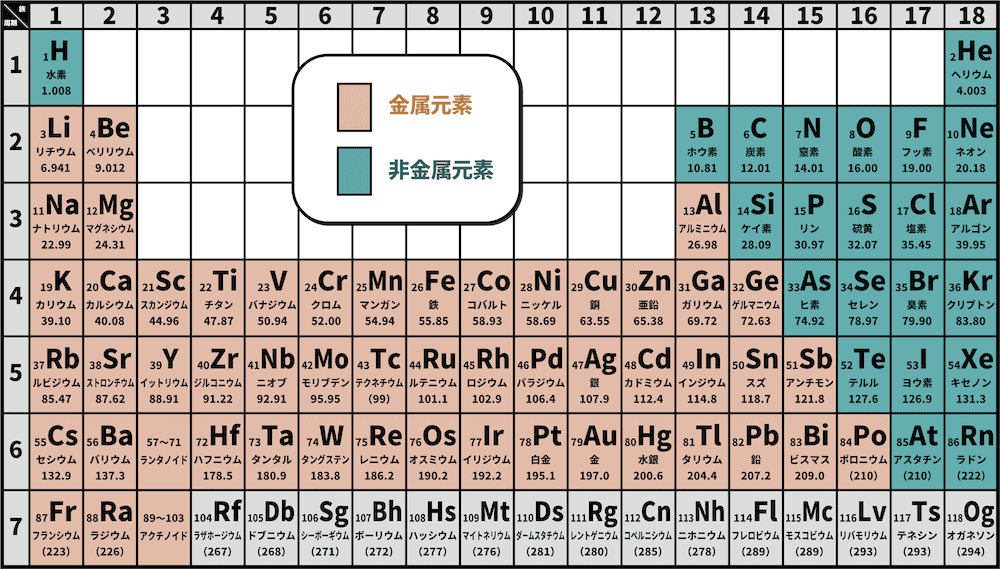
- 原子が陽イオンになろうとする性質を陽性、陰イオンになろうとする性質を陰性という。
- 一般に、金属元素は陽性が、非金属元素は陰性が強い。
多原子イオン
- 原子団がイオンになったものを多原子イオンという。
| 価数 | 名称 | イオン式 |
|---|---|---|
| 1 | 水酸化物イオン | OH– |
| 1 | シアン化物イオン | CN– |
| 2 | 炭酸イオン | CO32- |
| 1 | 炭酸水素イオン | HCO3– |
| 1 | 酢酸イオン | CH3COO– |
| 2 | シュウ酸イオン | C2O42- |
| 1 | 硝酸イオン | NO3– |
| 2 | 硫酸イオン | SO42- |
| 2 | 亜硫酸イオン | SO32- |
| 1 | 硫酸水素イオン | HSO4– |
| 3 | リン酸イオン | PO43- |
| 1 | チオシアン酸イオン | SCN– |
| 1 | 次亜塩素酸イオン | ClO– |
| 1 | 亜塩素酸イオン | ClO2– |
| 1 | 塩素酸イオン | ClO3– |
| 1 | 過塩素酸イオン | ClO4– |
| 1 | 過マンガン酸イオン | MnO4– |
| 2 | クロム酸イオン | CrO42- |
| 2 | ニクロム酸イオン | Cr2O72- |
代表的な単原子イオン・多原子イオンは次のページに一覧でまとまっているので、確認しておきましょう。
イオン式一覧













