MENU
第一イオン化エネルギー・電子親和力・電気陰性度の違い
目次
はじめに
【プロ講師解説】このページでは『第一イオン化エネルギー・電子親和力・電気陰性度の違い』について解説しています。
イオン化エネルギーとは
- 原子の最外殻から電子を1個奪うときに必要な最低限のエネルギーをイオン化エネルギー(第一イオン化エネルギー)という。
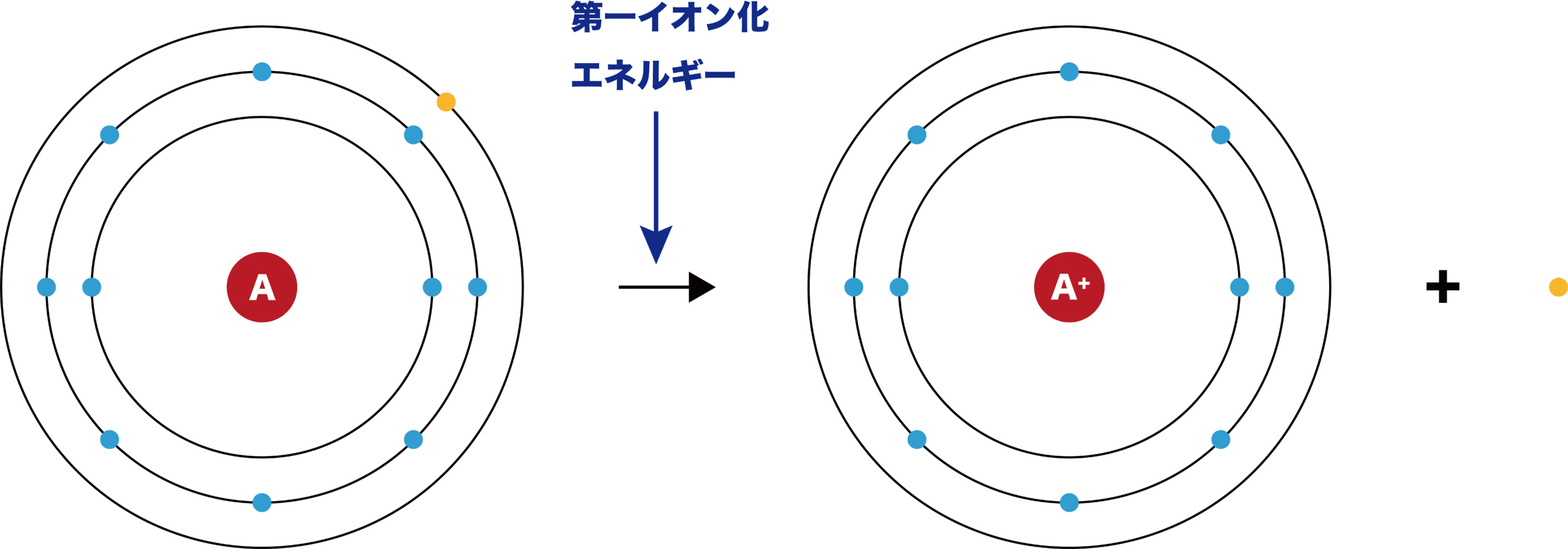
- イオン化エネルギーは、原子から電子を「奪うときに必要」なエネルギーなので、小さい方がより原子から電子を奪いやすい(=原子は電子を出しやすい)ということになる。
- 次のように、イオン化エネルギーを具体的な数字で表すと分かり易い。
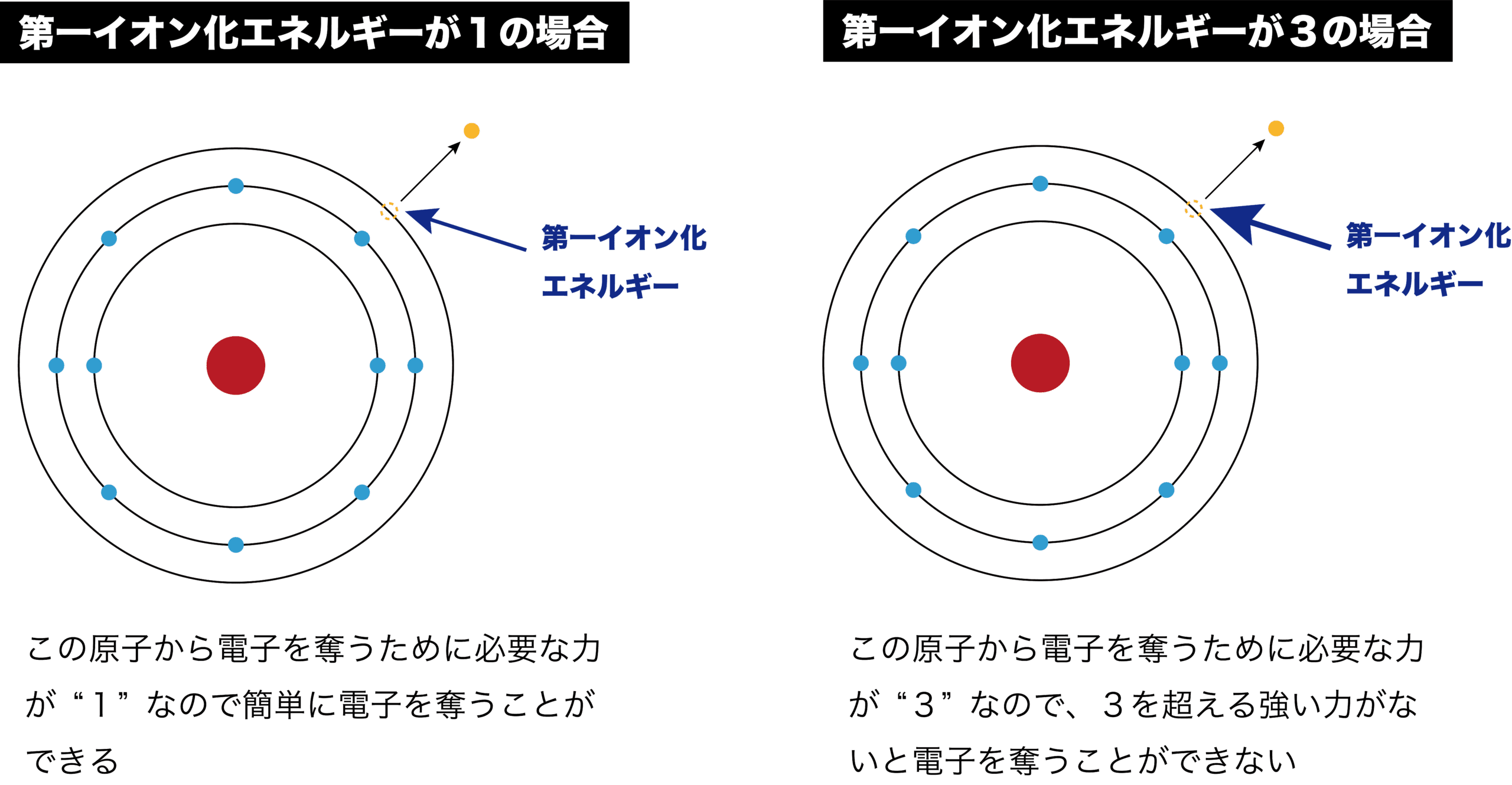
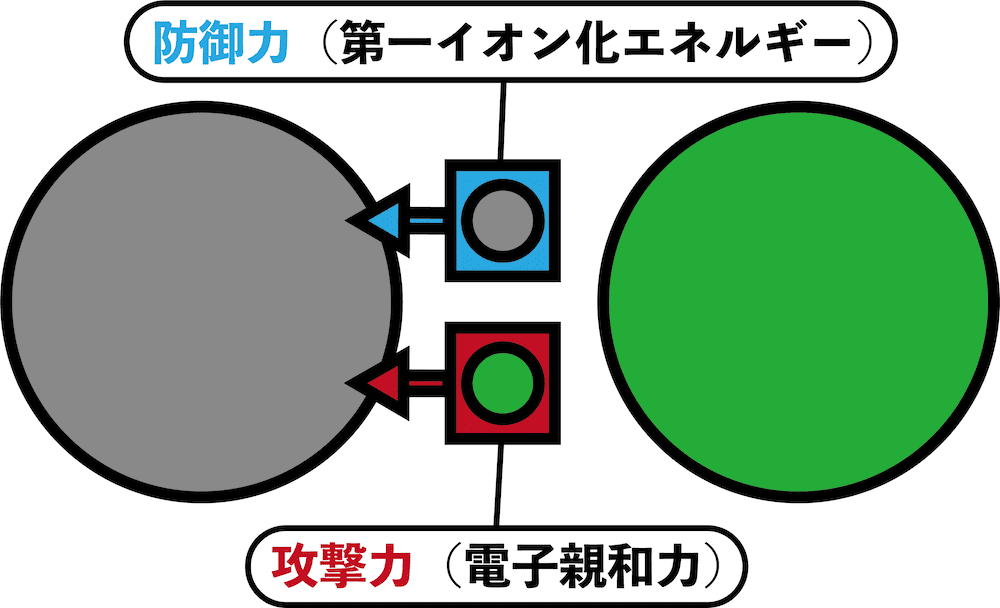
- また、以上を踏まえるとイオン化エネルギーはその原子の”防御力の指標”と考えることができる。
●イオン化エネルギー 大
→ 電子を奪われにくい → 防御力 高
●イオン化エネルギー 小
→ 電子を奪われやすい → 防御力 低
「原子がイオン化エネルギーを受けて電子を放出する」という反応は吸熱反応です。原子はイオン化エネルギーを「周りから受けて」電子を出すので、熱を受け取る反応、つまり吸熱反応となります。
電子親和力とは
- 原子に電子1個をくっつけたときに放出されるエネルギーを電子親和力という。
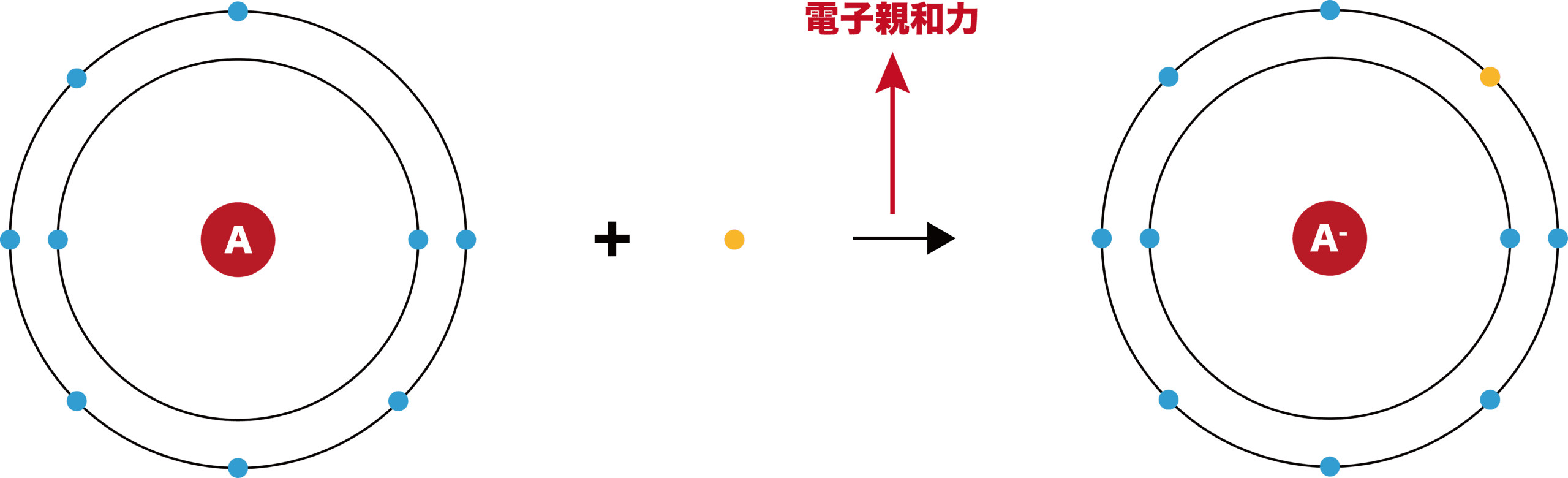
「力(ちから)」という文字がありますが、これは「エネルギー」と同じ意味をもちます。
電子親和力はイオン化エネルギーと対比して聞かれることが多いので、次のページも必ず確認しておきましょう。
参考:イオン化エネルギー(周期表での最大最小・グラフ・電子親和力との違いなど)
電子親和力=電子との仲の良さ
- 前述の通り、電子親和力とは、原子に電子1個をくっつけたときに放出されるエネルギーである。
- 電子親和力はイオン化エネルギーなどと比べてイメージしづらいが、「電子親和力=電子との仲の良さ」と考えると理解しやすい。
- 電子親和力が大きい場合、電子と仲がいい。電子と仲がいいということは、電子を他から奪う力が強い。
- 一方、電子親和力が小さい場合、電子と仲が良くない。仲が良くないということは、電子を他から奪う力が弱い。
- このように考えると(イオン化エネルギーを”防御力の指標”対応させて)電子親和力はその原子の”攻撃力の指標”と見ることができる。
●電子親和力 大
電子と仲がいい → 他から電子を奪いやすい → 攻撃力 高
●電子親和力 小
電子と仲が悪い → 他から電子を奪いにくい → 攻撃力 低
「原子に電子1個をくっつけたときに電子親和力が放出される」という反応は発熱反応です。電子親和力は電子をくっつけるときに「放出」されるエネルギー(熱)なので、熱を放出する反応、つまり発熱反応となります。
電気陰性度とは
- 異なる2つの原子(グレーとグリーン)が結合するとき、お互いが電子を1個ずつ出し合い、共有電子対を形成する。
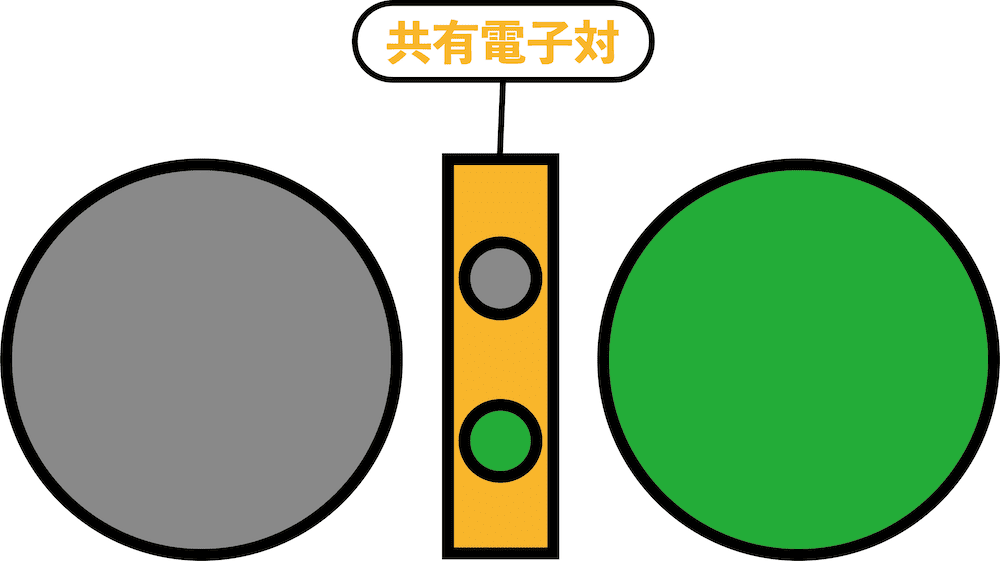
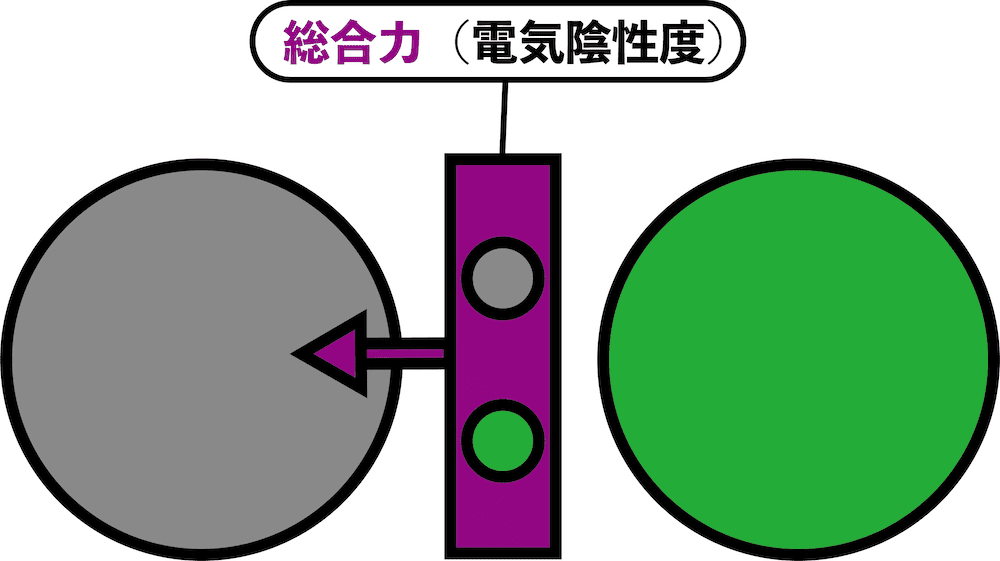
- このとき、原子が共有電子対を自分の方に引っ張る強さを電気陰性度という。
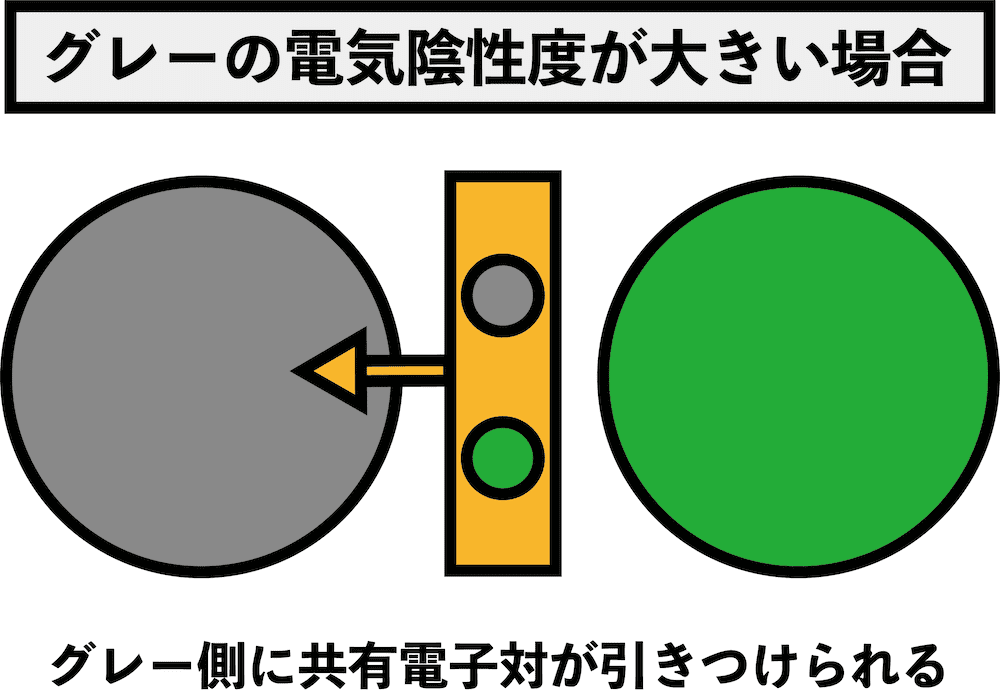
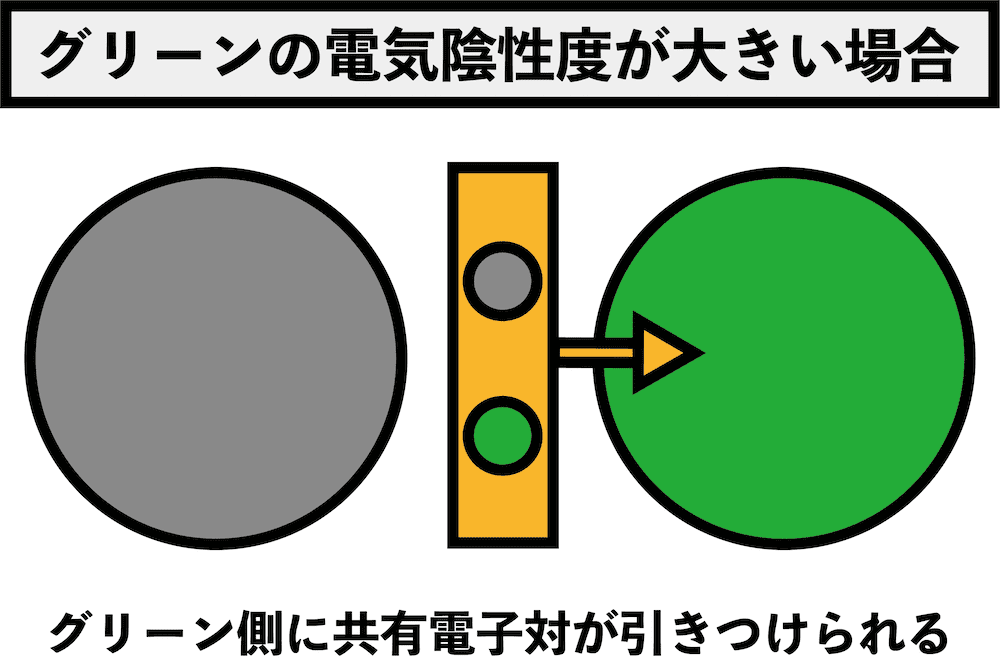
- 電気陰性度の大きい原子が、共有電子対をより強く自分側に引き寄せる。
電気陰性度と第一イオン化エネルギー・電子親和力の関係
- 第一イオン化エネルギーは「自分の電子を守る力(=防御力)」、電子親和力は「相手の電子を奪う力(=攻撃力)」である。
- 共有電子対は「自分の電子」と「相手の電子」が組み合わさってできたものである。
- したがって、電気陰性度、つまり「共有電子対を自分の方に引っ張る力」は、自分の電子を守る力(=防御力=第一イオン化エネルギー)と相手の電子を奪い取る力(=攻撃力=電子親和力)の両方を合わせた総合力ということになる。
第一イオン化エネルギー、電子親和力について詳しくは、次のページを確認しましょう。
・第一イオン化エネルギー(周期表での最大最小・グラフ・電子親和力との違いなど)
・電子親和力(周期表上での最大最小・グラフ・希ガスやハロゲンの場合など)
電気陰性度とマリケンの評価方法
- 電気陰性度・イオン化エネルギー・電子親和力の関係を表したマリケンの定義とよばれる式が存在する。

- この式をみると、電気陰性度はイオン化エネルギーと電子親和力の和に比例しており、イオン化エネルギーと電子親和力が大きくなればなるほど電気陰性度も大きくなるということがわかる。

※マリケンの定義は正確性に欠けることがわかり、現在はあまり使われていない。代わりにポーリングの定義が使われている。(マリケンの定義も、式が綺麗でわかり易いので参考にするのは全然あり)