MENU
第一イオン化エネルギー(周期表での最大最小・グラフ・電子親和力との違いなど)
目次
はじめに
【プロ講師解説】このページでは『イオン化エネルギー(周期表での最大最小・グラフ・電子親和力との違いなど)』について解説しています。
イオン化エネルギーとは
- 原子の最外殻から電子を1個奪うときに必要な最低限のエネルギーをイオン化エネルギー(第一イオン化エネルギー)という。
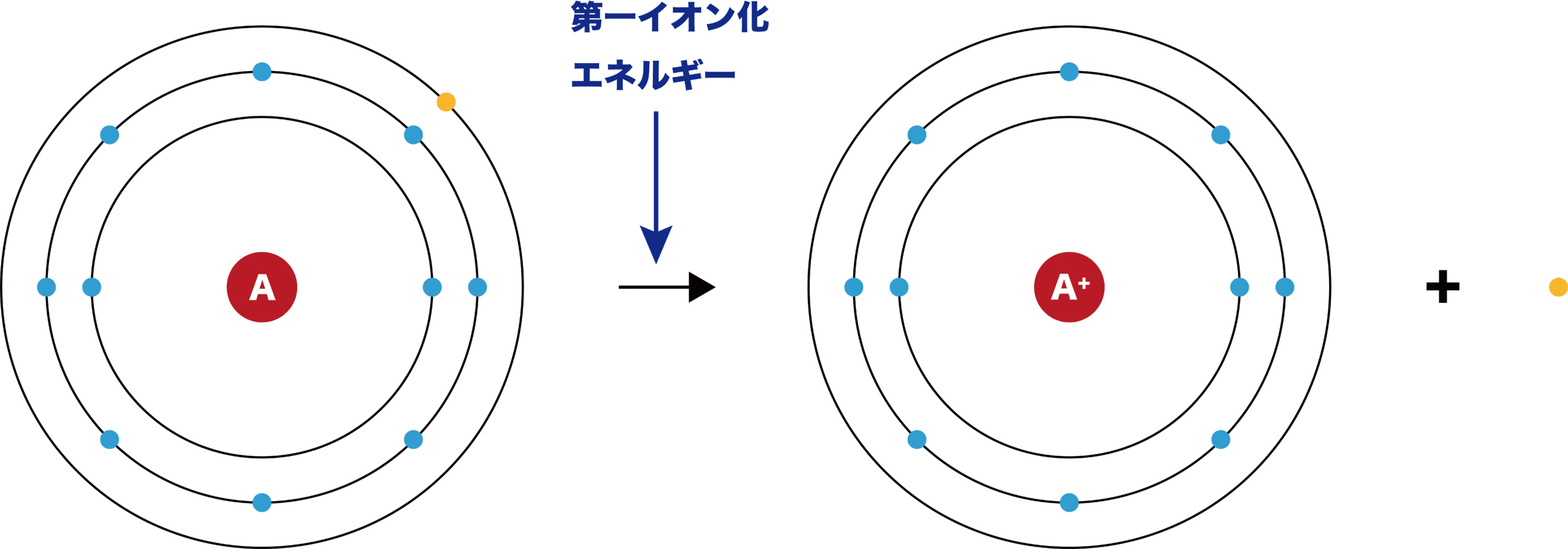
- イオン化エネルギーは、原子から電子を「奪うときに必要」なエネルギーなので、小さい方がより原子から電子を奪いやすい(=原子は電子を出しやすい)ということになる。
- 次のように、イオン化エネルギーを具体的な数字で表すと分かり易い。
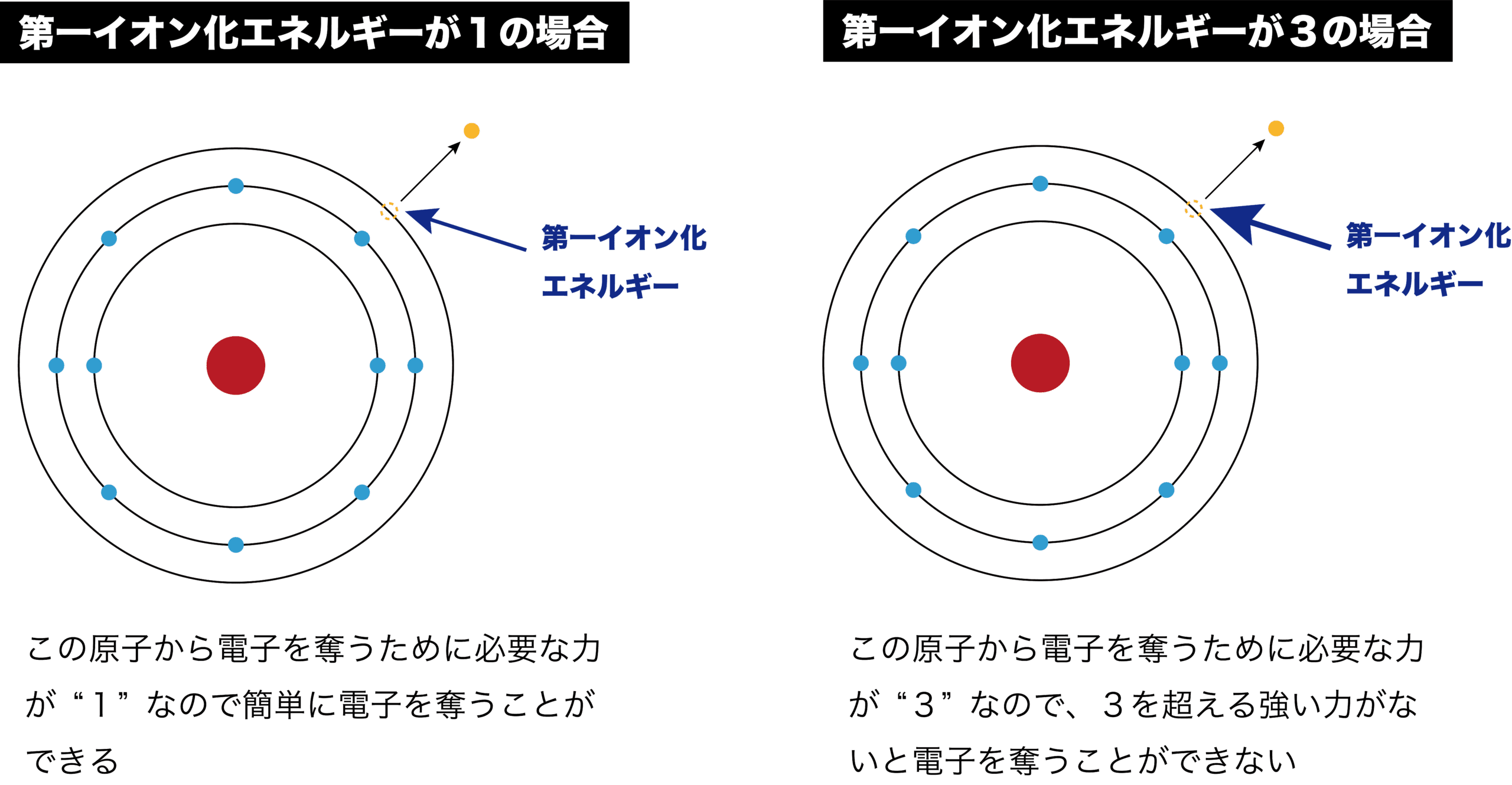
- また、以上を踏まえるとイオン化エネルギーはその原子の”防御力の指標”と考えることができる。
●イオン化エネルギー 大
→ 電子を奪われにくい → 防御力 高
●イオン化エネルギー 小
→ 電子を奪われやすい → 防御力 低
「原子がイオン化エネルギーを受けて電子を放出する」という反応は吸熱反応です。原子はイオン化エネルギーを「周りから受けて」電子を出すので、熱を受け取る反応、つまり吸熱反応となります。
イオン化エネルギーの周期表中での傾向
- イオン化エネルギーを原子番号順に並べると次のようになる。
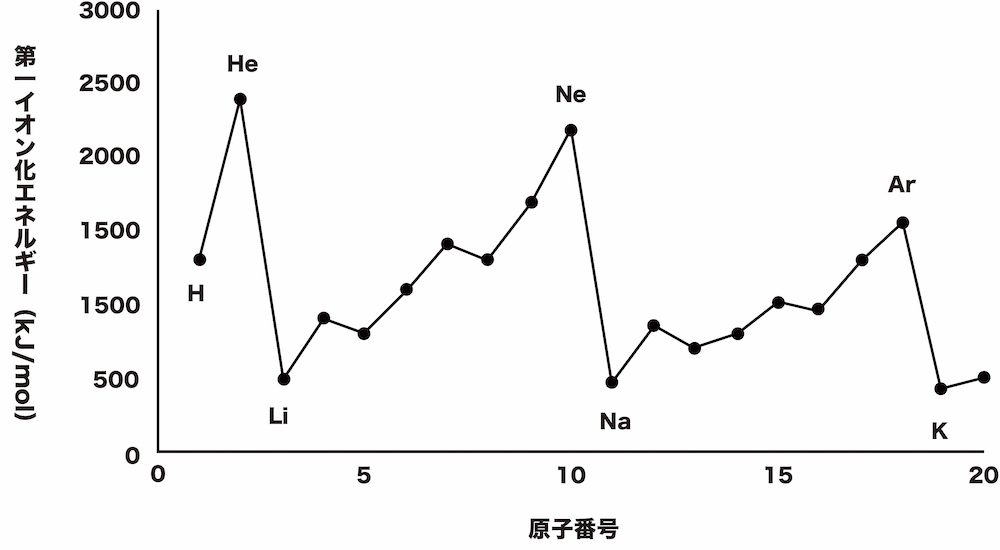
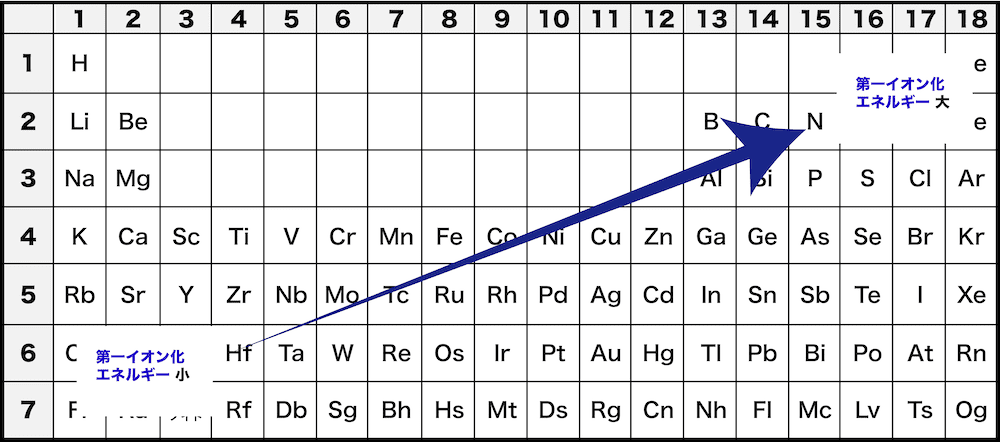
- 周期表で考えると、イオン化エネルギーはおおむね右上にいくにしたがって大きくなると考えることができる。
同周期
- 同周期では、右にいく(原子番号が大きくなる)にしたがってイオン化エネルギーが大きくなる。
- これは、陽子数が増えると、原子核が最外殻電子をより強く引きつけ、引き離すのに大きなエネルギーを必要とするためである。
同族
- 同族では、下にいく(原子番号が大きくなる)にしたがってイオン化エネルギーが小さくなる。
- これは、電子殻が増えると、最外殻電子が原子核から離れ、引き離しやすくなるためである。
希ガス
- 希ガスのイオン化エネルギーは非常に大きい。これは、希ガスの電子配置は非常に安定しており、電子を引き離しにくいからである。
有効核電荷
- ここまで、次のような解説を記載した。
- 同族では、下にいく(原子番号が大きくなる)にしたがってイオン化エネルギーが小さくなる。
- これは、電子殻が増えると、最外殻電子が原子核から離れ、引き離しやすくなるためである。
- これを聞いたときに、このような疑問が浮かぶ人がいるはず。
周期表の下にいくほど電子殻が増えてイオン化エネルギーが小さくなるのはイメージできます。ただ、陽子数も増えて、電子を引きつける力が強くなり、その点ではイオン化エネルギーは大きくなりませんか?
- ここでは、この疑問を解消するため、有効核電荷という考え方について学ぶ。
- 一族元素であるリチウムLiにおいて、K殻は閉殻状態である。
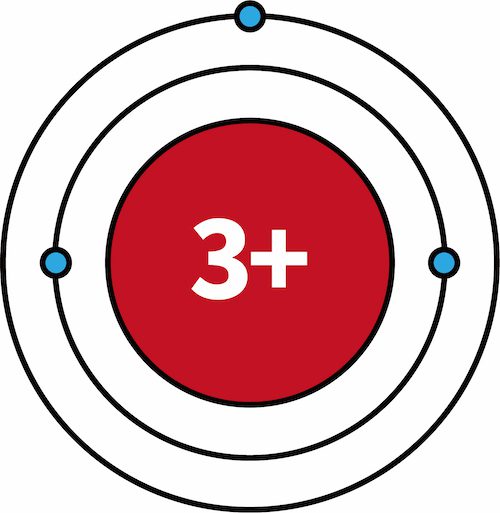
- このとき、K殻に存在する2個の電子は、原子核の正電荷+3のうち+2分を打ち消している。
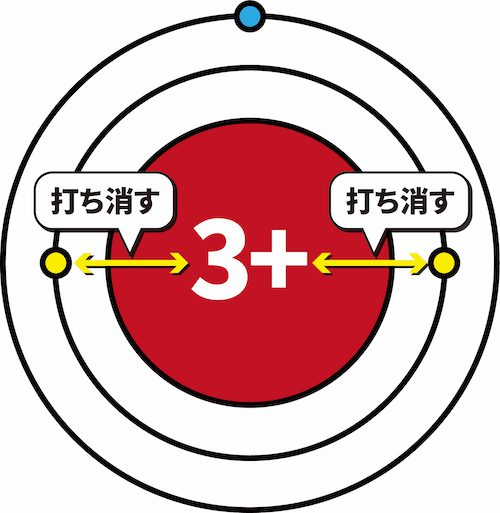
- その結果、L殻に存在する1個の最外殻電子にはたらく原子核の正電荷は+1となる。
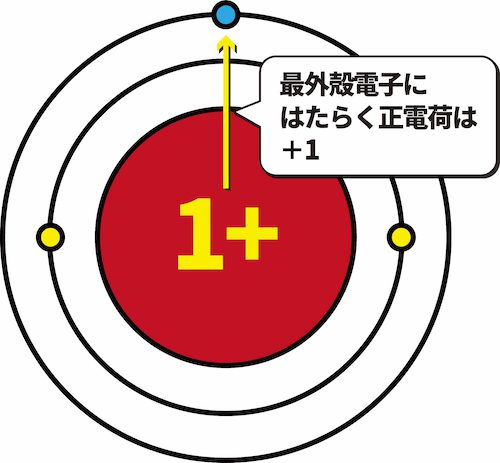
- このように、原子核の正電荷のうち、最外殻電子に実際にはたらく”みかけ上の電荷”を有効核電荷という。
- 一族元素であるLiとNaの有効核電荷を比較すると、両方とも+1で等しい。
| リチウムLi | ナトリウムNa | |
|---|---|---|
| 電子配置 |  | 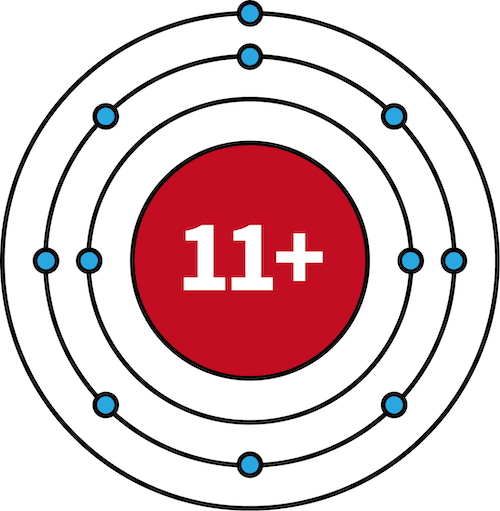 |
| 有効核電荷 | 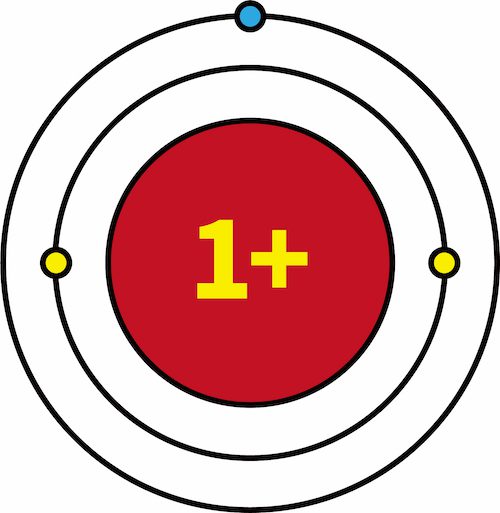 | 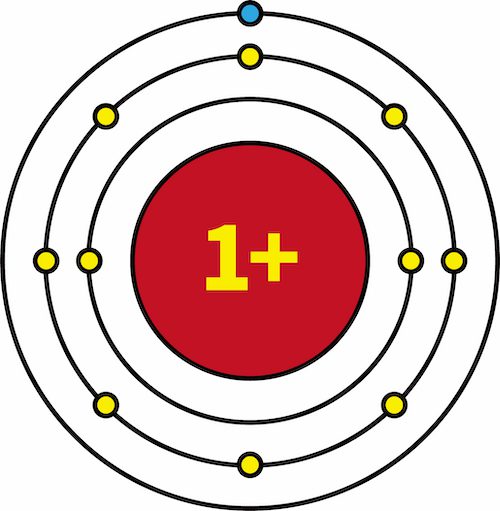 |
参考:電子配置(書き方・例題・電子を並べる順番やルール・覚え方など)
- したがって、陽子数に関わらず原子核から最外殻電子にはたらく電荷は同じであり、電子殻の数のみがイオン化エネルギーの大小に影響する。
- これが、同族の原子で、下にいく(原子番号が大きくなる)にしたがってイオン化エネルギーが小さくなる理由である。
第二イオン化エネルギー・第三イオン化エネルギーについて
- 先述の通り、第一イオン化エネルギーは原子から1個の電子を奪うために必要なエネルギーである。
- イオン化エネルギーには、第一イオン化エネルギーの他に第二イオン化エネルギー・第三イオン化エネルギーも存在しており、第二イオン化エネルギーは一価の陽イオンからさらに電子を1個奪うために必要なエネルギー、第三イオン化エネルギーは二価の陽イオンからさらに電子を1個奪うために必要なエネルギーである。
- 通常、同じ原子では第一イオン化エネルギー、第二イオン化エネルギー、第三イオン化エネルギーの順に大きくなる。したがって、ナトリウムNaなど第一イオン化エネルギーが比較的小さく陽イオンになりやすい原子でも、第二イオン化エネルギー以降は非常に大きいため、2個以上の電子を失ってNa2+やNa3+といった形になる可能性は低い。
イオン化エネルギーまとめ
この『イオン化エネルギー(周期表での最大最小・グラフ・電子親和力との違いなど)』のページで解説した内容をまとめる。
- 原子の最外殻から電子を1個奪うときに必要な最低限のエネルギーをイオン化エネルギー(第一イオン化エネルギー)という。
- ●イオン化エネルギー 大
→ 電子を奪われにくい → 防御力 高
●イオン化エネルギー 小
→ 電子を奪われやすい → 防御力 低 - 「原子がイオン化エネルギーを受けて電子を放出する」という反応は吸熱反応である。
- 同周期では、右にいく(原子番号が大きくなる)にしたがってイオン化エネルギーが大きくなる。
- 同族では、下にいく(原子番号が大きくなる)にしたがってイオン化エネルギーが小さくなる。
- 貴ガス(希ガス)のイオン化エネルギーは非常に大きい。これは、希ガスの電子配置は非常に安定しており、電子を引き離しにくいからである。
参考:貴ガス(希ガス)の電子配置が安定な理由














