MENU
酸・塩基の定義(アレニウス/ブレンステッド・ローリー)
目次
はじめに
【プロ講師解説】このページでは『酸・塩基の定義(アレニウス/ブレンステッド・ローリー)』について解説しています。
酸・塩基の定義
- 酸・塩基の定義として有名なアレニウスの定義、ブレンステッド・ローリーの定義を紹介する。
| アレニウスの定義 | 酸 | H+を出すもの |
| 塩基 | OHーを出すもの | |
| ブレンステッド・ローリーの定義 | 酸 | H+を出すもの |
| 塩基 | H+を受け取るもの |
アレニウスの定義
| 酸 | H+を出すもの |
| 塩基 | OHーを出すもの |
- 水溶液中で水素イオンH+を放出する物質を酸、OHーを放出する物質を塩基とする。これをアレニウスの定義という。
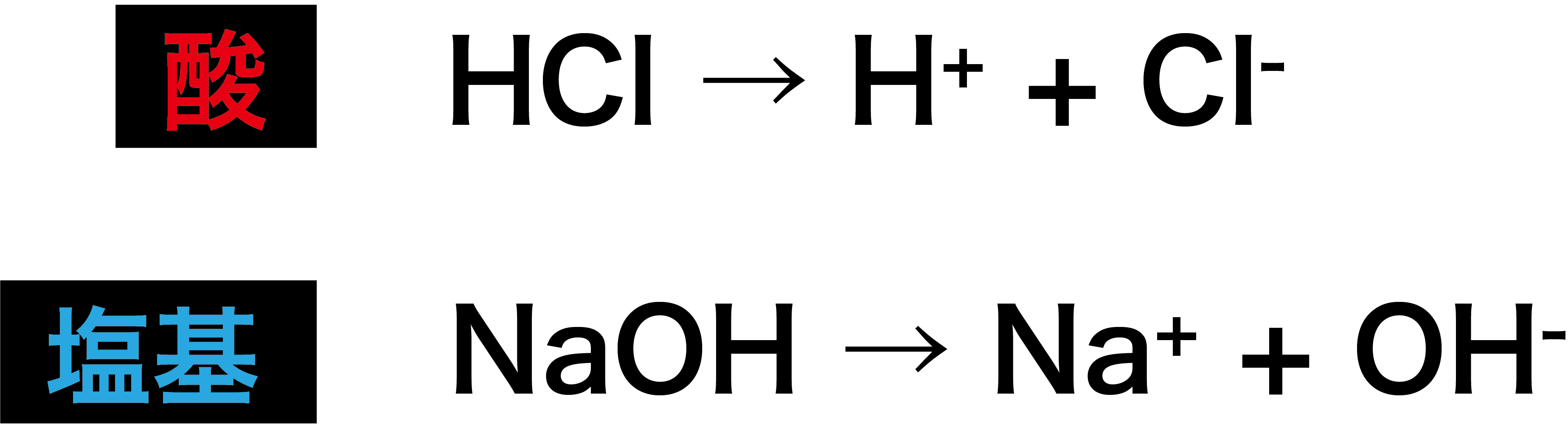
- しかし、アレニウスの定義は「水溶液中」という条件に限定されるので、やや使いづらい面がある。そこで新たに提唱されたのが「ブレンステッド・ローリーの定義」である。
ブレンステッド・ローリーの定義
| 酸 | H+を出すもの |
| 塩基 | H+を受け取るもの |
- 水素イオンH+を出す物質を酸、H+を受け取る物質を塩基とする。これをブレンステッド・ローリーの定義という。
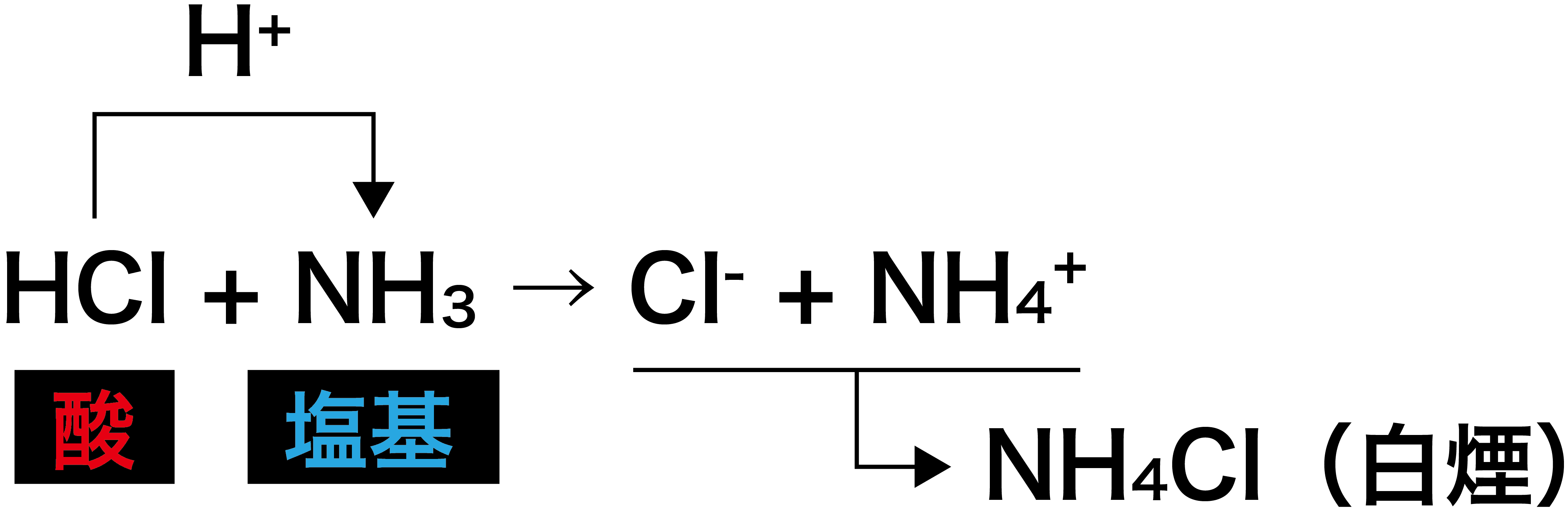
- 酸であるHClが水素イオン(H+)を出してClーとなり、塩基であるNH3がH+を受け取ってNH4+になる。
- ClーとNH4+は組み合わさって塩化アンモニウムNH4Clの白煙となる。
オキソニウムイオンとブレンステッド・ローリーの定義
- 水溶液中で酸から生じたH+は不安定なため、水分子と配位結合してオキソニウムイオンH3O+として存在している。
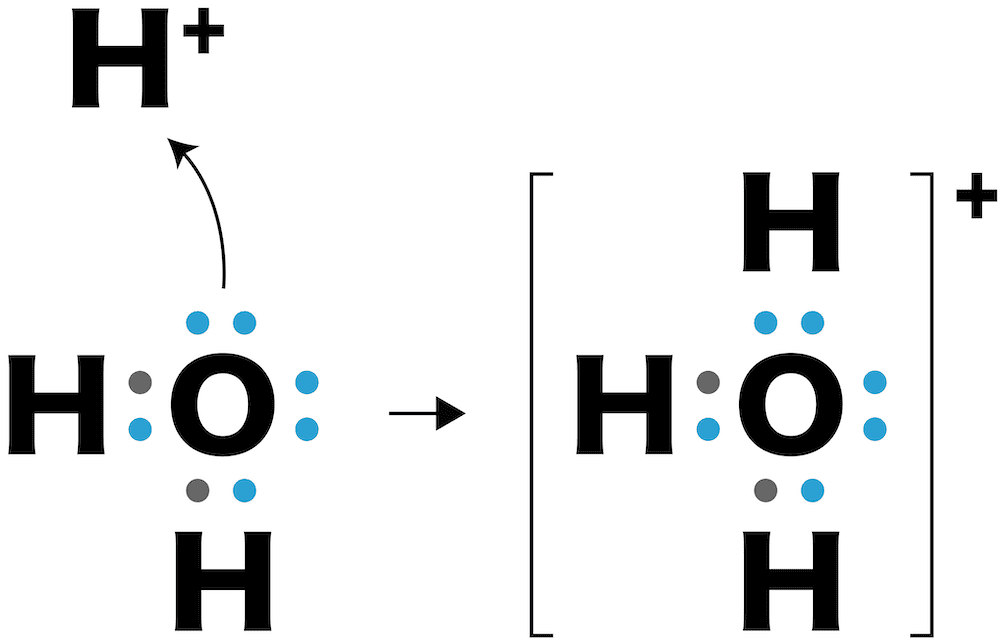
- たとえば、硝酸HNO3の電離は通常次のように表す。
\[ \mathrm{HNO_{3}→NO_{3}^{-}+H^{+}} \]
- しかしこれは省略した書き方で、正確には次のように書く。
\[ \mathrm{HNO_{3}+H_{2}O→NO_{3}^{-}+H_{3}O^{+}} \]
- この式で考えると、ブレンステッド・ローリーの定義より、HNO3の電離反応ではH2Oを塩基として捉えることができる。
酸・塩基の定義まとめ
この『酸・塩基の定義(アレニウス/ブレンステッド・ローリー)』のページで解説した内容をまとめる。
- 水溶液中で水素イオンH+を放出する物質を酸、OHーを放出する物質を塩基とする。これをアレニウスの定義という。
- 水素イオンH+を出す物質を酸、H+を受け取る物質を塩基とする。これをブレンステッド・ローリーの定義という。














