MENU
【共洗い】中和滴定でビュレットとホールピペットを共洗いする理由や器具の覚え方など
はじめに
【プロ講師解説】このページでは『逆滴定(例題・計算問題の解き方・原理など)』について解説しています。
共洗いするもの・共洗いしないもの
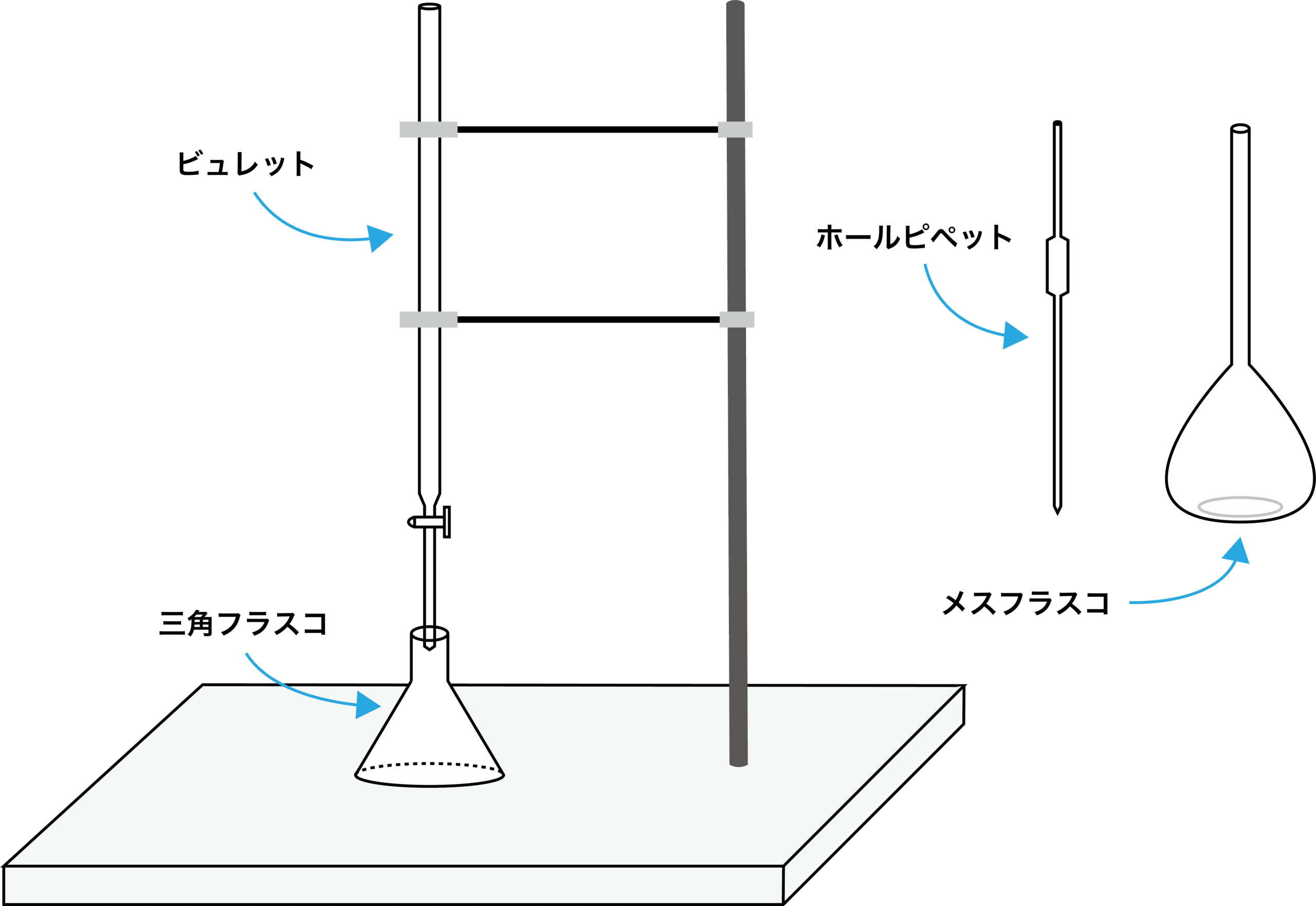
- 中和滴定で使用する器具において、共洗いするものとしないものを一覧で示す。
| 共洗いするもの | ホールピペット |
| ビュレット | |
| 共洗いしないもの | メスフラスコ |
| 三角フラスコ |
- 実験器具名の中に「ト」が付いているものは共洗いをする。
- 「ト」が付いているのは「ホールピペット」と「ビュレット」の2つ。この2つは、実験途中で共洗いの作業が必要となる。
- これ以降、中和滴定の流れを説明した後、各実験器具について細かい解説をし、なぜ共洗いが必要・不必要なのかを確認していく。
中和滴定の流れ
- 中和滴定の流れ・手順を解説する。
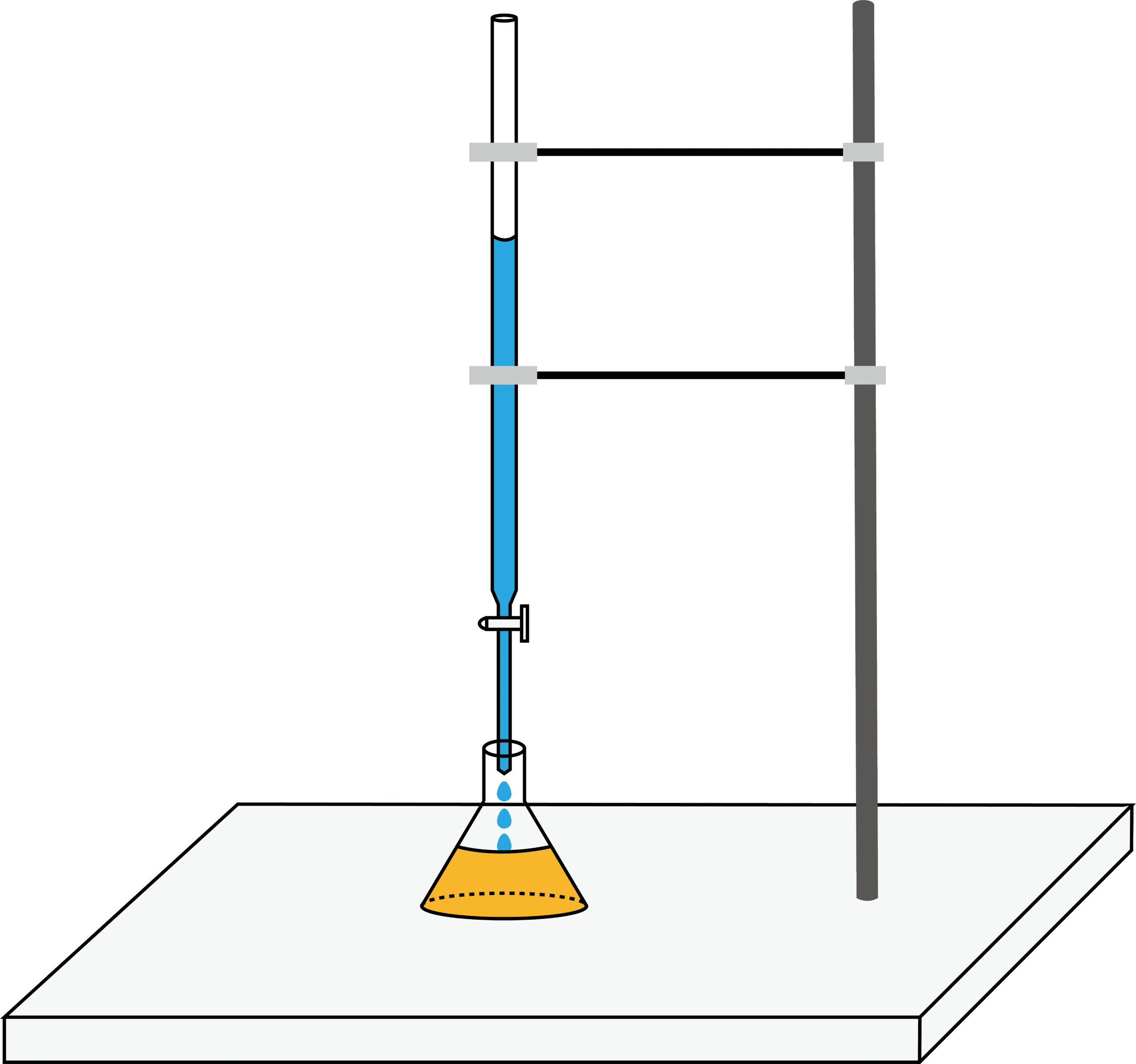
中和滴定の流れ
●STEP1
メスフラスコを用いて標準溶液を調製する。
●STEP2
ホールピペットを用いて標準溶液を三角フラスコに移動させる。
●STEP3
濃度不明の溶液をビュレットに入れる。
●STEP4
濃度不明の溶液を滴下する。
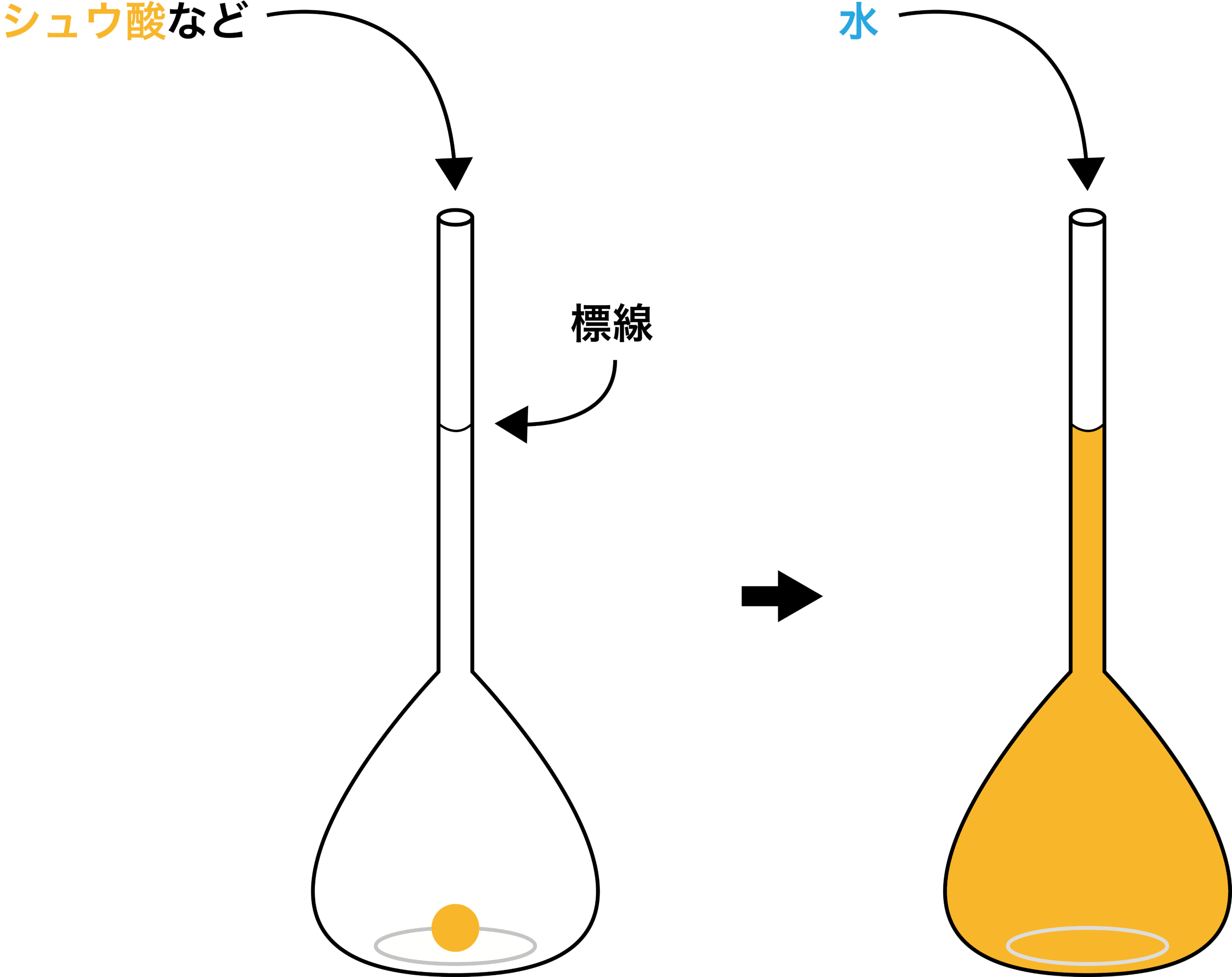
まずは、標準溶液を調製する。標準溶液とは”濃度既知の溶液”であり、中和滴定ではこれを使って”濃度未知の溶液”(=試料)の濃度を求める。標準溶液を調製するときはメスフラスコという道具を用いる。
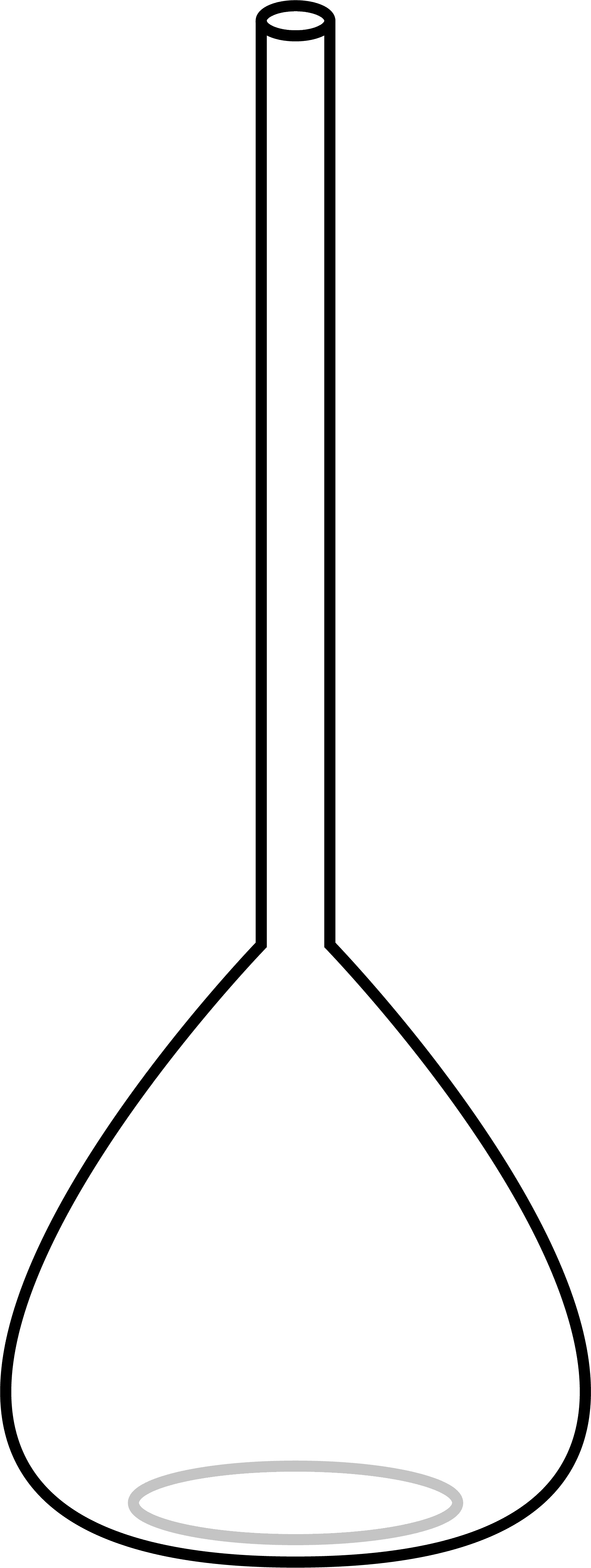
メスフラスコの細くなった先端部分には「標線」という線があり、一定量の化学物質を入れた後にこの線まで水を入れることで、作りたい濃度の溶液を普通のフラスコよりも正確に調製することができる。
次に、ホールピペットを用いて、STEP1で調整した標準溶液を三角フラスコに移動させる。
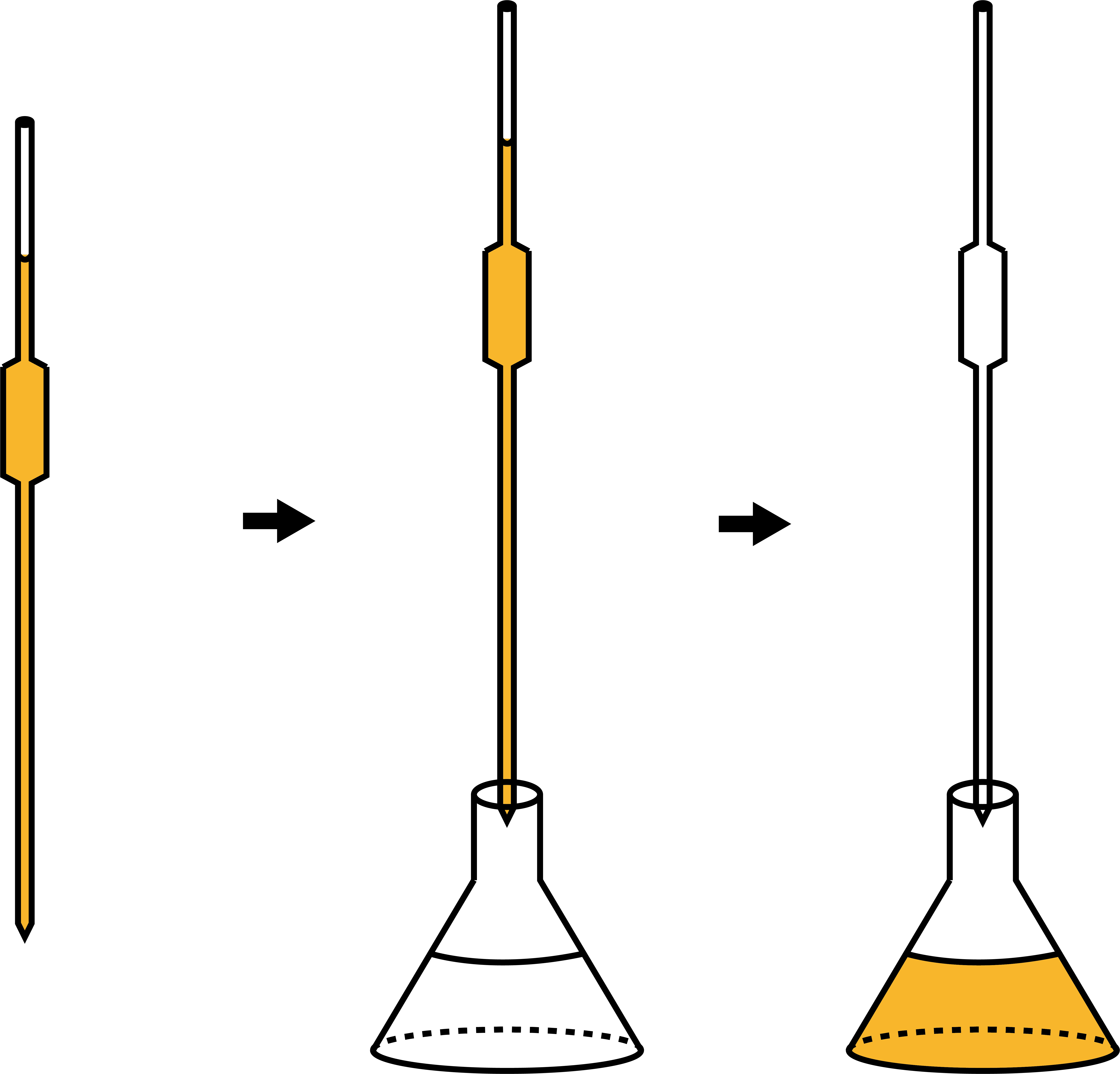
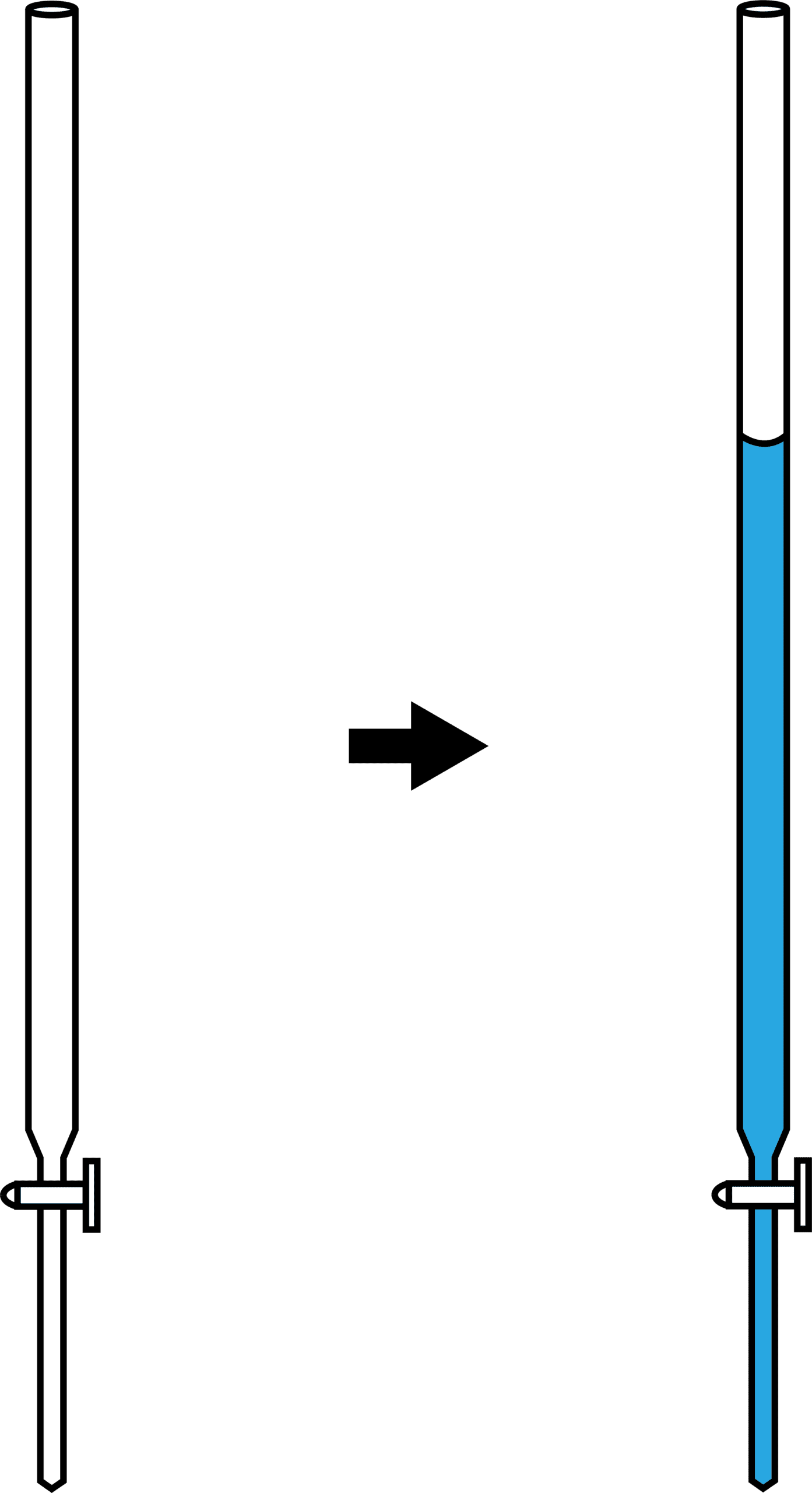
次に、濃度不明の溶液をビュレットに入れる。
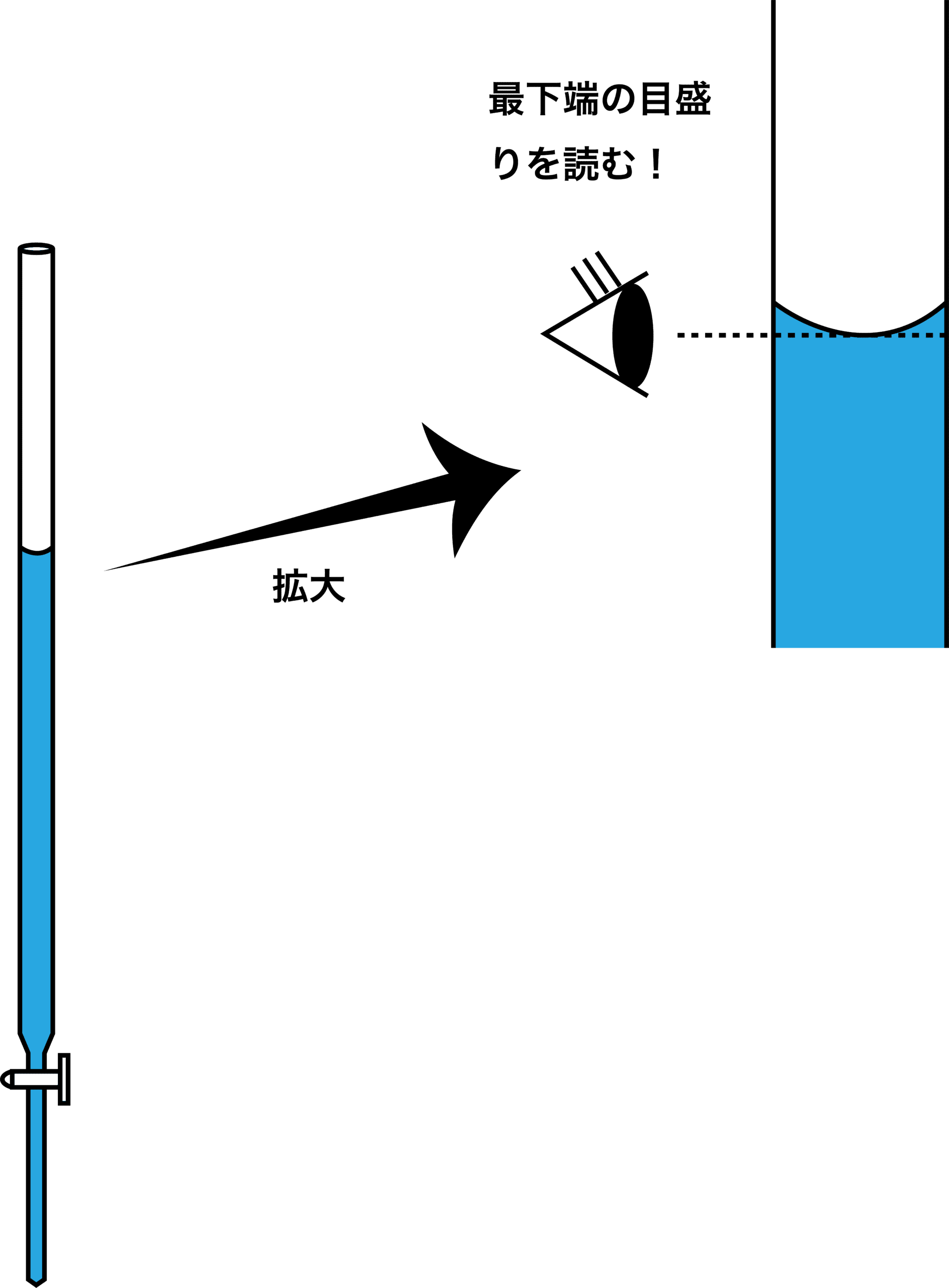
ちなみに、ビュレットの目盛りはボコっとなっている液面の一番下の位置を読むということに注意しよう。
共洗いをするものとしないもの
- 中和滴定で使用する器具において、共洗いするものと共洗いしないものを一覧で示す。
| 共洗いするもの | ホールピペット |
| ビュレット | |
| 共洗いしないもの | メスフラスコ |
| 三角フラスコ |
- ホールピペットとビュレットは共洗いをするが、メスフラスコと三角フラスコは共洗いはしない。
- なぜ共洗いをするものとしないものが存在するのか、その違いや見分け方について器具別に解説する。
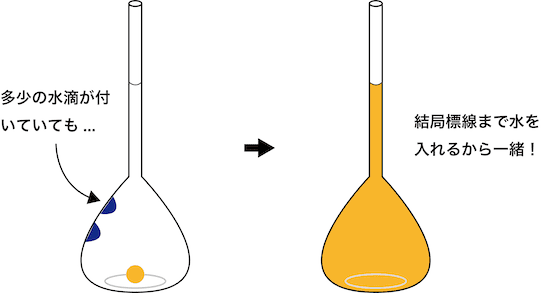
メスフラスコ
- メスフラスコは、標準溶液を調製するときに用いる。

- ポイントは「水」を入れている点である。
- 結局水を一定量まで入れるなら、最初多少水で濡れていようと関係ない。したがって、メスフラスコを共洗いする必要はない。
ホールピペット
- ホールピペットは、調製した標準溶液を量りとって、三角フラスコに移し取るときに用いる。
- 標準溶液というのは「濃度が正確に分かっている」溶液である。したがって、標準溶液の濃度はホールピペットを使って量りとったあとも一定の値に保たれていなければならない。
- それにも関わらず、もしホールピペットに洗ったときの水滴など”標準溶液以外のもの”が付いていると、せっかく正確に調製した濃度が変わってしまう。
- したがって、ホールピペットは必ず標準溶液で共洗いをしてから用いる。
ビュレット
- ビュレットは、濃度不明の溶液を上から滴下する際に用いる道具である。
- ビュレットに水滴が付いていると、その分溶液の濃度が変化してしまい、結果として濃度計算をするときに値がズレてしまう。
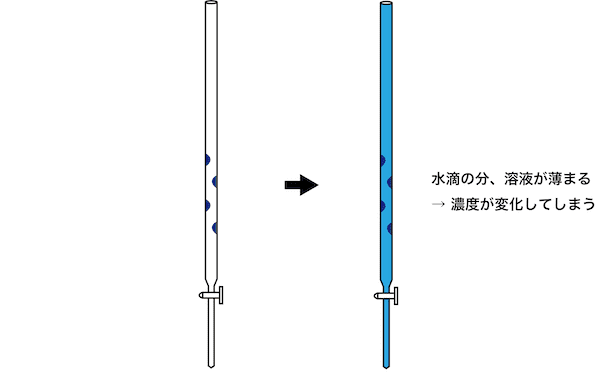
- したがって、ビュレットを中和滴定に用いる際は、共洗いをして水滴を取り除く必要がある。
三角フラスコ
- 三角フラスコは、ホールピペットで量りとった標準溶液を入れ、ビュレットから落ちてくる濃度未知の溶液を受け止めるために用いる。
- 【公式あり】中和計算を一瞬で解く方法を理由を交えて徹底解説!にあるように、中和の計算式は次の通りである。
\[ \underbrace{ \mathrm{酸のmol×酸の価数} }_{ \mathrm{H^{+}のmol} }=\underbrace{ \mathrm{塩基のmol×塩基の価数} }_{ \mathrm{OH^{-}のmol} } \]
- これを見て分かるように、左辺と右辺で比べているのは酸・塩基の「mol」である。ということはつまり、「mol」の値さえ変わらなければ計算上支障はないと考えることができる。
- 三角フラスコに多少の水滴が残っていても、標準溶液に含まれている物質の「mol数」自体に変化はないので、三角フラスコは共洗いをせずに用いることができる。
ビュレットを共洗いする理由
- 次のような質問をよく受ける。
「mol数同士を比べるから三角フラスコの共洗いが必要ないなら、ビュレットも共洗いしなくていいんじゃない?」
- まず、三角フラスコに入っている液が元々どこから来たかを考える。
- 三角フラスコに入っている溶液は「メスフラスコで調製した標準溶液をホールピペットで量り取った溶液」である。
- つまり、標準溶液は濃度既知の溶液で、それを一定量正確に量り取っているわけなので、「標準溶液のmol数」はもう既に決まった値ということになる。
- 標準溶液が酸、濃度未知の溶液が塩基だとすると、次のようになる。
\[ \underbrace{ 酸(\mathrm{mol/L}) × 酸(\mathrm{L}) }
_{ \text{ ここは量り取ってきた時点で一定の値→水があろうと関係ない }}
=
塩基(\mathrm{mol/L}) × 塩基(\mathrm{L}) \]
- したがって、三角フラスコに水滴が残っていて濃度が変わったとしても「量り取ってきたときのmol」を使えば何の問題もなく計算できる。
- これに対して、ビュレットに入っているのは「濃度がまだ分かっていない溶液」である。
\[ \underbrace{ 酸(\mathrm{mol/L}) × 酸(\mathrm{L}) }
_{ もう既に分かっている値\\(三角フラスコに入っている)}
=
\underbrace{ 塩基(\mathrm{mol/L}) }
_{ ここを知りたい\\(ビュレットに入っている) }
×
\underbrace{ 塩基(\mathrm{L}) }
_{ \text{ 滴下する量 }} \]
- 今から中和滴定をしてこの濃度を求めようとしているのにそれを薄めてしまったら中和滴定によって「薄まった後の濃度」が求まってしまうことになる。
\[ \underbrace{ 酸(\mathrm{mol/L}) × 酸(\mathrm{L}) }
_{ 標準溶液の方は一定 }
=
\underbrace{ 塩基(\mathrm{mol/L}) }
_{ ここが知りたいのに、ここが変わってしまうと… }
× 塩基(\mathrm{L}) \\
\ \\
\Downarrow\
\ \\
\underbrace{ 酸(\mathrm{mol/L}) × 酸(\mathrm{L}) }
_{ 標準溶液の方は一定 }
=
\underbrace{ 塩基(\mathrm{mol/L}) × 塩基(\mathrm{L}) }
_{ 勿論滴定はできるが薄まった分の滴下量も増えて結果的に薄まった後の濃度が求まる→意味ない! } \]
- 求めたい濃度を変えてしまったら何の意味もないので、ビュレットは必ず共洗いが必要となる。
三角フラスコを共洗いしない理由
- 三角フラスコを共洗いするとどうなるの考える。

- 三角フラスコを共洗いすると、調製した標準溶液を入れる前に少量の標準溶液がフラスコ内に付着している状態になり、「mol数」が変化する。
- 上で説明したように、中和計算(【公式あり】中和計算を一瞬で解く方法を理由を交えて徹底解説!を参照)の式は「mol数」を比べる式なので、mol数が変化すると計算にずれが生じてしまう。したがって、三角フラスコは共洗いをしない。