MENU
原子の大きさ(比較・クーロン力や周期表、族、周期との関係など)
目次
はじめに
【プロ講師解説】このページでは『原子の大きさ(比較・クーロン力や周期表、族、周期との関係など)』について解説しています。
原子半径とは
- 原子の原子核から電子までの距離を原子半径という。

周期表の同周期における原子半径
- 周期表の同周期(横)において、原子半径は右にいくほど小さくなる。
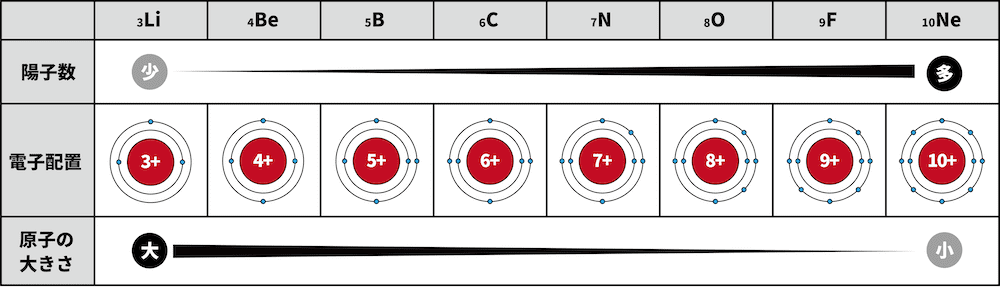
- 第2周期の原子は全て、最外殻がL殻である。
- 原子番号が増える(右にいく)につれ、陽子数が増加する。陽子数が増加するということはすなわち、原子核が電子を引きつける強さが増す、ということである。
- したがって、右の原子ほど原子核が電子を強く引きつけ、原子半径が小さくなる。
周期表の同族における原子半径
- 周期表の同族(縦)において、原子半径は下にいくほど大きくなる。
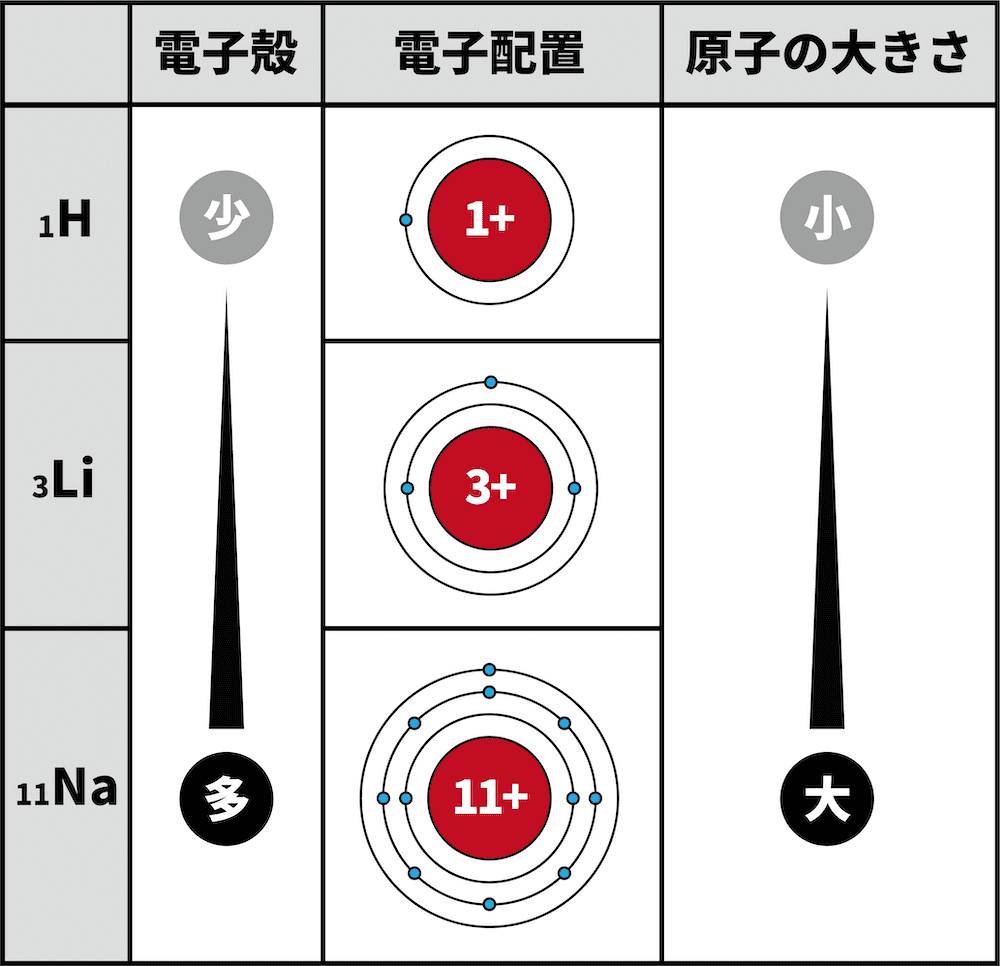
- 1族の元素について、1Hの最外殻はK殻、3Liの最外殻はL殻、11Naの最外殻はM殻である。
- 電子殻が増えるほど、原子半径は大きくなる。
- したがって、K殻までしか電子殻がない1HよりもL殻まで電子殻がある3Liの方が原子半径が大きい。同様に、L殻までしか電子殻がない3LiよりもM殻まで電子殻がある11Naの方が原子半径が大きい。
- つまり、周期表の下にいくほど電子殻が増え、原子半径が大きくなる。
有効核電荷
【よくある質問】周期表の下にいくほど電子殻が増えて原子半径が大きくなるのはイメージできます。ただ、陽子数も増えて、電子を引きつける力が強くなり、その点では原子半径が小さくなりませんか?
- ここでは、この疑問を解消するため、有効核電荷という考え方について学ぶ。
- 一族元素であるリチウムLiにおいて、K殻は閉殻状態である。
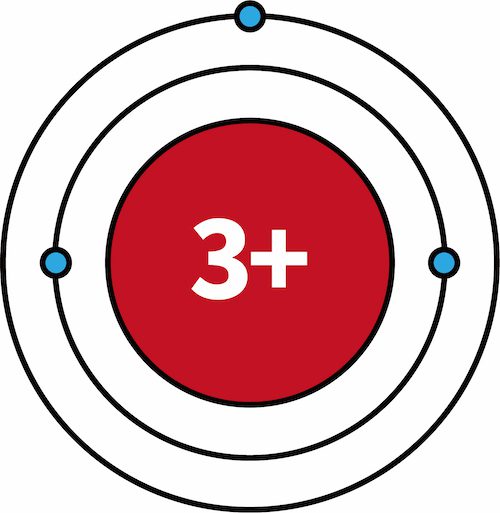
- このとき、K殻に存在する2個の電子は、原子核の正電荷+3のうち+2分を打ち消している。
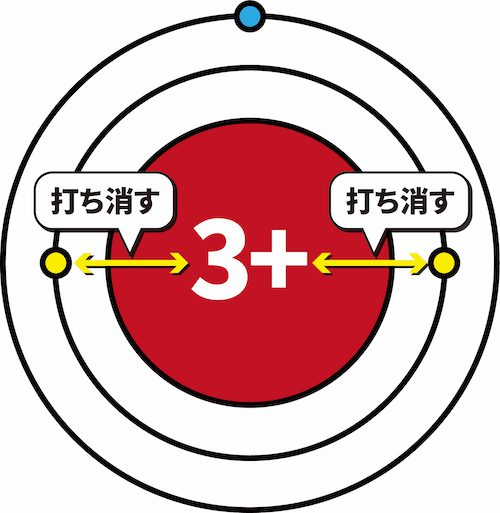
- その結果、L殻に存在する1個の最外殻電子に働く原子核の正電荷は+1となる。
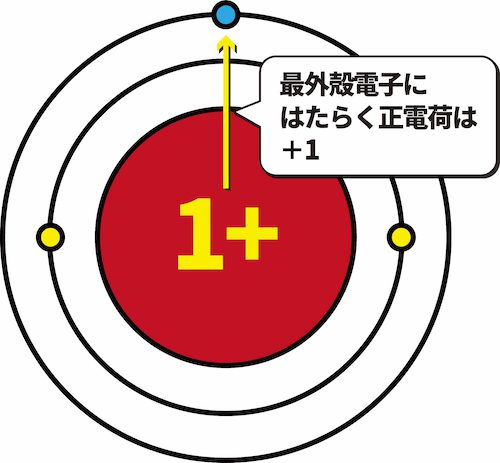
- このように、原子核の正電荷のうち、最外殻電子に実際に働くみかけ上の電荷を有効核電荷という。
- 一族元素であるLi・Na・Kの有効核電荷を比較すると、全て+1で等しい。
| リチウムLi | ナトリウムNa | |
|---|---|---|
| 電子配置 |  | 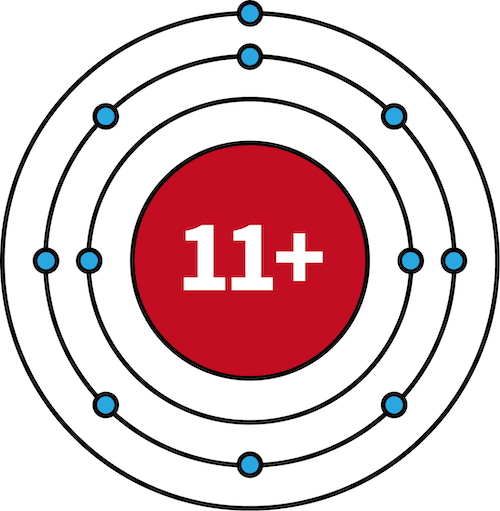 |
| 有効核電荷 | 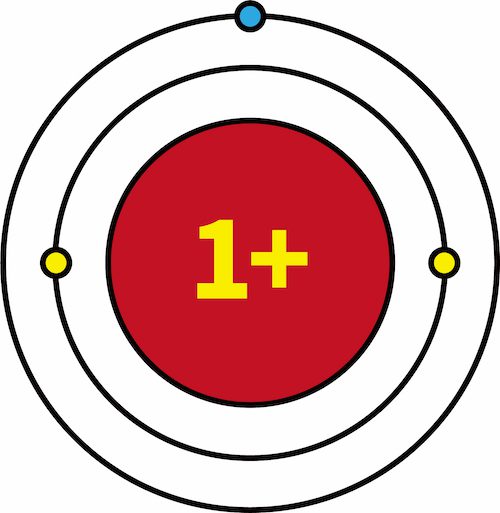 | 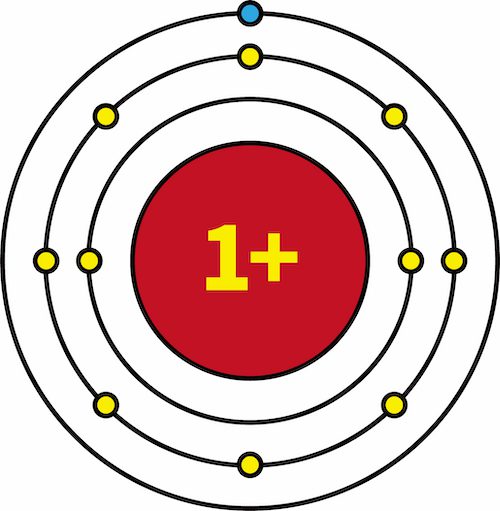 |
- したがって、陽子数に関わらず原子核から最外殻電子に働く電荷は同じであり、電子殻の数のみが原子半径の大小に影響する。
- これが、同族の原子で、下にいく(原子番号が大きくなる)にしたがって原子半径が大きくなる理由である。
原子半径まとめ
この『原子の大きさ(比較・クーロン力や周期表、族、周期との関係など)』のページで解説した内容をまとめる。
- 原子の原子核から電子までの距離を原子半径という。
- 周期表の同周期(横)において、原子半径は右にいくほど小さくなる。
- 周期表の同族(縦)において、原子半径は下にいくほど大きくなる。
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
問1
原子の原子核から電子までの距離を【1】という。
解答/解説:タップで表示
解答:【1】原子半径
原子の原子核から電子までの距離を原子半径という。
問2
周期表の同周期において、原子半径は右にいくほど【1(大き or 小さ)】くなる。
解答/解説:タップで表示
解答:【1】小さ
周期表の同周期(横)において、原子半径は右にいくほど小さくなる。

問3
周期表の同族において、原子半径は下にいくほど【1(大き or 小さ)】くなる。
解答/解説:タップで表示
解答:【1】大き
周期表の同族(縦)において、原子半径は下にいくほど大きくなる。














