MENU
【ファラデーの法則】電気量計算の公式・解き方(演習問題付き)
はじめに
【プロ講師解説】このページでは『【ファラデーの法則】電気量計算の公式・解き方(演習問題付き)』について解説しています。
ファラデーの法則
- 電極で変化するイオンの物質量(mol)は流れた電気量(C)に比例する。
- これをファラデーの法則という。
電気量・ファラデー定数
- 電気量はクーロン(C)とファラデー(F)の2つの単位で表される。
- 1Cは1アンペア(A)の電流が1秒間流れたときの電気量である。
\[ \mathrm{電気量(C) = 電流(A) × 時間(秒)} \]
- 1Fは電子1molのもつ電気量である。
\[ \mathrm{電気量(F) = 9.65 × 10^{4}(c/mol)} \]
- ちなみに、この9.65×104という数値はファラデー定数とよばれる。
電気量計算の解法

- 電気量計算は上の関係を意識すれば誰でも簡単に解くことができる。いくつか例題用いて解説していこう。
(1)
5Aの電流を3860秒間流したときに流れた電気量は何クーロン(C)か。また、そのときに流れた電子eーの物質量は何molか。
- 問題文に電流(A)と時間(秒)が書かれているので、まずはそれを使って流れた電気量(C)を求める。
\[ \mathrm{5(A)×3860(秒)=19300(C)} \]
- 次に、求めた電気量とファラデー定数を用いて流れた電子eーのmolを求める。
\[ \begin{align}
\mathrm{e^{-}(mol)}&\mathrm{=\frac{ 19300(C) }{ 9.65×10^{4}(C/mol) }}\\
&=0.2
\end{align} \]
(2)
次の反応において、9650Cの電気量を使用したときに流れた電子eーの物質量は何molか。また、そのとき析出した銅Cuの質量は何gか。ただし、Cu=64とする。
Cu2+ + 2eー → Cu
- まずは、電気量とファラデー定数を用いて流れた電子eーのmolを求める。
\[ \begin{align}
\mathrm{e^{-}(mol)}&\mathrm{=\frac{ 9650(C) }{ 9.65×10^{4}(C/mol) }}\\
&=0.1
\end{align} \]
- 次に、反応量計算を行い、銅の析出量を求める。
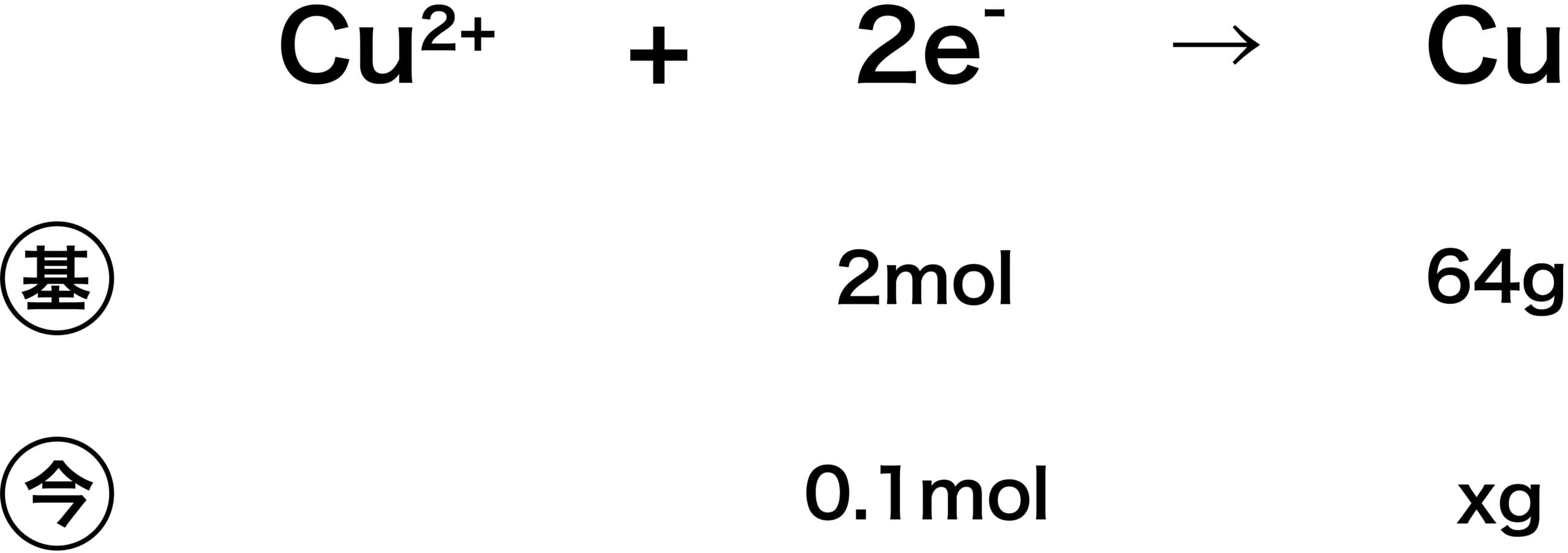
\[ \begin{align}&2:64=0.1:x\\
&\leftrightarrow x=3.2(\mathrm{g}) \end{align}\]
(3)
次の反応において、3Aの電流を1930秒流したときに発生する酸素は標準状態で何Lか。
2H2O → O2 + 4H+ + 4eー
- 問題文に電流(A)と時間(秒)が書かれているので、まずはそれを使って流れた電気量(C)を求める。
\[ \mathrm{3(A)×1930(秒)=5790(C)} \]
- 次に、求めた電気量とファラデー定数を用いて流れた電子eーのmolを求める。
\[ \begin{align}
\mathrm{e^{-}(mol)}&\mathrm{=\frac{ 5790(C) }{ 9.65×10^{4}(C/mol) }}\\
&=0.06
\end{align} \]
- 最後に、反応量計算を行い、酸素の発生量を求める。

\[ \begin{align}&22.4:4=x:0.06\\
&\leftrightarrow x=0.336(\mathrm{L}) \end{align}\]
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
電極で変化するイオンの物質量(mol)は流れた電気量(C)に比例する。これを【1】の法則という。
解答/解説:タップで表示
解答:【1】ファラデー
電極で変化するイオンの物質量(mol)は流れた電気量(C)に比例する。これをファラデーの法則という。
1Cは1Aの電流が1【1】間流れたときの電気量である。
解答/解説:タップで表示
解答:【1】秒
電気量はクーロン(C)とファラデー(F)の2つの単位で表される。
1Cは1アンペア(A)の電流が1秒間流れたときの電気量である。
\[ \mathrm{電気量(C) = 電流(A) × 時間(秒) }\]
1【1】は電子1molのもつ電気量である。
解答/解説:タップで表示
解答:【1】ファラデー(F)
1Fは電子1molのもつ電気量である。
\[ \mathrm{電気量(F) = 9.65 × 10^{4}(C/mol)} \]
ちなみに、この9.65×104という数値はファラデー定数とよばれる。
5Aの電流を3860秒間流したときに流れた電気量は【1】Cである。
解答/解説:タップで表示
解答:【1】19300
問題文に電流(A)と時間(秒)が書かれているため、まずはそれを使って流れた電気量(C)を求める。
\[ \mathrm{5(A)×3860(秒)=19300(C)} \]
問4のときに流れた電子eーの物質量は【1】molである。
解答/解説:タップで表示
解答:【1】0.2
問4で求めた電気量と、ファラデー定数を用いて流れた電子eーのmolを求める。
\[ \begin{align}
\mathrm{e^{-}(mol)}&\mathrm{=\frac{ 19300(C) }{ 9.65×10^{4}(C/mol) }}\\
&=0.2
\end{align} \]
次の反応において、9650Cの電気量を使用したときに流れた電子eーの物質量は何molか。
Cu2+ + 2eー → Cu
解答/解説:タップで表示
解答:0.1
電気量とファラデー定数を用いて流れた電子eーのmolを求める。
\[ \begin{align}
\mathrm{e^{-}(mol)}&\mathrm{=\frac{ 9650(C) }{ 9.65×10^{4}(C/mol) }}\\
&=0.1
\end{align} \]
問6のときに析出した銅Cuの質量は何gか。ただし、Cu=64とする。
解答/解説:タップで表示
解答:3.2g
反応量計算を行い、銅の析出量を求める。
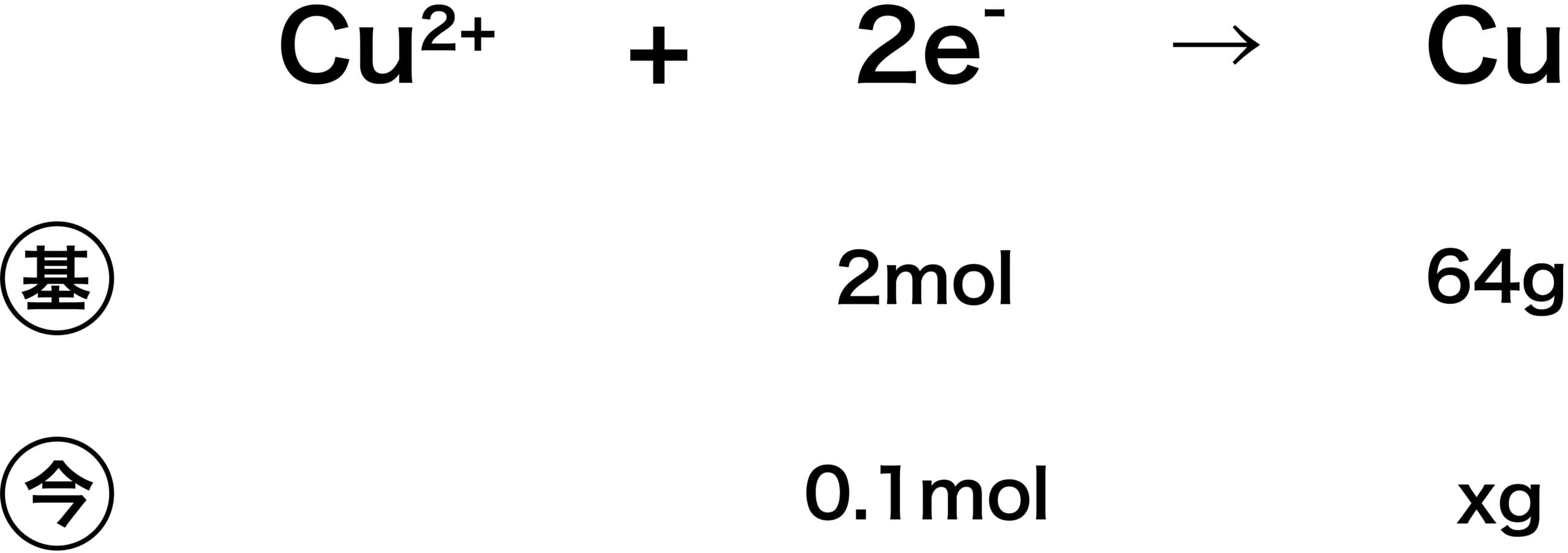
\[ \begin{align}2:64=0.1:x\\
\leftrightarrow x=3.2(\mathrm{g})\end{align} \]
次の反応において、3Aの電流を1930秒流したときに発生する酸素は標準状態で何Lか。
2H2O → O2 + 4H+ + 4eー
解答/解説:タップで表示
解答:0.336L
問題文に電流(A)と時間(秒)が書かれているので、まずはそれを使って流れた電気量(C)を求める。
\[ \mathrm{3(A)×1930(秒)=5790(C)} \]
次に、求めた電気量とファラデー定数を用いて流れた電子eーのmolを求める。
\[ \begin{align}
\mathrm{e^{-}(mol)}&\mathrm{=\frac{ 5790(C) }{ 9.65×10^{4}(C/mol) }}\\
&=0.06
\end{align} \]
最後に、反応量計算を行い、酸素の発生量を求める。

\[ \begin{align}&22.4:4=x:0.06\\
&\leftrightarrow x=0.336(\mathrm{L}) \end{align}\]