MENU
活性化エネルギーと反応熱
はじめに
【プロ講師解説】このページでは『活性化エネルギーと反応熱』について解説しています。
活性化エネルギーと反応熱
- 反応物質が反応するために必要なエネルギーを活性化エネルギーという。
- 活性化エネルギーを得て反応途中の段階にある、非常に不安定な状態を活性化状態という。
- 化学反応の進行に伴って出入りする熱(エネルギー)を反応熱という。
●活性化エネルギー
反応物質が反応するために必要なエネルギー
●活性化状態
活性化エネルギーを得て反応途中の段階にある、非常に不安定な状態
●反応熱
化学反応の進行に伴って出入りする熱(エネルギー)
水素とヨウ素の反応
- 水素H2とヨウ素I2の反応は、次の化学反応式で表される。
\[ \mathrm{H_{2}+I_{2}→2HI} \]
- ただし、H2とI2を反応させても、いきなり安定なHIができるわけではない。次の2STEPで反応の流れを確認する。
●STEP1
反応物(H2・I2)に外部から活性化エネルギーが加わる。
→ 活性化状態(遷移状態)になる。
●STEP2
活性化状態からエネルギーを放出し、生成物(HI)ができる。
→ 活性化状態(遷移状態)になる。
まずは、反応物(H2・I2)に外部から活性化エネルギーが加わる。その結果、活性化状態(遷移状態)になる。

活性化状態は、H2とI2が反応してHIになりかけてはいるけれども、エネルギー状態が高く非常に不安定である。
次に、活性化状態からエネルギーを放出し、生成物(HI)ができる。
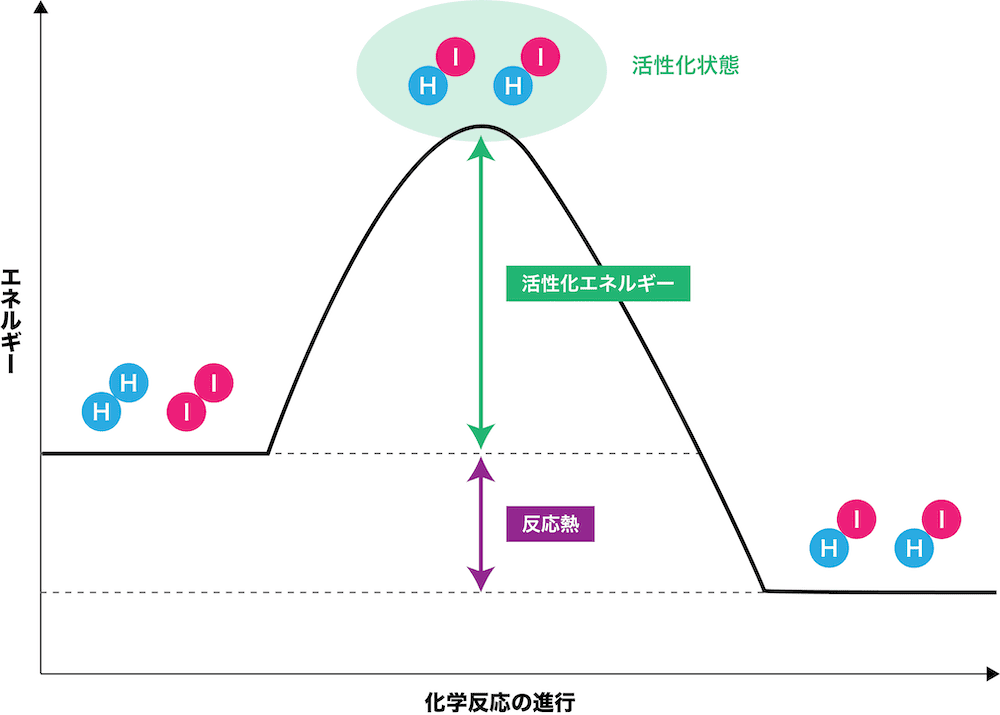
このとき、最初のH2・I2のエネルギーと、安定したHIのエネルギーの差を反応熱という。
活性化エネルギーと反応速度
- 活性化エネルギーと反応速度の関係について解説する。
活性化エネルギー(大)→反応速度(小)
活性化エネルギー(小)→反応速度(大)
活性化エネルギーが大きい場合
- 活性化エネルギーは「反応物が活性化状態になるために必要なエネルギー」である。したがって、これが大きいということは「反応物が活性化状態になるまで時間がかかる」ということになる。すると当然、反応全体にかかる時間も長くなる。

活性化エネルギーが小さい場合
- 活性化エネルギーが小さい場合、「反応物が活性化状態になるまでにかかる時間が短い」ので、反応全体にかかる時間も短くなる。
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
分子同士が衝突して化学反応が起こるとき、エネルギーの高い状態(【1】)を経由する。物質を【1】にするために必要な最低限のエネルギーを【2】という。
解答/解説:タップで表示
解答:【1】活性化状態【2】活性化エネルギー
●活性化エネルギー
反応物質が反応するために必要なエネルギー
●活性化状態
活性化エネルギーを得て反応途中の段階にある、非常に不安定な状態

活性化エネルギーが小さいほど、反応速度は【1(速 or 遅)】くなる。
解答/解説:タップで表示
解答:【1】速
活性化エネルギーが大きい場合
活性化エネルギーは「反応物が活性化状態になるために必要なエネルギー」である。したがって、これが大きいということは「反応物が活性化状態になるまで時間がかかる」ということになる。すると当然、反応全体にかかる時間も長くなる。

活性化エネルギーが小さい場合
活性化エネルギーが小さい場合、「反応物が活性化状態になるまでにかかる時間が短い」ので、反応全体にかかる時間も短くなる。

反応物のエネルギーと生成物のエネルギーの差を【1】という。
解答/解説:タップで表示
解答:【1】反応エンタルピー
反応物のエネルギーと生成物のエネルギーの差を反応エンタルピーという。














