置換反応と配向性(オルト・メタ・パラ)
目次
はじめに
【プロ講師解説】このページでは『置換反応と配向性(オルト・メタ・パラ)』について解説しています。
置換反応と配向性
- ベンゼンの一置換体C6H5Xに置換反応を行う場合、先に入っている置換基Xの種類によって、ベンゼンのどの位置で置換反応が起こりやすいかが変化する。
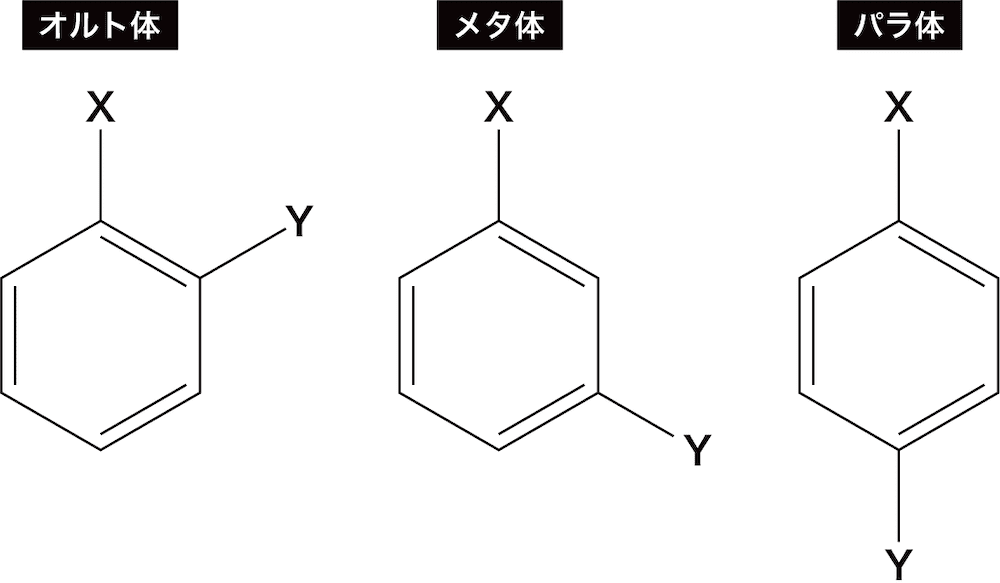
- ベンゼンの二置換体には、オルト・メタ・パラの位置が置換された3つの構造異性体がある。

- 新たな置換基Yがベンゼンの2位or6位に付くとオルト体、3位or5位に付くとメタ体、4位につくとパラ体となる。
オルト-パラ配向性の置換基
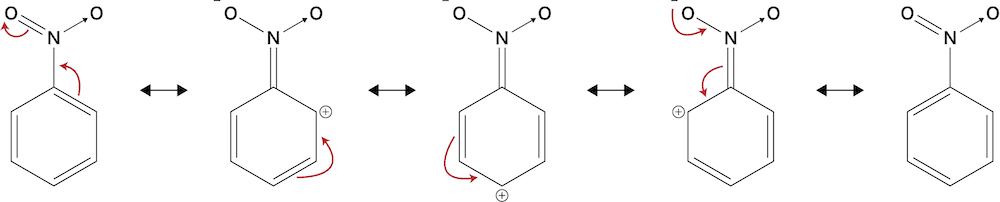
- -OH、-NH2、-CH3などの置換基は、ベンゼン環に電子を与える電子供与性という性質をもつ。
- 与えた電子がベンゼン環に流れ込み、次のような一連の流れをみせる。

- 置換基は電子密度が高くなっている部分=電荷がマイナスの部分に付きやすいので、この場合オルト位、もしくはパラ位に置換基が付くことが予想される(オルト-パラ配向性)。
各置換基が電子供与基としてはたらくのは、-OH、-NH2では非共有電子対、-CH3ではC-H結合の共有電子対の一部が、ベンゼン環に流れ込むためです。
メタ配向性の置換基
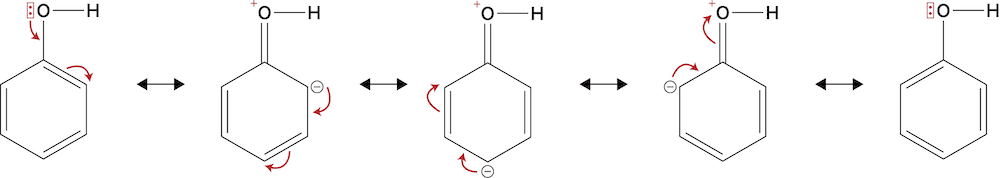
- -NO2、-COOHなどの置換基は、ベンゼン環の電子を引きつける電子吸引性という性質がある。
- 電子を吸引した結果、次のような一連の流れがみられる。

- 繰り返すが、置換基は電子密度が高くなっている部分=電荷がマイナスの部分に付きやすいので、この場合オルト位、パラ位の電子密度が低くなっているので、相対的に電子密度の高いメタ位に置換基が付くことが予想される(メタ配向性)。
各置換基が電子吸引基としてはたらくのは、-NO2、-COOHの中でベンゼン環に直接結合している窒素N原子や炭素C原子が(より電気陰性度の高い酸素O原子の影響で)正の電荷をもち、これがベンゼン環の電子を引き寄せるためです。
高校化学・化学基礎の計算問題が苦手な人に向けた計算ドリルを発売しました。豊富な問題数で、入試頻出の計算問題の解き方を身につけることができます。

無機化学の知識を総ざらいできるオリジナル問題集ができました。解答・解説編には入試頻出事項が一通りまとめられており、まとめノート/参考書としての役割も果たします。

有機化学に関する入試頻出事項を演習することのできるオリジナル問題集が紙の本になりました。暗記項目だけではなく、計算問題や思考力が問われる問題についても触れています。

元講師、薬剤師、イラストレーター
数百名の中高生向け指導経験あり(過去生徒合格実績:東工大・東北大・筑波大・千葉大・岡山大・早稲田大・慶應義塾大・東京理科大・上智大・明治大など)。
2014年よりwebメディア『化学のグルメ』を運営
公式オンラインストアで販売中の理論化学ドリルシリーズ・有機化学ドリル等を執筆