MENU
反応速度が変化する要因
目次
はじめに
【プロ講師解説】このページでは『反応速度が変化する要因』について解説しています。
3つの要因
- 反応速度に影響を与える要因は主に『濃度/温度/触媒』の3つである。
濃度
濃度を大きくする
→分子同士の衝突回数が増える
→反応速度増加
- 化学反応が起こるには、分子同士が衝突する必要がある。
- 濃度を大きくすると分子同士の衝突回数が増えるので、反応速度も大きくなる。
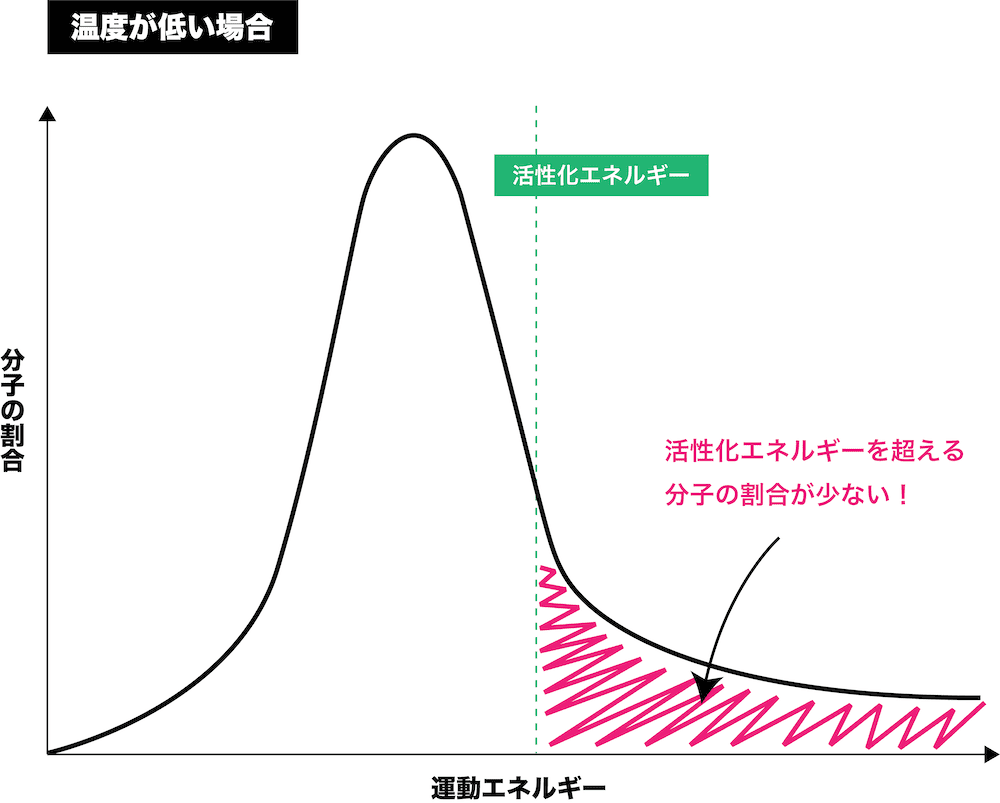
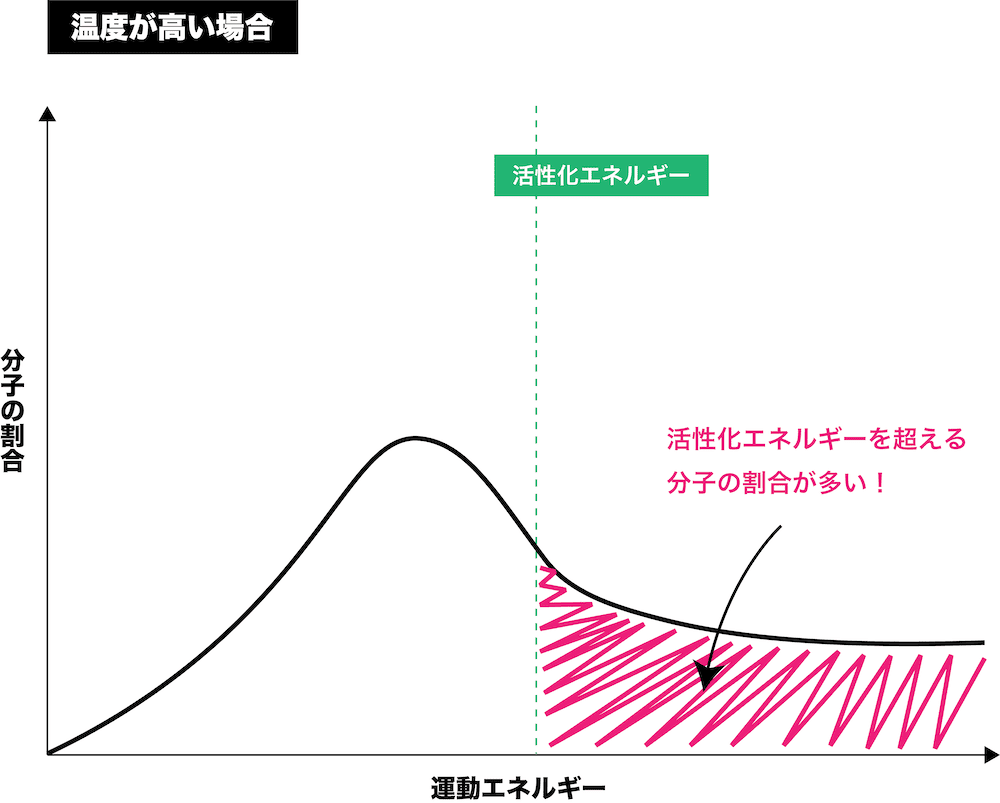
温度
温度を大きくする
→ 運動エネルギーの大きな分子(活性化エネルギー以上のエネルギーをもつ分子)が増える
→ 反応速度増加
- 温度が上昇することで、運動エネルギーの大きな分子の割合が増加する。
- 「運動エネルギーの大きな分子の割合が増加する」=「活性化エネルギー以上のエネルギーをもつ分子の割合が増加する」と考えることができるので、温度が上昇すると反応速度は大きくなる。
参考:活性化エネルギーと反応熱
触媒
触媒を加える
→ 活性化エネルギーdown
→ 反応速度増加
- 触媒を加えると、活性化エネルギーが低下する。
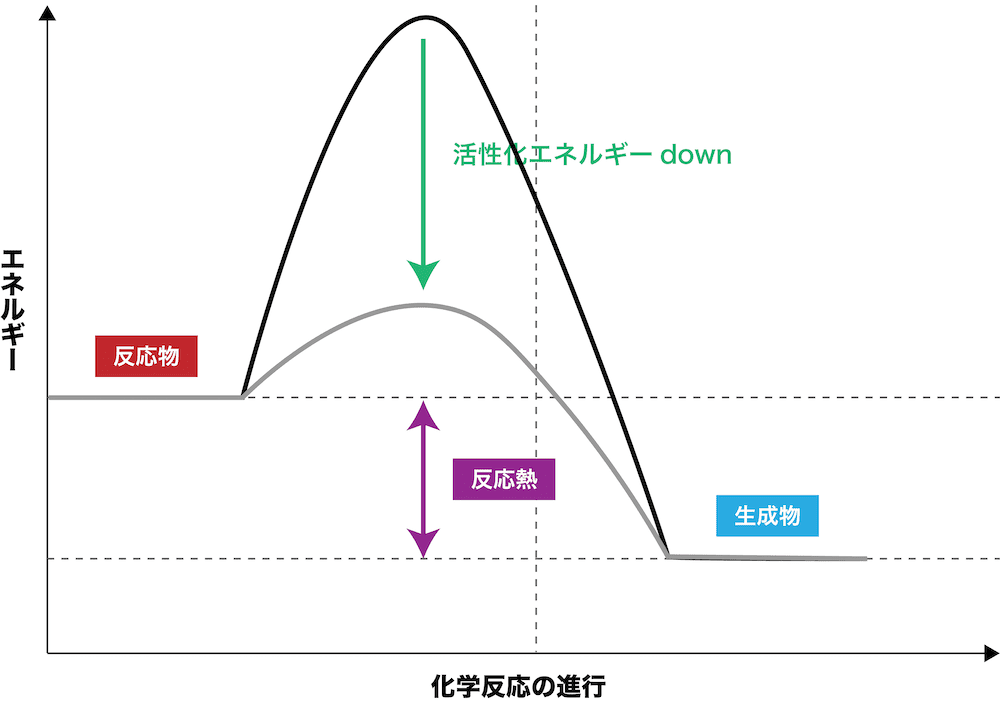
- 活性化エネルギーは、「反応が進行するためにはこれ以上のエネルギーにならなくては」というエネルギーなので、これが低下すると反応が簡単に進行することになる。したがって、触媒を加えて活性化エネルギーが低下すると、反応速度は増加する。
- また、触媒を加えても「反応熱」は変わらない。これは、(反応熱=反応物と生成物のエネルギー差なので)反応物と生成物のエネルギーが変化していないことを考えると当然である。
参考:活性化エネルギーと反応熱














