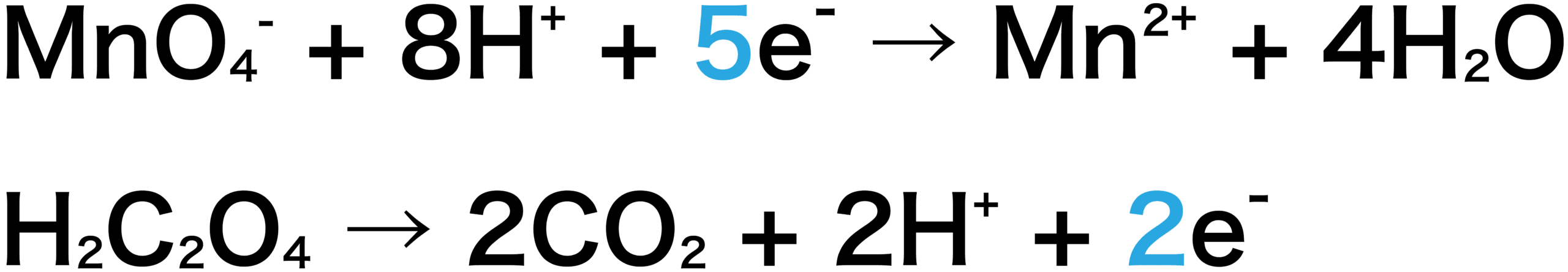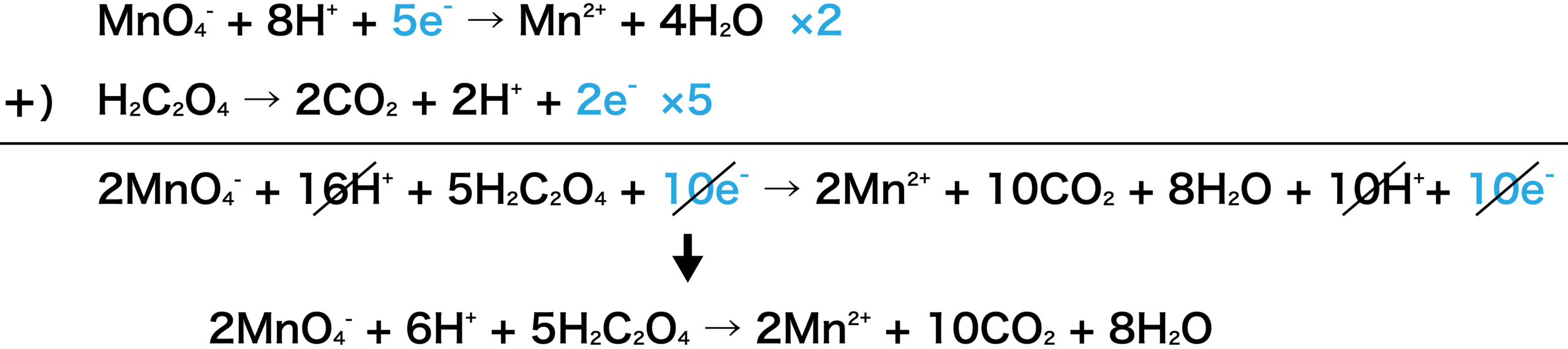MENU
酸化還元滴定(実験・計算問題・指示薬・硫酸酸性にする理由など)
はじめに
【プロ講師解説】このページでは『酸化還元滴定(実験・計算問題・指示薬・硫酸酸性にする理由など)』について解説しています。
酸化還元滴定の流れ
- ここに、濃度未知の還元剤であるシュウ酸H2C2O4(無色)が入った容器があるとする(シュウ酸は電離した状態で記載)。

- この容器に、既に濃度が分かっている酸化剤である過マンガン酸カリウムKMnO4(赤色)を滴下していく。
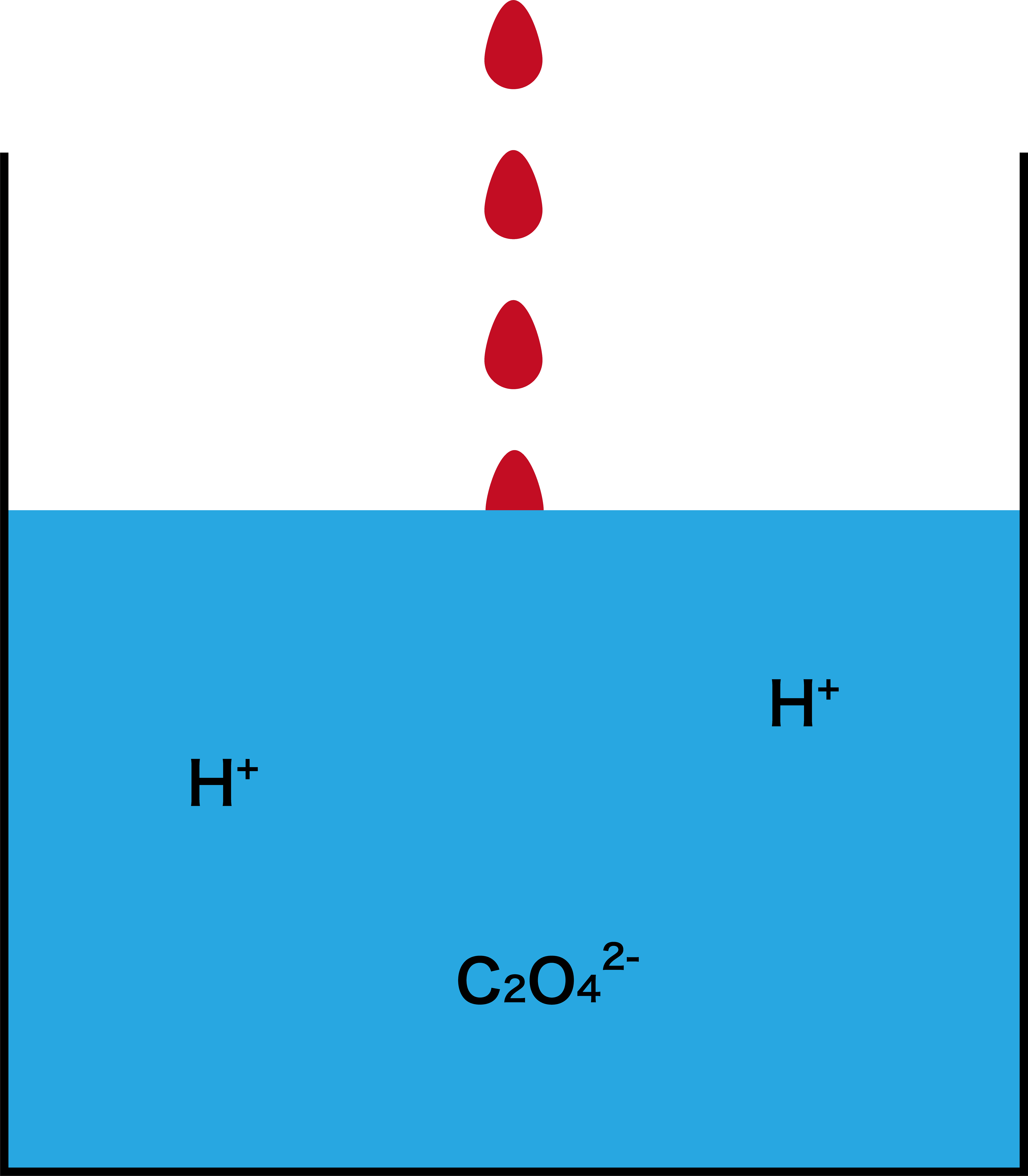
- はじめのうちは、赤色の過マンガン酸カリウムKMnO4を入れてもシュウ酸H2C2O4と酸化還元反応を起こし、すぐに無色となる。しかし、滴定を続けていくと、次のようになる。
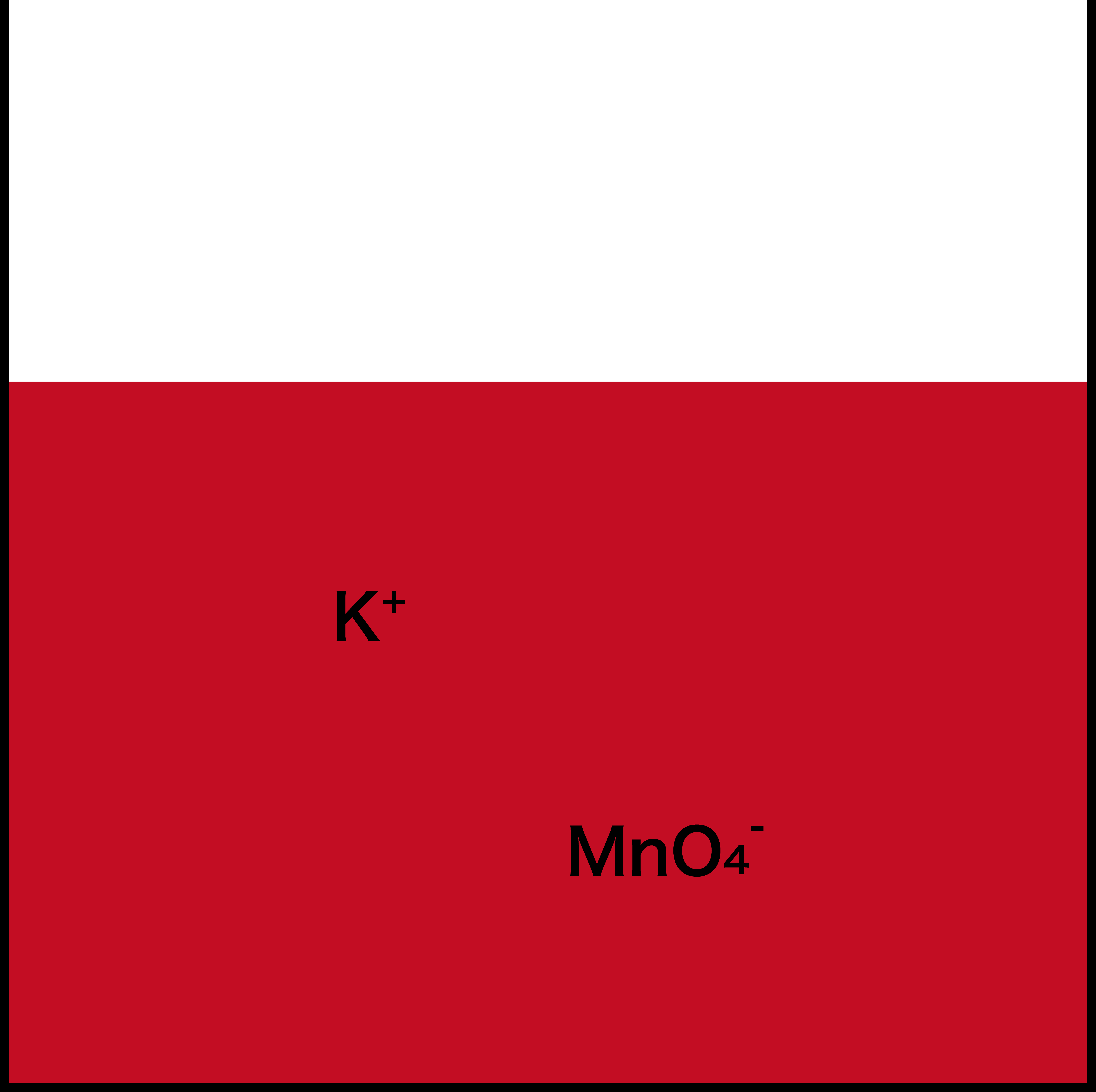
- あるとき急に赤色が消えなくなる。これは、シュウ酸H2C2O4を使い切ってこれ以上酸化還元反応が起こらなくなり、その結果、過マンガン酸カリウムKMnO4の赤色(正確にはKMnO4に含まれるイオンであるMnO4ーの色)が残っているという原理である。
- KMnO4を使った酸化還元滴定では、この色が消えなくなるタイミングを滴定の終点とし、そこまでに滴下したKMnO4の量を用いて濃度未知の溶液(H2C2O4など)の濃度を求める。
過マンガン酸カリウムを使った酸化還元滴定で指示薬を用いない理由
- 過マンガン酸カリウムKMnO4を使った酸化還元滴定では、指示薬を使用しない。
- これは、過マンガン酸カリウムに含まれるイオンにより、色の変化が起きるためである。メチルオレンジやフェノールフタレインなどの指示薬を使う中和滴定とは異なる、過マンガン酸カリウムを使った酸化還元滴定の特徴なので、よく覚えておこう。
過マンガン酸カリウムを使った酸化還元滴定の計算問題
- 過マンガン酸カリウムKMnO4を使った酸化還元滴定の計算問題の解き方について、例題を用いて解説する。
硫酸酸性で濃度未知のシュウ酸水溶液500(ml)に0.50(mol/L)の過マンガン酸カリウム水溶液を滴下していく。200(ml)滴下したところで、色が赤紫色から変化しなくなった。このときのシュウ酸水溶液の濃度(mol/L)を求めよ。
- この計算問題は、次の2STEPを用いて解く。
●STEP1
2つの半反応式から反応式を作成する。
●STEP2
「酸化剤が受け取るeー(mol)= 還元剤が放出するeー(mol)」を利用し、未知の濃度を求める。
酸化還元反応では、還元剤の出した電子eーを酸化剤がそのまま受け取るので、次の式が成り立つ。
\[ \mathrm{酸化剤が受け取るe^{ー}(mol)= 還元剤が放出するe^{ー}(mol)} \]
したがって、今回の場合、次の式をつくることができる。
\[ \begin{align}
&\underbrace{ \mathrm{0.50(mol/L) × \frac{ 200 }{ 1000 }(L)} }
_{ \mathrm{KMnO_{4}\text{ のmol }}}
× 5
=
\underbrace{ x\mathrm{(mol/L)} × \frac{ 500 }{ 1000 }(L) }
_{ \mathrm{H_{2}C_{2}O_{4}\text{ のmol }}}
× 2 \\
\\
&↔︎ x\mathrm{=0.50(mol/L)}
\end{align}\]
KMnO4とH2C2O4の半反応式より、KMnO41molが受け取るeーは5mol、H2C2O41molから出るeーは2molなので、左辺に5、右辺に2をかけていることに注意しよう。
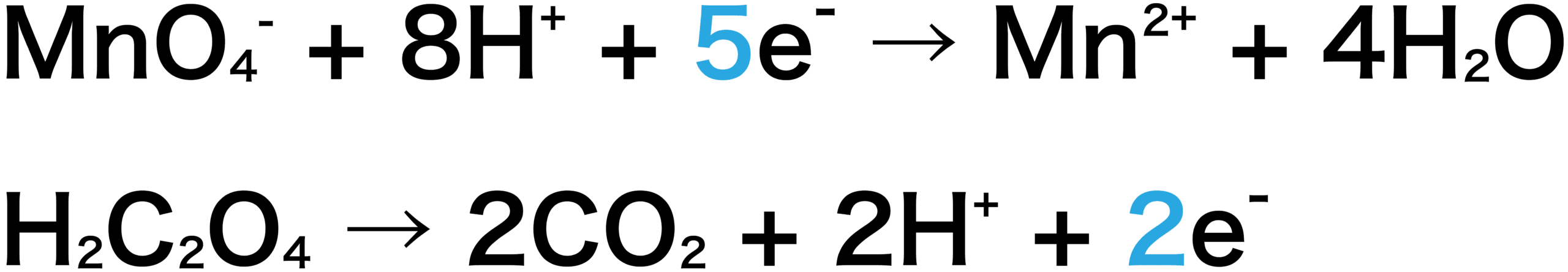
酸化還元滴定のポイント
- ここからは、酸化還元滴定でつまづきやすいポイントについて解説していく。
過マンガン酸カリウムを使った酸化還元滴定を「酸性下」で行う理由
- 過マンガン酸カリウムの半反応式は、溶液の液性を酸性・中性・塩基性のどれにするかで変わる。
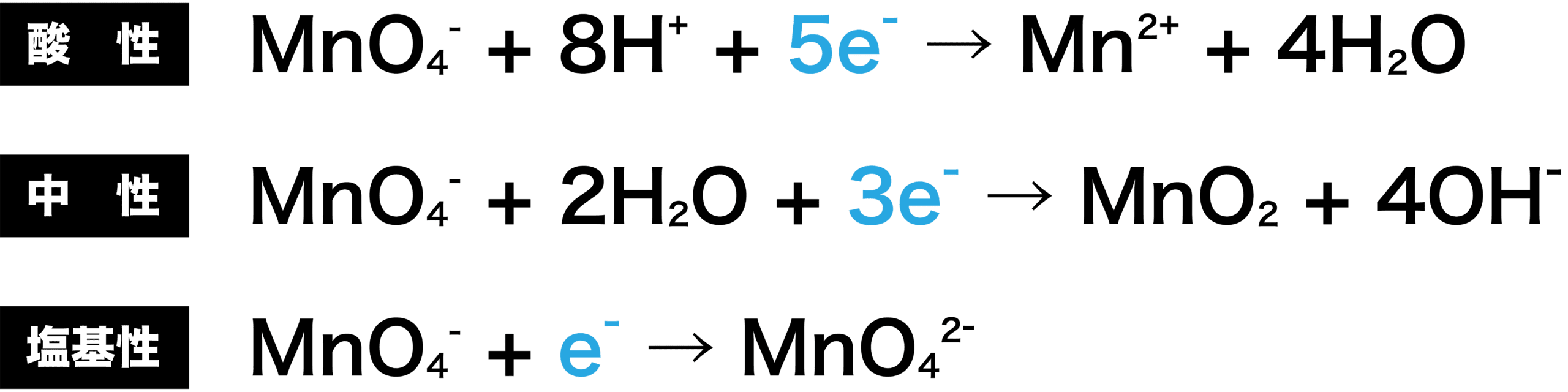
- これらの反応式を比較すると、酸性のときに最も多くの電子eーを受け取っていることがわかる。多くのeーを受け取るということはつまり「酸化剤として優秀」ということなので、過マンガン酸カリウムは酸性下で用いられる。
溶液を酸性にする際、硫酸を使用する理由
- 酸化還元滴定の問題では、必ずと言っていいほど「硫酸酸性下で実験を…」との記載が書かれている。溶液を酸性にする理由は上で述べた通りだが、「なぜ毎回”硫酸H2SO4“を用いるのか」について疑問に思う人も多いはず。
- まず、酸として有名な塩酸HClは還元剤である。
\[ \mathrm{Cl^{ー}→Cl_{2}} \]
- また、硝酸HNO3は酸化剤である。
\[ \begin{align}
【希硝酸】\mathrm{HNO_{3}→NO}\\
【濃硝酸】\mathrm{HNO_{3}→NO_{2}}\end{align} \]
- このように、多くの酸は酸化剤又は還元剤としてはたらく。これに対して硫酸H2SO4は、酸化剤にも還元剤にもならないため、単にH+を供給し酸化還元反応を促進するためだけに働いてくれる。これが、酸化還元滴定で硫酸H2SO4を用いる理由である。
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
硫酸酸性で濃度未知のシュウ酸水溶液500(ml)に0.50(mol/L)の過マンガン酸カリウム水溶液を滴下していく。200(ml)滴下したところで、色が赤紫色から変化しなくなった。このときのシュウ酸水溶液の濃度(mol/L)を求めよ(有効数字2桁で解答)。
解答/解説:タップで表示
解答:0.50mol/L
●STEP1
2つの半反応式から反応式を作成する。
●STEP2
「酸化剤が受け取るeー(mol)= 還元剤が放出するeー(mol)」を利用し、未知の濃度を求める。
酸化還元反応では、還元剤の出した電子eーを酸化剤がそのまま受け取るので、次の式が成り立つ。
\[ \mathrm{酸化剤が受け取るe^{ー}(mol)= 還元剤が放出するe^{ー}(mol) }\]
したがって、今回の場合、次の式をつくることができる。
\[ \underbrace{ 0.50\mathrm{(\mathrm{mol/L})} × \frac{ 200 }{ 1000 }\mathrm{(L)} }
_{ \mathrm{KMnO_{4}}\text{ のmol }}
× 5
=
\underbrace{ x(\mathrm{mol/L}) × \frac{ 500 }{ 1000 }(\mathrm{L}) }
_{ \mathrm{H_{2}C_{2}O_{4}}\text{ のmol }}
× 2 \\
↔︎ x=0.50(\mathrm{mol/L}) \]
KMnO4とH2C2O4の半反応式より、KMnO41molが受け取るeーは5mol、H2C2O41molから出るeーは2molなので、左辺に5、右辺に2をかけていることに注意しよう。