MENU
【モル計算】単位を駆使!物質量molが絡む問題の解法(原子量・体積・アボガドロ数など)
はじめに
【プロ講師解説】このページでは『【モル計算】単位を駆使!物質量molが絡む問題の解法(原子量・体積・アボガドロ数など)』について解説しています。
物質量(mol)とは
- 物質量は「単位」の1つである。つまり、「長さ」や「重さ」と同じ類のものだということ。「長さ」を「m」、重さを「g」で表すように、物質量は「mol」で表す。
- 鉛筆を12本集めたものを…1″ダース”という。

- これと同様の考え方で、粒子(原子・分子など)を6.0×1023個集めたカタマリを…1″mol”という。
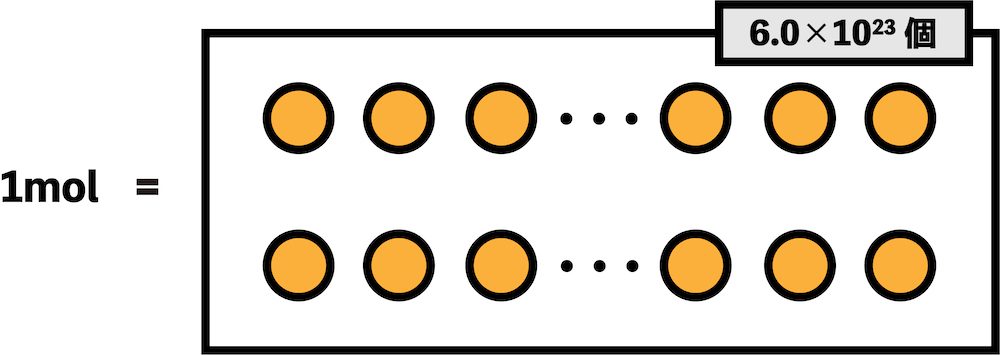
- ちなみに、6.0×1023個という数はどんな粒子でも同じである。
以上が物質量(mol)に関する簡単な説明です。特別なものではなく、単位の一種に過ぎないということが理解できれば問題ありません。これ以降、物質量に関連した単位をいくつか紹介した後、具体的なモル計算問題の解法について説明していきます。
アボガドロ定数(個数に関係したもの)
- 6.0×1023個は1molに含まれる粒子の個数である。
- 単位をつけると6.0×1023個/molとなり、これをアボガドロ定数という。
- アボガドロ定数は記号NAで表す。
\[ \mathrm{アボガドロ定数N_{A}=6.0×10^{23} (個/mol) } \]
※ここではイメージしやすくするために単位に「個」をつけているが、本来アボガドロ定数の単位は「/mol」である。計算をするときは「個/mol」で覚えていた方が扱いやすいが、一応把握しておこう。
※molの前に省略されている「1」を補うとさらにイメージしやすいかも。
\[ \mathrm{6.0×10^{23} (個/1mol)} \]
モル質量(質量に関係したもの)
- 粒子1molあたりの質量をモル質量という。
- モル質量は原子量(分子量・式量)と一致し、単位「g/mol」をつけて表す。
\[ \mathrm{モル質量(g/mol)} \]
モル体積(体積に関係したもの)
- 全ての気体は「標準状態(0℃、1気圧)で1molあたり22.4Lの体積を占める」ことが知られている。
- 「1molあたりのL」を単位で表すと「L/mol」となるので、「1molあたり22.4Lの体積を占める」というのを単位をつけて表すと、「22.4(L/mol)」となる。
\[ \mathrm{22.4(L/mol)} \]
気体の密度と分子量
- 気体の密度は通常1Lあたりの質量(g/L)で表す。
- これに22.4(L/mol)をかけると、22.4Lあたりの質量、つまり、1molあたりの質量(モル質量)になる。
\[ \mathrm{気体の密度(g/L) × 22.4(L/mol) = モル質量(g/mol)} \]
molとgの計算
- molとgに関する計算をするときにポイントとなるのは「モル質量」である。
- 先述の通り、モル質量は原子量(分子量・式量)の値と一致し、単位はg/molである。
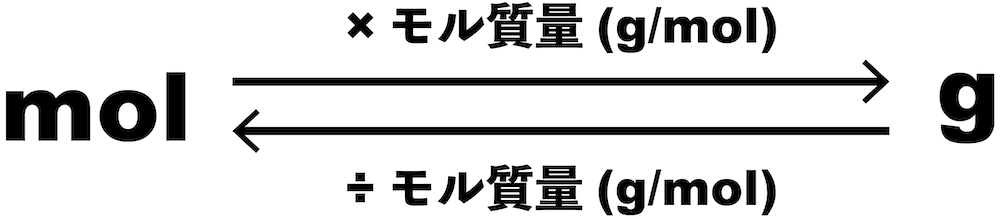
mol→g
- molからgを求めるときは、molにモル質量(g/mol)をかける。
- すると、molが約分され、gを得ることができる。
\[ \mathrm{\cancel{mol} \times \frac{ g }{ \cancel{mol} } = g} \]
2.0molのH2Oは何gか。(H=1、O=16、有効数字2桁で解答)
- molとモル質量がわかっているので、これらをかけあわせる。
\[ \mathrm{2.0(\cancel{mol}) \times 18(g/\cancel{mol}) = 36(g)} \]
g→mol
- gからmolを求めるときは、gをモル質量(g/mol)で割る。
- すると、gが約分され、molを求めることができる。
\[ \begin{align}
&\mathrm{g \div \frac{ g }{ mol }} \\
&\mathrm{= \cancel{g} \times \frac{ mol }{ \cancel{g} }} \\
&\mathrm{= mol}
\end{align} \]
44gのCO2は何molか。(C=12、O=16、有効数字2桁で解答)
- gをモル質量(g/mol)で割ると、
\[ \begin{align}
&\mathrm{44(g) \div 44(g/mol) }\\
&\mathrm{= 44(\cancel{ g }) \times \frac{ 1 }{ 44 }(mol/\cancel{ g })} \\
&\mathrm{= 1.0(mol)}
\end{align} \]
molとLの計算
- 先述の通り、標準状態(0℃・1気圧)で、すべての気体は1molあたり22.4Lの体積を占める。これがmolとLに関する計算をするときのポイントである。
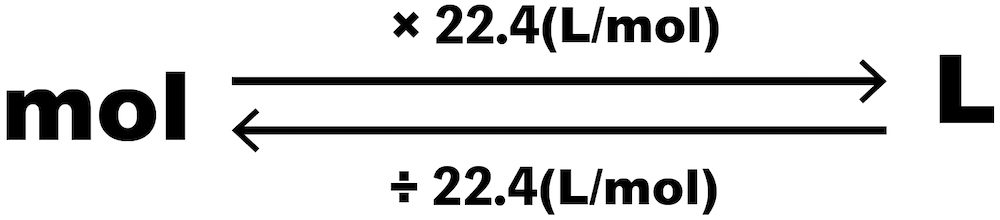
mol→L
- molからLを求めるときは、molに22.4(L/mol)をかける。
- すると、molが約分され、Lを得ることができる。
\[ \mathrm{\cancel{mol} \times \frac{ L }{ \cancel{mol} } = L} \]
0.50molのアルゴンは標準状態で何Lか。(有効数字3桁で解答)
- 標準状態でmolがわかっているので…
\[ \mathrm{0.50(\cancel{mol}) \times 22.4(L/\cancel{mol}) = 11.2(L)} \]
L→mol
- Lからmolを求めるときは、Lを22.4(L/mol)で割る。
- すると、Lが約分され、molを求めることができる。
\[ \begin{align}
&\mathrm{L \div \frac{ L }{ mol } } \\
&\mathrm{= \cancel{L} \times \frac{ mol }{ \cancel{L} } }\\
&\mathrm{= mol}
\end{align} \]
標準状態で2.24LのCO2は何molか。(有効数字2桁で解答)
- Lを22.4(L/mol)で割ると…
\[ \begin{align}
&\mathrm{2.24(L) \div 22.4(L/mol)} \\
&\mathrm{= 2.24(\cancel{ L }) \times \frac{ 1 }{ 22.4 }(mol/\cancel{ L })} \\
&\mathrm{= 0.10(mol)}
\end{align} \]
molと個数の計算
- 先述の通り、1molには6.0×1023個の粒子が含まれる。これがmolと個数に関する計算をするときのポイントである。
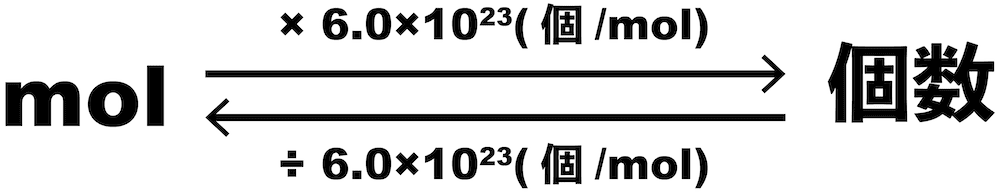
mol→個数
- molから個数を求めるときは、molに6.0×1023(個/mol)をかける。
- すると、molが約分され、個数を得ることができる。
\[ \mathrm{\cancel{mol} \times \frac{ 個 }{ \cancel{mol} } = 個} \]
0.50molのアルゴンは何個か。(有効数字2桁で解答)
- 個数がわかっているため…
\[ \mathrm{0.50(\cancel{mol}) \times 6.0×10^{23}(個/\cancel{mol}) = 3.0×10^{23}(個)} \]
個数→mol
- 個数からmolを求めるときは、個数を6.0×1023(個/mol)で割る。
- すると、個数が約分され、molを求めることができる。
\[ \begin{align}
&\mathrm{個 \div \frac{ 個 }{ mol } } \\
&\mathrm{= \cancel{個} \times \frac{ mol }{ \cancel{個} } }\\
&\mathrm{= mol}
\end{align} \]
1.2×1023個のO2は何molか。(有効数字2桁で解答)
- 個数を6.0×1023(個/mol)で割ると…
\[ \begin{align}
&\mathrm{1.2×10^{23}(個) \div 6.0×10^{23}(個/mol) }\\
&\mathrm{= 1.2×10^{23}(\cancel{ 個 }) \times \frac{ 1 }{ 6.0×10^{23} }(mol/\cancel{ 個 }) }\\
&\mathrm{= 0.20(mol)}
\end{align} \]
gとLの変換
- ここからは、molを利用した応用的な単位変換計算を紹介する。
- まずは、gとLの変換である。

g→L
- g→Lの変換は「gをmolに変換し、そのmolをLに変換する」という方法で行う。
3.2gのO2は標準状態で何Lか。(O=16、有効数字3桁で解答)
- まずは、gをモル質量(g/mol)で割ることで、molを求める。
\[ \begin{align}
&\mathrm{3.2(g) \div 32(g/mol)} \\
&\mathrm{= 3.2(\cancel{ g }) \times \frac{ 1 }{ 32 }(mol/\cancel{ g }) }\\
&\mathrm{= 0.10(mol) }
\end{align}\]
- 次に、今求めたmolに22.4(L/mol)をかけることで、Lを求める。
\[ \mathrm{0.100(\cancel{mol}) \times 22.4(L/\cancel{mol}) = 2.24(L) }\]
L→g
- L→gの変換は「Lをmolに変換し、そのmolをgに変換する」という方法で行う。
11.2LのH2は何gか。(H=1、有効数字2桁で解答)
- まずは、Lを22.4(L/mol)で割ることで、molを求める。
\[ \begin{align}
&\mathrm{11.2(L) \div 22.4(L/mol)} \\
&\mathrm{= 11.2(\cancel{ L }) \times \frac{ 1 }{ 22.4 }(mol/\cancel{ L }) }\\
&\mathrm{= 0.500(mol)}
\end{align} \]
- 次に、今求めたmolにモル質量(g/mol)をかけることで、gを求める。
\[ \mathrm{0.500(\cancel{mol}) \times 2(g/\cancel{mol}) = 1.0(g)} \]
gと個数の変換
- 次はgと個数の変換である。
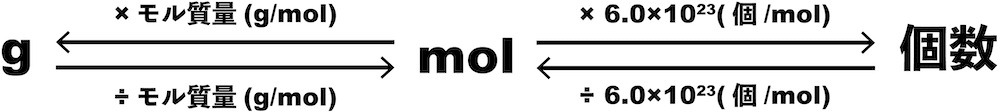
g→個数
- g→個数の変換は「gをmolに変換し、そのmolを個数に変換する」という方法で行う。
8.8gのCO2は何個か。(C=12、O=16、有効数字2桁で解答)
- まずは、gをモル質量(g/mol)で割ることで、molを求める。
\[ \begin{align}
&\mathrm{8.8(g) \div 44(g/mol)} \\
&\mathrm{= 8.8(\cancel{ g }) \times \frac{ 1 }{ 44 }(mol/\cancel{ g }) }\\
&\mathrm{= 0.20(mol) }
\end{align}\]
- 次に、今求めたmolに6.0×1023(個/mol)をかけることで、個数を求める。
\[ \mathrm{0.20(\cancel{mol}) \times 6.0×10^{23}(個/\cancel{mol}) = 1.2×10^{23}(個)} \]
個数→g
- 個数→gの変換は「個数をmolに変換し、そのmolをgに変換する」という方法で行う。
3.0×1023個のN2は何gか。(N=14、有効数字2桁で解答)
- まずは、個数を6.0×1023(個/mol)で割ることで、molを求める。
\[ \begin{align}
&\mathrm{3.0×10^{23}(個) \div 6.0×10^{23}(個/mol)} \\
&\mathrm{= 3.0×10^{23}(\cancel{ 個 }) \times \frac{ 1 }{ 6.0×10^{23} }(mol/\cancel{ 個 }) }\\
&\mathrm{= 0.50(mol)}
\end{align} \]
- 次に、今求めたmolにモル質量(g/mol)をかけることで、gを求める。
\[ \mathrm{0.50(\cancel{mol}) \times 28(g/\cancel{mol}) = 14(g) }\]
Lと個数の変換
- 最後は、Lと個数の変換である。
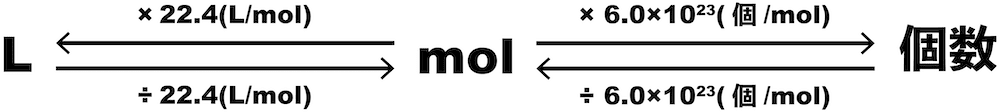
L→個数
- L→個数の変換は「Lをmolに変換し、そのmolを個数に変換する」という方法で行う。
標準状態で4.48LのO2は何個か。(有効数字2桁で解答)
- まずは、Lを22.4(L/mol)で割ることで、molを求める。
\[ \begin{align}
&\mathrm{4.48(L) \div 22.4(L/mol)} \\
&\mathrm{= 4.48(\cancel{ L }) \times \frac{ 1 }{ 22.4 }(mol/\cancel{ L }) }\\
&\mathrm{= 0.20(mol) }
\end{align}\]
- 次に、今求めたmolに6.0×1023(個/mol)をかけることで、個数を求める。
\[ \mathrm{0.20(\cancel{mol}) \times 6.0×10^{23}(個/\cancel{mol}) = 1.2×10^{23}(個) }\]
個数→L
- 個数→Lの変換は「個数をmolに変換し、そのmolをLに変換する」という方法で行う。
1.2×1024個のNO2は標準状態で何Lか。(有効数字3桁で解答)
- まずは、個数を6.0×1023(個/mol)で割ることで、molを求める。
\[ \begin{align}
&\mathrm{1.2×10^{24}(個) \div 6.0×10^{23}(個/mol) }\\
&\mathrm{= 1.2×10^{24}(\cancel{ 個 }) \times \frac{ 1 }{ 6.0×10^{23} }(mol/\cancel{ 個 }) }\\
&\mathrm{= 2.0(mol)}
\end{align} \]
- 次に、今求めたmolに22.4(L/mol)をかけることで、Lを求める。
\[ \mathrm{2.0(\cancel{mol}) \times 22.4(L/\cancel{mol}) = 44.8(L)} \]
モル計算まとめ
この『【モル計算】単位を駆使!物質量molが絡む問題の解法(原子量・体積・アボガドロ数など)』のページで解説した内容をまとめる。
- 粒子が6.0×1023個集まったカタマリを1molという。(アボガドロ定数)
- 粒子1molあたりの質量をモル質量という。
- 全ての気体は、標準状態(0℃、1気圧)で1molあたり22.4Lの体積を占める。
演習問題
H=1、C=12、O=16、アボガドロ定数:6.0×1023(/mol)、標準状態における気体の体積:22.4(L/mol)
2.0molのO2は何gか(有効数字2桁で解答)。
解答/解説:タップで表示
解答:64g
\[ \mathrm{2.0(\cancel{mol}) \times 32(g/\cancel{mol}) = 64(g)} \]
1.0molのH2は標準状態で何Lか(有効数字3桁で解答)。
解答/解説:タップで表示
解答:22.4L
\[ \mathrm{1.0(\cancel{mol}) \times 22.4(L/\cancel{mol}) = 22.4(L)} \]
3.0molのO2は何個か(有効数字2桁で解答)。
解答/解説:タップで表示
解答:1.8×1024個
\[ \mathrm{3.0(\cancel{mol}) \times 6.0×10^{23}(個/\cancel{mol}) = 1.8×10^{24}(個)} \]
1.8gのH2Oは何molか(有効数字2桁で解答)。
解答/解説:タップで表示
解答:0.10mol
\[ \begin{align}
&\mathrm{1.8(g) \div 18(g/mol) }\\
&\mathrm{= 1.8(\cancel{ g }) \times \frac{ 1 }{ 18 }(mol/\cancel{ g }) }\\
&\mathrm{= 0.10(mol)}
\end{align} \]
標準状態で4.48LのCO2は何molか(有効数字2桁で解答)。
解答/解説:タップで表示
解答:0.20mol
\[ \begin{align}
&\mathrm{4.48(L) \div 22.4(L/mol)} \\
&\mathrm{= 4.48(\cancel{ L }) \times \frac{ 1 }{ 22.4 }(mol/\cancel{ L }) }\\
&\mathrm{= 0.20(mol)}
\end{align} \]
1.2×1023個のN2は何molか(有効数字2桁で解答)。
解答/解説:タップで表示
解答:0.20mol
\[ \begin{align}
&\mathrm{1.2×10^{23}(個) \div 6.0×10^{23}(個/mol) }\\
&\mathrm{= 1.2×10^{23}(\cancel{ 個 }) \times \frac{ 1 }{ 6.0×10^{23} }(mol/\cancel{ 個 })} \\
&\mathrm{= 0.20(mol)}
\end{align} \]
標準状態で3.0molのN2は何Lか(有効数字3桁で解答)。
解答/解説:タップで表示
解答:67.2L
\[ \mathrm{3.0(\cancel{mol}) \times 22.4(L/\cancel{mol}) = 67.2(L)} \]
8.8gのCO2は何molか(有効数字2桁で解答)。
解答/解説:タップで表示
解答:0.20mol
\[ \begin{align}
&\mathrm{8.8(g) \div 44(g/mol)} \\
&\mathrm{= 8.8(\cancel{ g }) \times \frac{ 1 }{ 44 }(mol/\cancel{ g }) }\\
&\mathrm{= 0.20(mol)}
\end{align} \]
0.50molのH2は何個か(有効数字2桁で解答)。
解答/解説:タップで表示
解答:3.0×1023個
\[ \mathrm{0.50(\cancel{mol}) \times 6.0×10^{23}(個/\cancel{mol}) = 3.0×10^{23}(個)} \]
標準状態で0.224LのO2は何molか(有効数字2桁で解答)。
解答/解説:タップで表示
解答:0.010mol
\[ \begin{align}
&\mathrm{0.224(L) \div 22.4(L/mol)} \\
&\mathrm{= 0.224(\cancel{ L }) \times \frac{ 1 }{ 22.4 }(mol/\cancel{ L }) }\\
&\mathrm{= 0.010(mol)}
\end{align} \]
2.0gのH2は何個か(有効数字2桁で解答)。
解答/解説:タップで表示
解答:6.0×1023個
まずは、gをモル質量(g/mol)で割ることで、molを求める。
\[ \begin{align}
&\mathrm{2.0(g) \div 2(g/mol)} \\
&\mathrm{= 2.0(\cancel{ g }) \times \frac{ 1 }{ 2 }(mol/\cancel{ g }) }\\
&\mathrm{= 1.0(mol) }
\end{align}\]
次に、今求めたmolに6.0×1023(個/mol)をかけることで、個数を求める。
\[ \mathrm{1.0(\cancel{mol}) \times 6.0×10^{23}(個/\cancel{mol}) = 6.0×10^{23}(個) }\]
標準状態で2.24LのO2は何gか(有効数字2桁で解答)。
解答/解説:タップで表示
解答:3.2g
まずは、Lを22.4(L/mol)で割ることで、molを求める。
\[ \begin{align}
&\mathrm{2.24(L) \div 22.4(L/mol) }\\
&\mathrm{= 2.24(\cancel{ L }) \times \frac{ 1 }{ 22.4 }(mol/\cancel{ L }) }\\
&\mathrm{= 0.10(mol)}
\end{align} \]
次に、今求めたmolにモル質量(g/mol)をかけることで、gを求める。
\[ \mathrm{0.10(\cancel{mol}) \times 32(g/\cancel{mol}) = 3.2(g)} \]
6.0×1023個のO2は標準状態で何Lか(有効数字2桁で解答)。
解答/解説:タップで表示
解答:22.4L
まずは、個数を6.0×1023(個/mol)で割ることで、molを求める。
\[ \begin{align}
&\mathrm{6.0×10^{23}(個) \div 6.0×10^{23}(個/mol) }\\
&\mathrm{= 6.0×10^{23}(\cancel{ 個 }) \times \frac{ 1 }{ 6.0×10^{23} }(mol/\cancel{ 個 }) }\\
&\mathrm{= 1.0(mol)}
\end{align} \]
次に、今求めたmolに22.4(L/mol)をかけることで、Lを求める。
\[ \mathrm{1.0(\cancel{mol}) \times 22.4(L/\cancel{mol}) = 22.4(L) }\]
1.2×1024個のH2は何gか(有効数字2桁で解答)。
解答/解説:タップで表示
解答:4.0g
まずは、個数を6.0×1023(個/mol)で割ることで、molを求める。
\[ \begin{align}
&\mathrm{1.2×10^{24}(個) \div 6.0×10^{23}(個/mol) }\\
&\mathrm{= 1.2×10^{24}(\cancel{ 個 }) \times \frac{ 1 }{ 6.0×10^{23} }(mol/\cancel{ 個 })} \\
&\mathrm{= 2.0(mol)}
\end{align} \]
次に、今求めたmolにモル質量(g/mol)をかけることで、gを求める。
\[ \mathrm{2.0(\cancel{mol}) \times 2(g/\cancel{mol}) = 4.0(g)} \]
標準状態で22.4LのO2は何個か(有効数字2桁で解答)。
解答/解説:タップで表示
解答:6.0×1023個
まずは、Lを22.4(L/mol)で割ることで、molを求める。
\[ \begin{align}
&\mathrm{22.4(L) \div 22.4(L/mol) }\\
&\mathrm{= 22.4(\cancel{ L }) \times \frac{ 1 }{ 22.4 }(mol/\cancel{ L }) }\\
&\mathrm{= 1.0(mol) }
\end{align}\]
次に、今求めたmolに6.0×1023(個/mol)をかけることで、個数を求める。
\[ \mathrm{1.0(\cancel{mol}) \times 6.0×10^{23}(個/\cancel{mol}) = 6.0×10^{23}(個)} \]














