MENU
【陽イオン交換膜法】水酸化ナトリウムの製法の仕組みや反応式など
はじめに
【プロ講師解説】このページでは『【陽イオン交換膜法】水酸化ナトリウムの製法の仕組みや反応式など』について解説しています。
陽イオン交換膜法とは
- 水酸化ナトリウムNaOHの工業的製法を陽イオン交換膜法という。
- 陽イオン交換膜法は電気分解の一種であるため、次のページを確認した後読むことをオススメする。
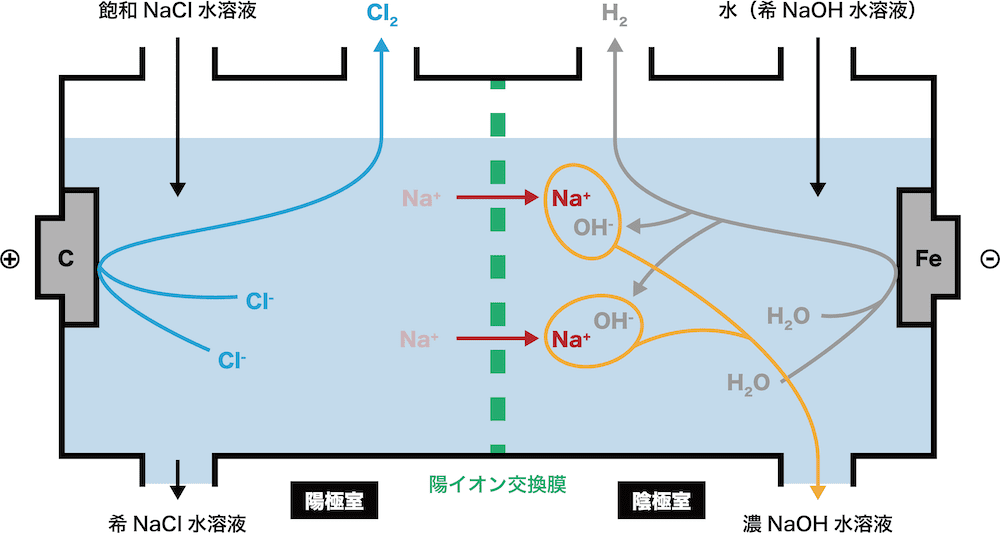
陽イオン交換膜法の仕組み
- 陽イオン交換膜法の仕組みについて、次の流れで解説する。
●STEP1
陽極室にNaCl水溶液を、陰極室に水(NaOH水溶液)を入れる。
●STEP2
陽極室でCl-がe-を放出し、Cl2が生じる。
●STEP3
陰極室でH2Oがe-を受け取り、OH-とH2が生じる。
●STEP4
陽極室にあるNa+が陽イオン交換膜を通過し陰極室に移動する。
●STEP5
STEP3で発生したOH-とSTEP4で陰極室に移動したNa+がくっつきNaOHが生成する。
まずは、陽極室にNaCl水溶液を、陰極室に水(NaOH水溶液)を入れる。
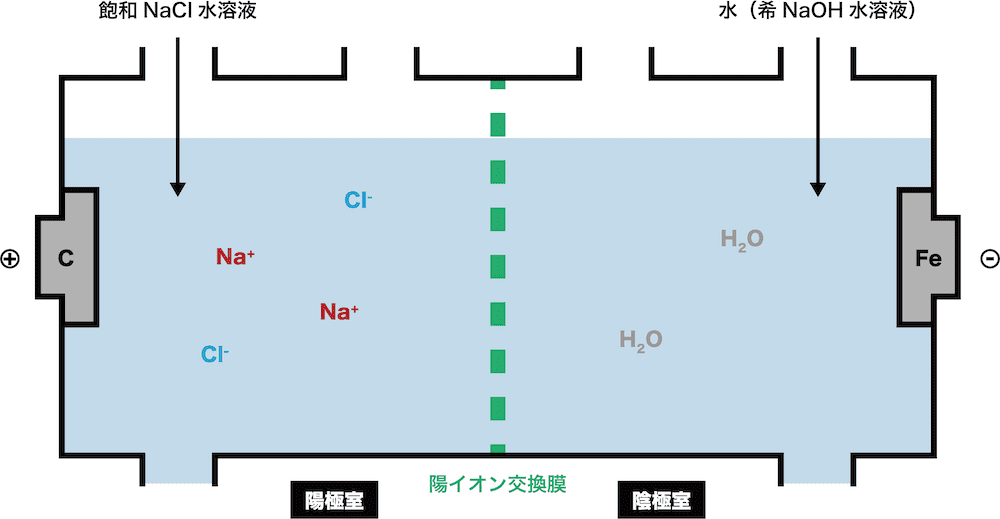
陰極室において、NaOHの生成反応に直接関与するのは水H2Oだが、実際は電気伝導性を上げるためにNaOHを少しだけ溶かした希NaOH水溶液が用いられる。
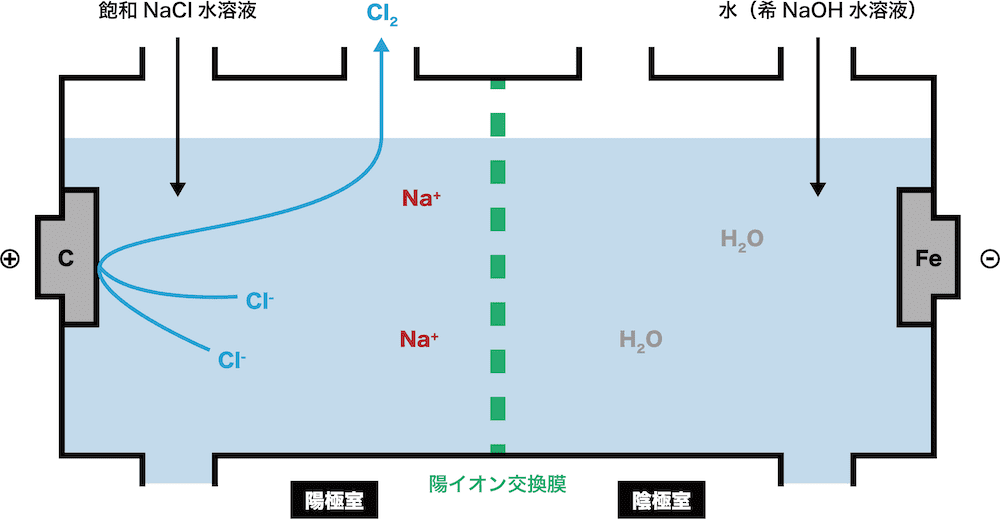
陽極室に存在するNa+、Cl-、 H2Oのうち、最も電子e-を放出しやすいのはCl-である。
したがって、陽極室ではCl-がe-を放出し、Cl2が生じる。
陰極室に存在するNa+、OH-、 H2Oのうち、最もe-を受け取りやすいのはH2Oである。
したがって、 H2Oがe-を受け取りOH-とH2が生じる。
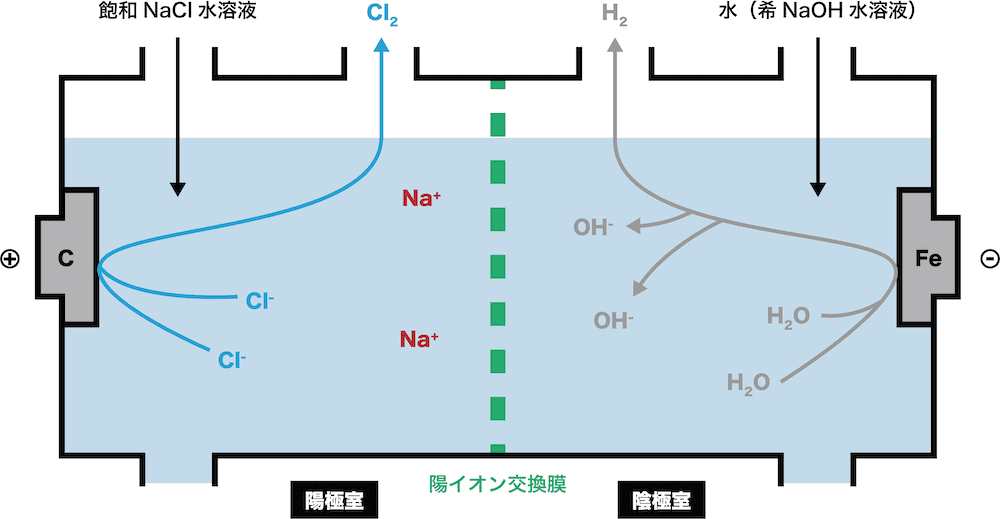
次に、陽極室にあるNa+が陽イオン交換膜を通過し陰極室に移動する。
陽イオン交換膜とは、陽イオンだけを透過させる膜である。

最後に、STEP3で発生したOH-とSTEP4で陰極室に移動したNa+がくっつきNaOHが生成する。
陽イオン交換膜法の反応式
- 陽イオン交換膜法の陽極、陰極および全体の反応式を考える。
陽極の反応式
- 陽極では、Cl-がe-を放出し、Cl2が生じる。
\[ \mathrm{2Cl^{-} → Cl_{2} + 2e^{-}} \]
陰極の反応式
- 陰極では、H2Oがe-を受け取り、OH-とH2が生じる。
\[ \mathrm{2H_{2}O + 2e^{-} → H_{2} + 2OH^{-}} \]
全体の反応
- 陽イオン交換膜法の全体の反応式をつくるときは、陽極の反応式と陰極の反応式を足し合わせる。
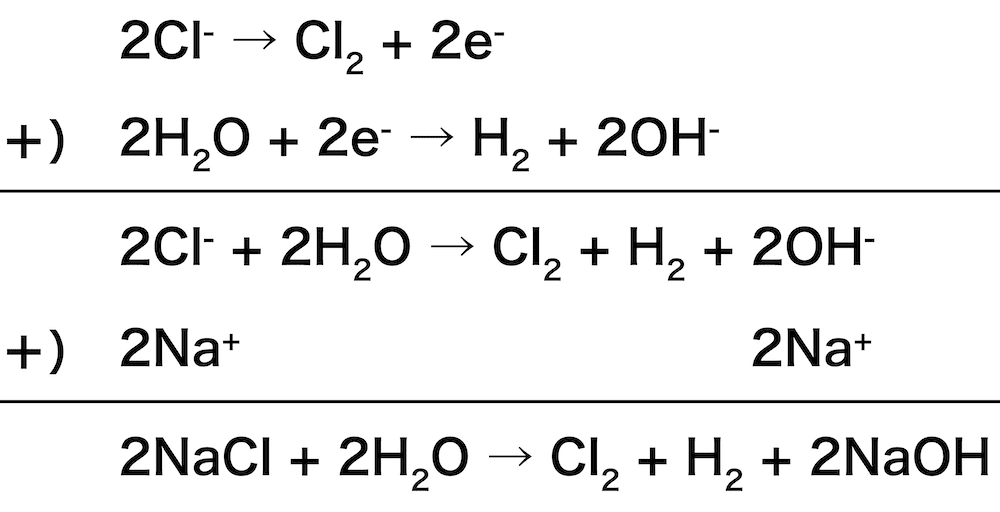
- 今回は2つの式の電子e-の数が揃っているため、そのまま足せば全体の反応式をつくることができる。
- なお、陽極・陰極どちらの式にもNa+が入っていないため、最後にこれを補うことも忘れないようにしよう。
陽イオン交換膜の仕組みと役割
- 陽イオン交換膜法に用いられる陽イオン交換膜の仕組みと役割について解説する。
陽イオン交換膜の仕組み
- 陽イオン交換膜には負電荷をもつ置換基が結合している。
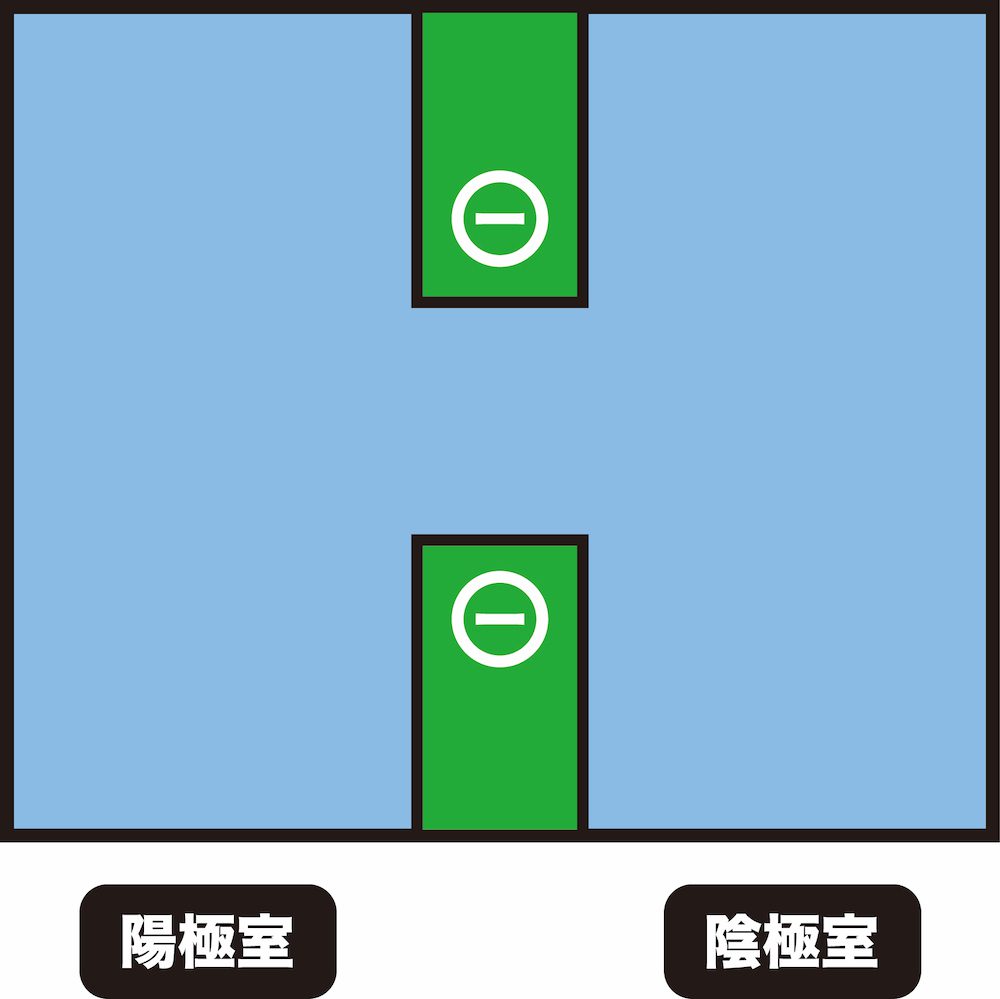
- この負電荷部分に、静電引力によって陽イオンが引きつけられ、吸着する。
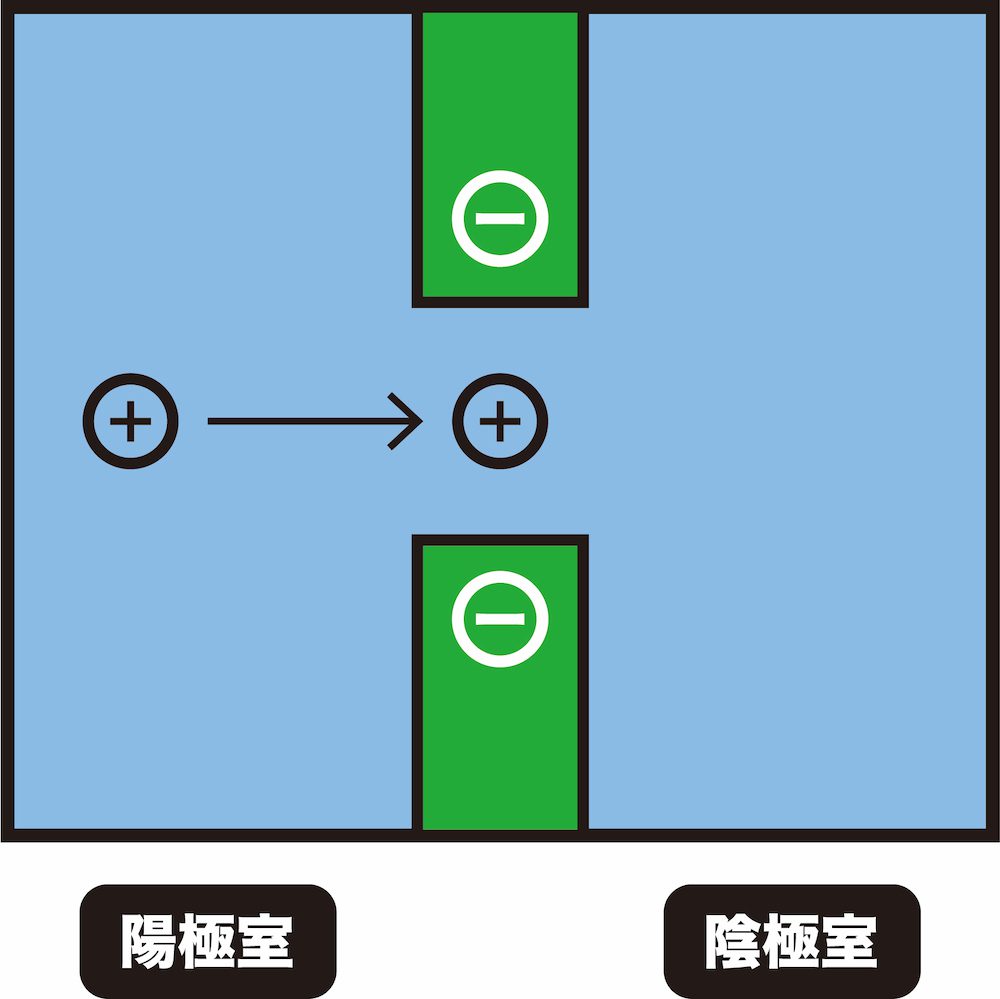
- 次から次に陽イオンがやってくることにより、先に吸着した陽イオンが膜から追い出される。
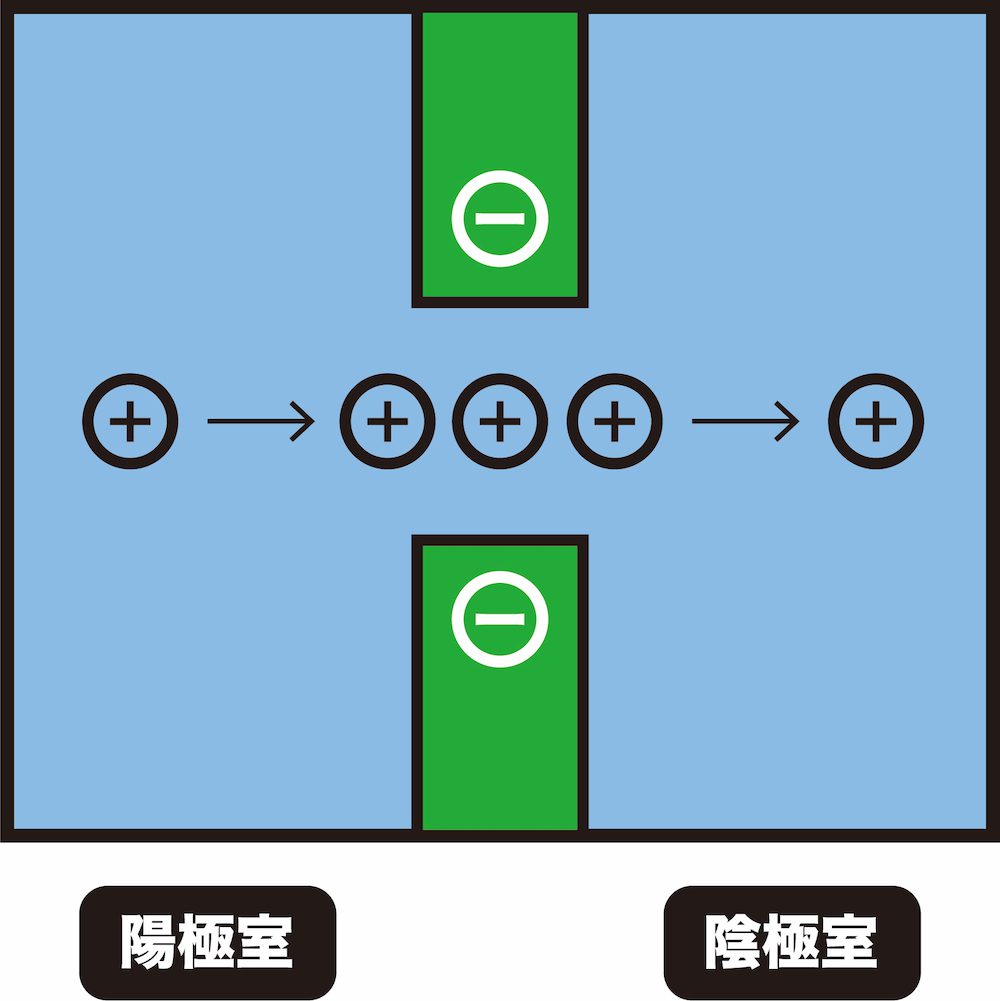
- このような仕組みにより、陽イオン交換膜は陽イオンを透過する。
ちなみに、陰イオンは負電荷同士の反発により、陽イオン交換膜内部に侵入できません。
陽イオン交換膜の役割
- 陽イオン交換膜の役割は2つ存在する。
●陽イオン交換膜の役割
- 陰極室で生成したOH-が陽極室に移動するのを防ぐ
- 陽極室で生成したCl-が陰極室に移動するのを防ぐ
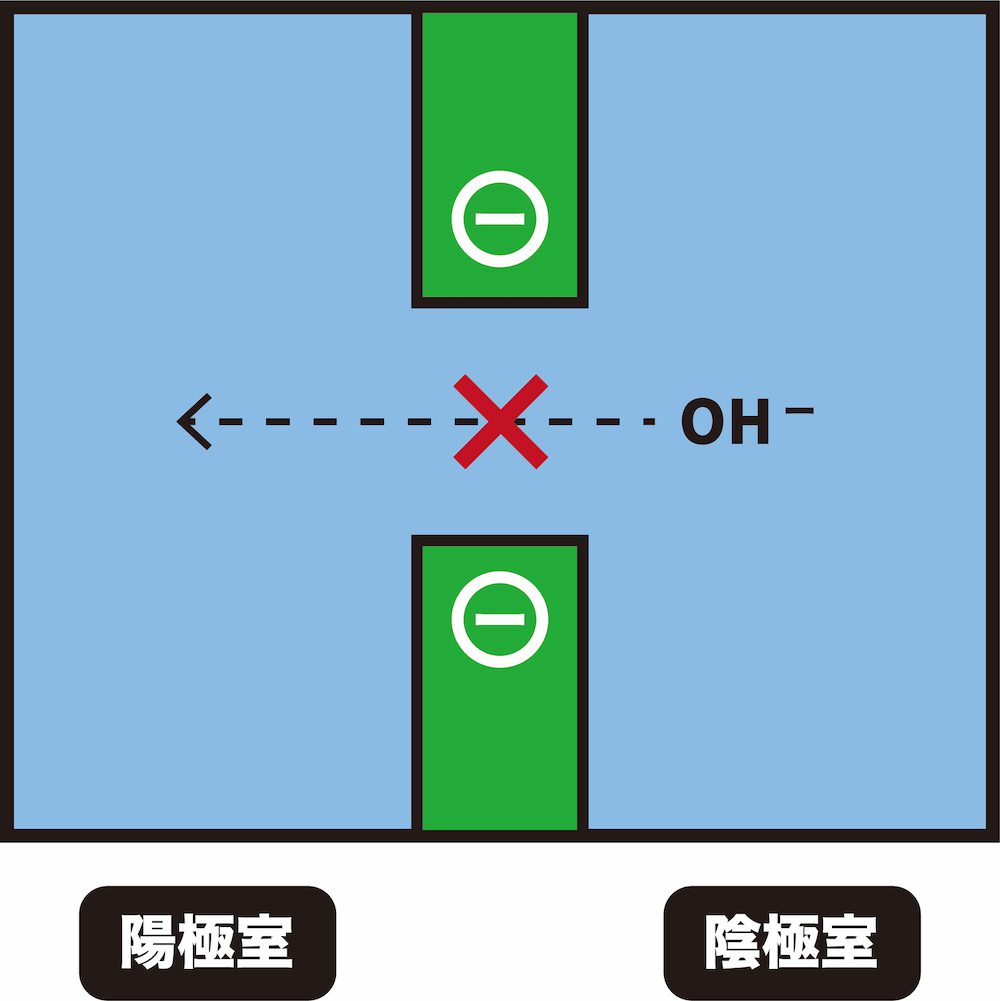
❶ 陰極室で生成したOH-が陽極室に移動するのを防ぐ
- 陽イオン交換膜は、陰極室で生成したOH-が陽極室に移動するのを防ぐ役割をもつ。
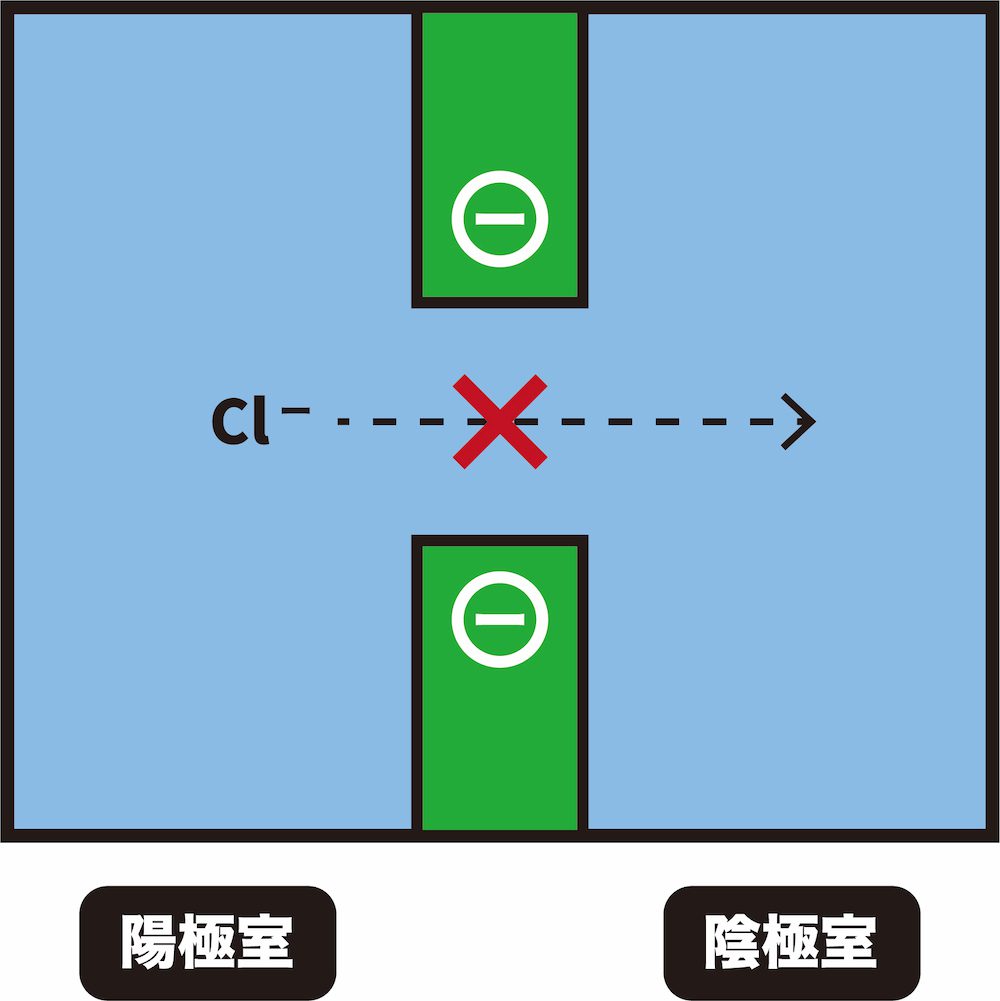
❷ 陽極室で生成したCl-が陰極室に移動するのを防ぐ
- 陽イオン交換膜は、陽極室で生成したCl-が陰極室に移動するのを防ぐ役割をもつ。