MENU
塩素の製法(洗気びんの順番の理由・覚え方など)
目次
はじめに
【プロ講師解説】このページでは『塩素の製法(洗気びんの順番の理由・覚え方など)』について解説しています。
塩素の製法
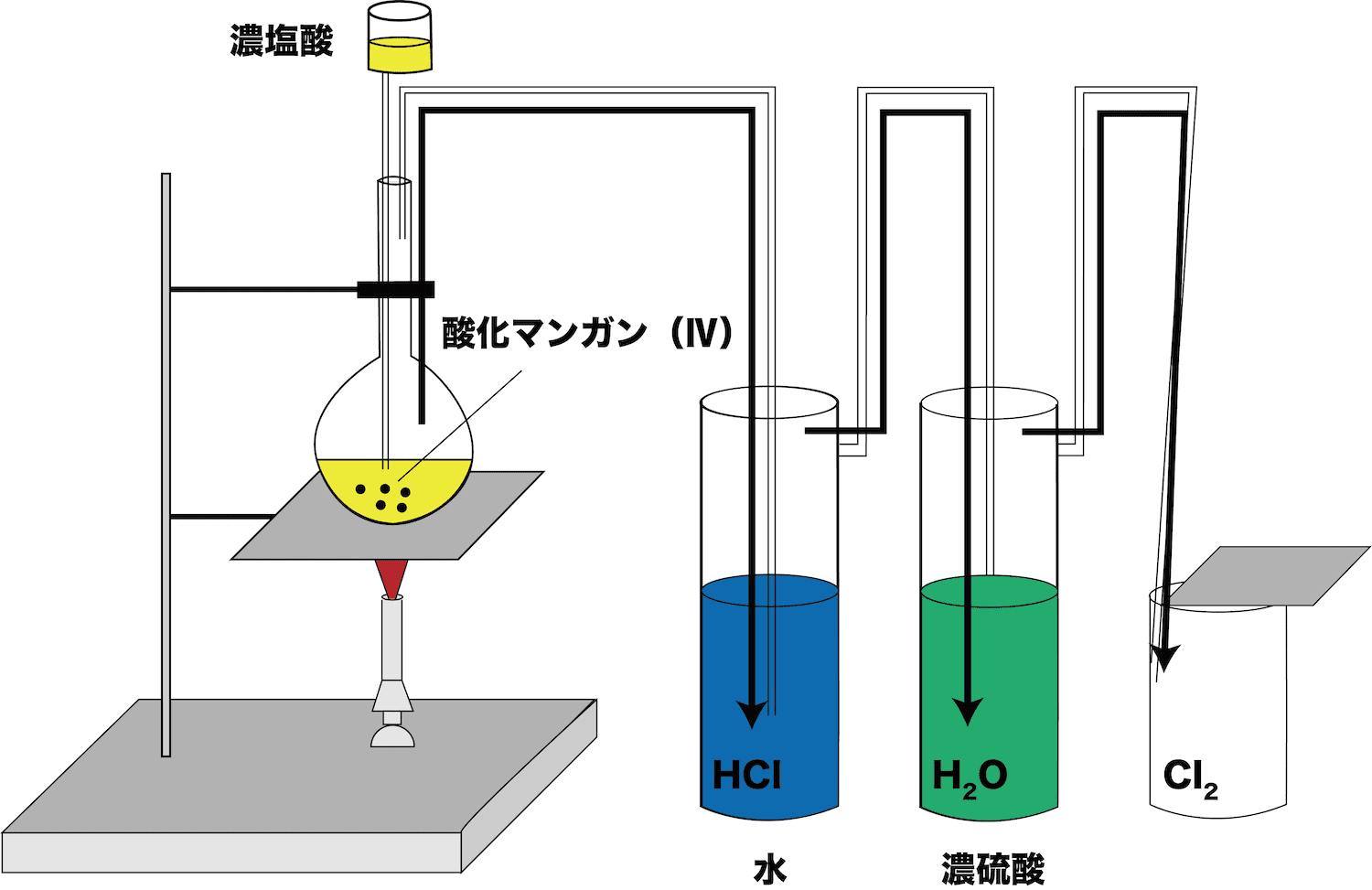
- 塩素の製法の流れは次の通りである。
●STEP1
酸化マンガン(Ⅳ)MnO2の入ったフラスコをバーナーの上にセットし、水・濃硫酸の入った洗気びんを順番につなぐ。
●STEP2
濃塩酸HClを滴下する→Cl2・H2O・HClが発生
●STEP3
水の入った洗気びんでHClを取り除く。
●STEP4
濃硫酸の入った洗気びんでH2Oを取り除く。
●STEP5
下方置換法でCl2を回収する。
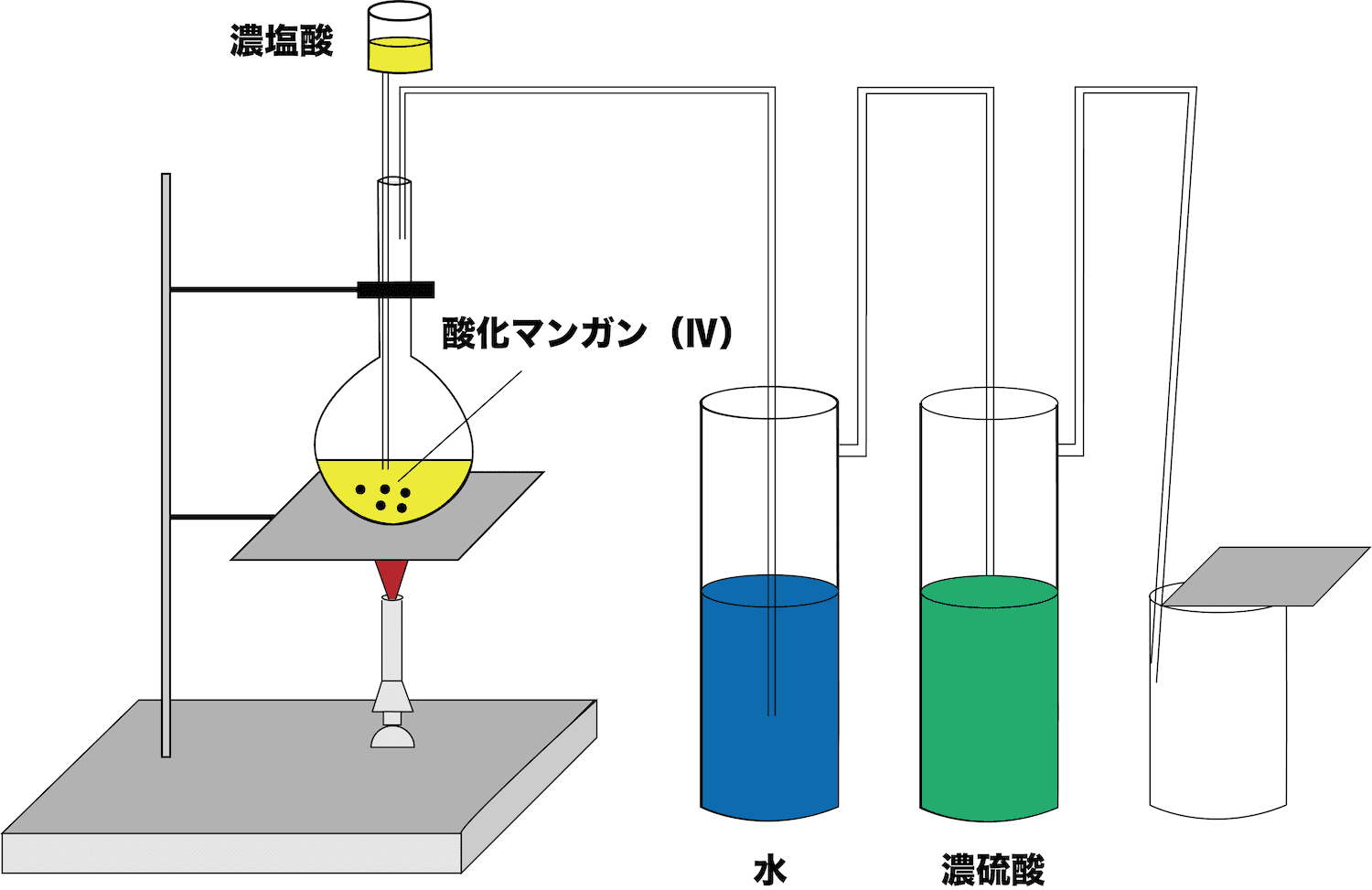
STEP
酸化マンガン(Ⅳ)MnO2の入ったフラスコをバーナーの上にセットし、水・濃硫酸の入った洗気びんを順番につなぐ。
まず、酸化マンガン(Ⅳ)MnO2の入ったフラスコをバーナーの上にセットし、水・濃硫酸の入った洗気びんを順番につなぐ。
STEP
濃塩酸HClを滴下する→Cl2・H2O・HClが発生
次に、濃塩酸HClを滴下する。

このときの反応式は次の通りである。
\[ \mathrm{MnO_{2}+4HCl→Cl_{2}+MnCl_{2}+2H_{2}O} \]
この反応により、塩素Cl2が発生する。
また、このとき発生する気体にはCl2の他に、揮発したHClとH2Oも含まれる。
STEP
水の入った洗気びんでHClを取り除く。
次に、水の入った洗気びんでHClを取り除く。
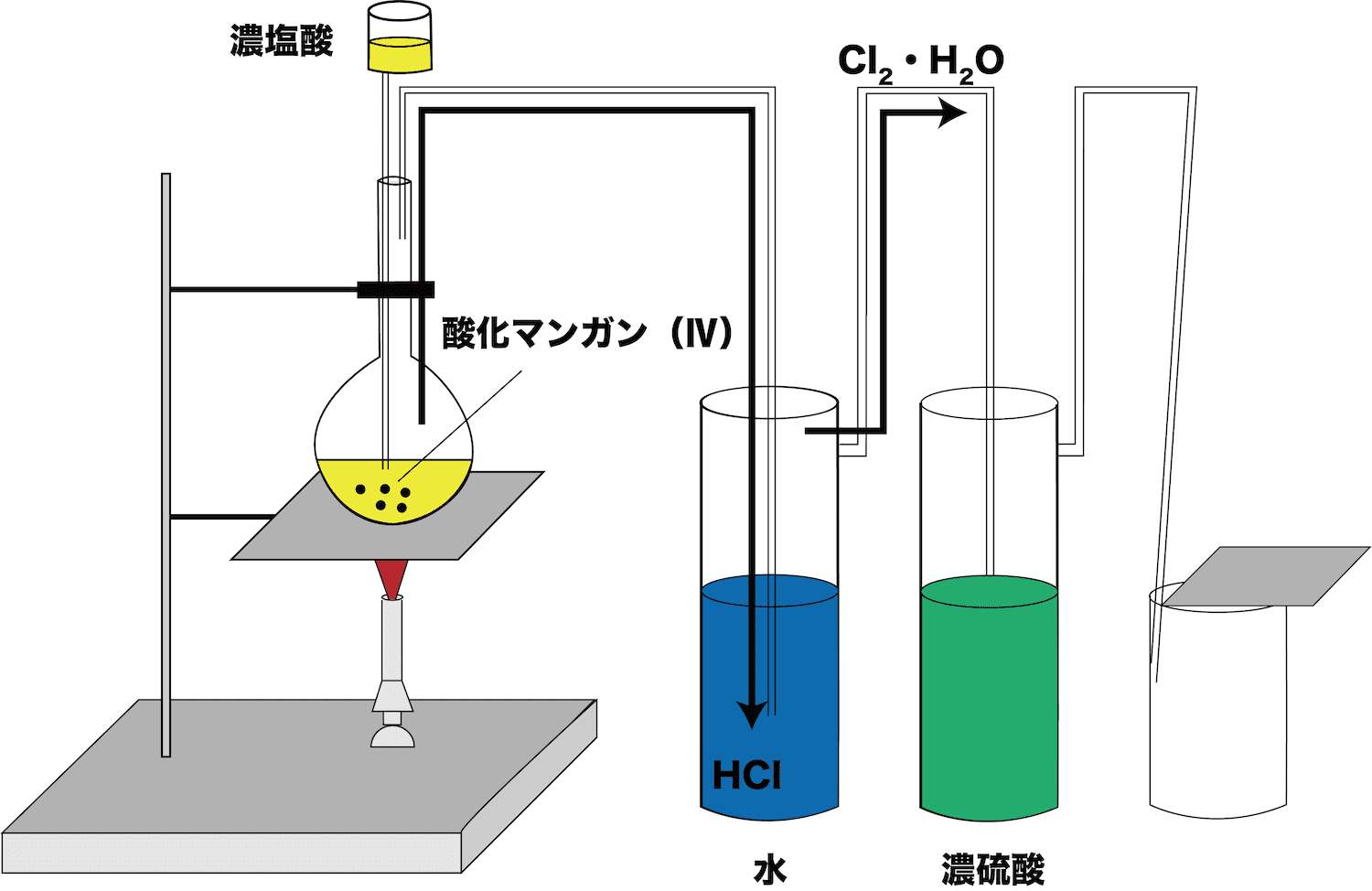
HClは水によく溶ける(Cl2は溶けない)ため、H2Oの入った洗気びんを通すことでHClのみが取り除かれる。
STEP
濃硫酸の入った洗気びんでH2Oを取り除く。