MENU
【乾燥剤】酸性・中性・塩基性の乾燥剤一覧や分類・仕組みなど
目次
はじめに
【プロ講師解説】このページでは『【乾燥剤】酸性・中性・塩基性の乾燥剤一覧や分類・仕組みなど』について解説しています。
乾燥剤の仕組み
- 気体に含まれる水分が乾燥剤に吸着し、結果的に気体が水分を失う=乾燥される。
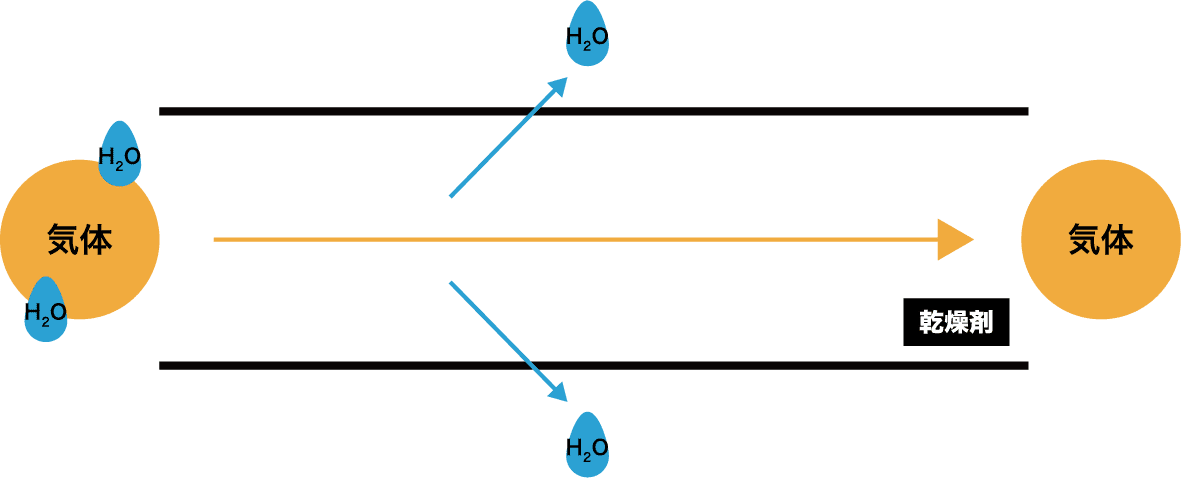
乾燥剤が使える場合、使えない場合
- 乾燥剤は気体によって使える場合と使えない場合がある。
- ここでは「酸性の気体を乾燥剤で乾燥させる場合」を例に説明する。
酸性気体に酸性の乾燥剤を使う場合
- まずは、酸性気体を乾燥させるときに酸性の乾燥剤を使う場合を考える。
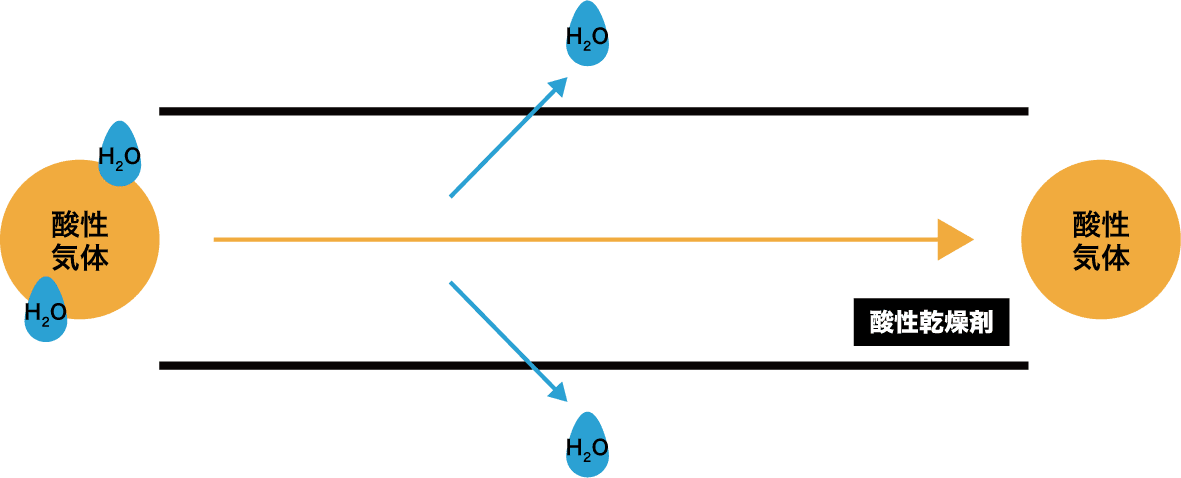
- 酸性気体を乾燥させるときに酸性の乾燥剤を使うと、問題なく乾燥を行うことができる。これは、酸性同士では反応が起こらないためである。
酸性気体に酸性の乾燥剤を使う場合
- 次に、酸性気体を乾燥させるときに塩基性の乾燥剤を使う場合を考える。

- 酸性と塩基性を合わせると当然ながら酸塩基反応(中和反応)が起こる。
- その結果、乾燥剤を通した気体をそのままの状態で得ることが難しくなる。
- このように、気体と乾燥剤には相性があり、反応が起こらないような組み合わせ(純粋に水だけを取ってくれる組み合わせ)を選んで使う必要がある。
乾燥剤の分類・一覧
- 代表的な乾燥剤と、乾燥できる気体・できない気体についてまとめる。
| 酸性気体 | 塩基性気体 | 中性気体 | ||
|---|---|---|---|---|
| 酸性の乾燥剤 | 十酸化四リンP4O10 | ○ | × | ○ |
| 濃硫酸 H2SO4 | ○ (H2Sは酸化還元反応をするので×) | × | ○ | |
| 塩基性の乾燥剤 | ソーダ石灰 (CaO+NaOH) | × | ○ | ○ |
| 中性の乾燥剤 | 塩化カルシウム CaCl2 | ○ | ○ NH3は反応してCaCl2・8NH3を作ってしまうため× | ○ |














