MENU
飽和蒸気圧(求め方・温度との関係・計算問題の解き方など)
はじめに
【プロ講師解説】このページでは『飽和蒸気圧(求め方・温度との関係・計算問題の解き方など)』について解説しています。
飽和蒸気圧とは
- 密閉容器に液体を入れて十分時間が経つと「液体が気体になる量」と「気体が再び液体に戻る量」が一定となり、見かけ上、容器内の気体分子数に変化がなくなる(気液平衡)。
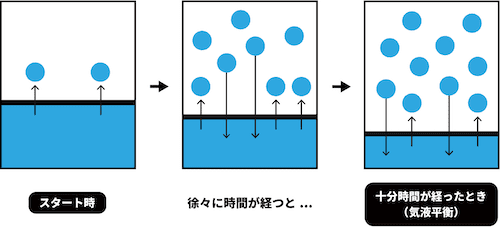
- このとき、温度と体積が一定であると仮定すると、モル数に変化はないので圧力も一定となる。
\[ P
=
\underbrace{ \frac{ nRT }{ V } }
_{ \text{ 一定 }} \]
- このときの圧力を、この温度におけるその物質の飽和蒸気圧(または蒸気圧)という。
- ちなみに、PV=nRTは気体の状態方程式とよばれる。気体の状態方程式について詳しくは次のページを参照のこと。
飽和蒸気圧の性質
●性質1
物質の種類と温度に依存する
●性質2
容器の大きさや他の気体の存在は関係ない
- 体積一定で温度を上げていくと、気体は徐々に蒸発し、気相中に存在する気体のmol数が増える。これに伴い圧力(飽和蒸気圧)が増加する。
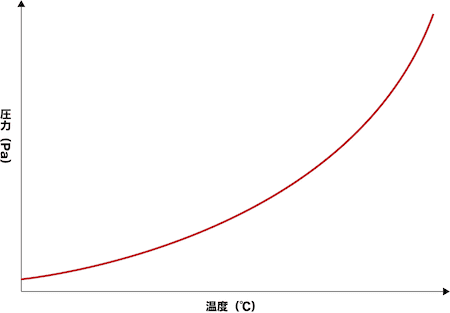
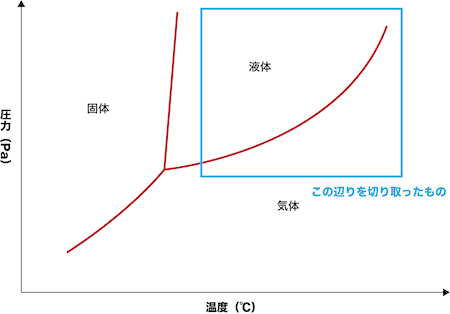
- ちなみにこのような圧力(飽和蒸気圧)と温度の関係を表す曲線を蒸気圧曲線といい、状態図の一部を切り取ったものである。
飽和蒸気圧が絡んだ計算問題
- 飽和蒸気圧の計算問題を解く前に次のことを押さえておく必要がある。
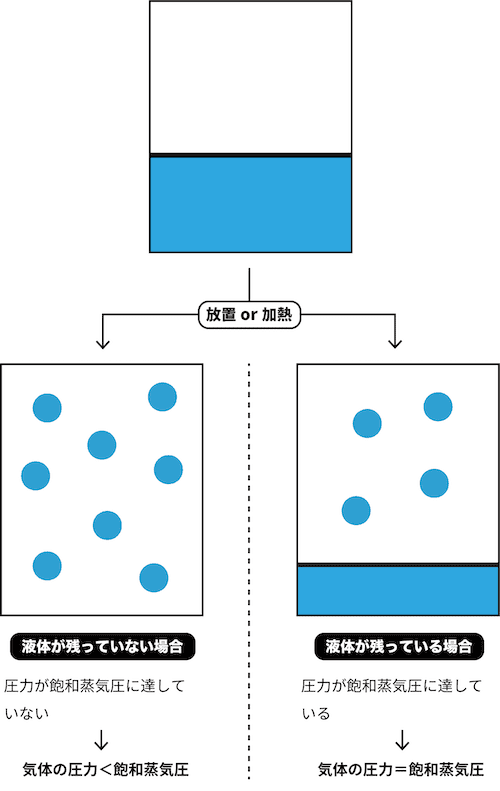
- 密閉容器に液体を入れて放置or加熱したとき、液体が残っていない場合と液体が残っている場合がある。
- 液体が残っていない場合では、容器内の気体の圧力が飽和蒸気圧に達しておらず「気体の圧力<飽和蒸気圧」の状態である。
- 一方、液体が残っている場合では、容器内の気体の圧力が飽和蒸気圧に達しており「気体の圧力=飽和蒸気圧」の状態である。
- それではこれから飽和蒸気圧が絡んだ計算問題を3パターン紹介する。いずれも入試頻出問題なのでしっかり解けるようにしておこう。
【パターン1】
状態判定(液化の有無の判断)
【パターン2】
水を放置した際の圧力及び液化している分の質量を求める問題
【パターン3】
化学反応後の容器内の圧力を求める問題
【パターン1】状態判定(液化の有無の判断)
●STEP1
液体全てが気体になったと仮定し、気体の状態方程式を用いて“仮の圧力P仮”を求める
●STEP2
STEP1で求めたP仮と飽和蒸気圧P飽を比較する
P仮 > P飽 → 液化している
P仮 ≦ P飽 → 液化していない
- 容器に液体を入れてしばらく放置(or加熱)した後、入れた液体が全て気体になっているのか、それとも一部が液体として存在しているのかを判断する問題である。
- 上の2STEPを用いて次の問題を解いてみよう。
80℃において、2.0Lの密閉容器に水を0.90g入れてしばらく放置した。このとき容器内に水滴は存在するか。ただし気体定数Rは8.3×103L・Pa/(K・mol)、80℃における水の飽和蒸気圧は4.7×104(Pa)とする。
まずは、液体が全て気体になったと仮定し、気体の状態方程式を用いて「仮の圧力」を求める。
\[ \begin{align} PV&=nRT\\
\leftrightarrow P&=\frac{ nRT }{ V }\\
&\mathrm{=\frac{ \frac{ 0.90(g) }{ 18(g/mol) }×8.3×10^{3}(L・Pa/(K・mol))×(80+273)(K) }{ 2.0(L) }}\\
&≒7.3×10^{4}(\mathrm{Pa}) \end{align} \]
P仮 > P飽 → 液化している
P仮 ≦ P飽 → 液化していない
次に、STEP1で求めた圧力P仮と飽和蒸気圧を比較する。
問題文に80℃における水の飽和蒸気圧は4.7×104(Pa)と書いてあるため、次のようになる。
\[ \underbrace{ 7.3×10^{4}(\mathrm{Pa}) }_{ \text{ STEP1で求めた仮の圧力 }}>\underbrace{ 4.7×10^{4}(\mathrm{Pa}) }_{ \text{ 飽和蒸気圧 }} \]
今回はP仮 > P飽のため、液化している(容器内に水滴は存在する)。
【パターン2】水を放置した際の圧力及び液化している分の質量を求める問題
●STEP1
液体全てが気体になったと仮定し、気体の状態方程式を用いて“仮の圧力P仮”を求める
●STEP2
STEP1で求めたP仮と飽和蒸気圧P飽を比較する
P仮 > P飽 → 液化している → 容器内の圧力はP飽
P仮 ≦ P飽 → 液化していない → 容器内の圧力はP仮
●STEP3
最初に入れたgに
\[\frac{ P_{仮}-P_{飽} }{ P_{仮} }\]
をかけ、液化しているgを求める
- 上の3STEPを用いて次の問題を解いてみよう。
80℃において、3.0Lの密閉容器に水を1.8g入れ放置した。このときの容器内の圧力、及び液化している水の質量を求めよ。ただし、気体定数を8.3×103L・Pa/(K・mol)、80℃における水の蒸気圧を4.7×104Paとする。
まずは、液体が全て気体になったと仮定し、気体の状態方程式を用いて「仮の圧力」を求める。
\[ \begin{align} PV&=nRT\\
\leftrightarrow P&=\frac{ nRT }{ V }\\
&\mathrm{=\frac{ \frac{ 1.8(g) }{ 18(g/mol) }×8.3×10^{3}(L・Pa/(K・mol))×(80+273)(K) }{ 3.0(L) }}\\
&≒9.8×10^{4}(\mathrm{Pa}) \end{align} \]
P仮 > P飽 → 液化している → 容器内の圧力はP飽
P仮 ≦ P飽 → 液化していない → 容器内の圧力はP仮
次に、STEP1で求めた圧力(P仮)と飽和蒸気圧を比較する。
\[ \underbrace{ 9.8×10^{4}(\mathrm{Pa}) }_{ \text{ STEP1で求めた仮の圧力 }}>\underbrace{ 4.7×10^{4}(\mathrm{Pa}) }_{ \text{ 飽和蒸気圧 }} \]
今回はP仮 > P飽のため、容器内の圧力はP飽の4.7×104である。
最初に入れたgに「(P仮ーP飽)/P仮」をかけ、液化しているgを求める。
\[ \begin{align}&1.8(\mathrm{g})×\frac{ 9.8×10^{4}(\mathrm{Pa})-4.7×10^{4}(\mathrm{Pa}) }{ 9.8×10^{4}(\mathrm{Pa}) }\\
&≒0.94(\mathrm{g})\end{align} \]
【パターン3】化学反応後の容器内の圧力を求める問題
●STEP1
反応量シートを用いて、燃焼後の各気体の分圧を求める(分圧が飽和蒸気圧を超えている場合はその気体の圧力は飽和蒸気圧として考える)
●STEP2
分圧を足し合わせ、全圧を求める
- 上の2STEPを用いて次の問題を解いてみよう。
容積一定の容器に、27℃でプロパン1.0×105Paと酸素6.0×105Paを入れ、完全燃焼させたところ、水と二酸化炭素が発生した。その後、27℃に戻したときの水(水蒸気)の分圧を求めよ。また、容器内に存在する気体の全圧を求めよ。ただし、水の飽和蒸気圧は27℃で4.0×103Paとする。
まずは、反応量シートを用いて燃焼後の各気体の分圧を出す。
このとき、分圧が飽和蒸気圧を超えている場合、その気体の圧力は飽和蒸気圧として考える。
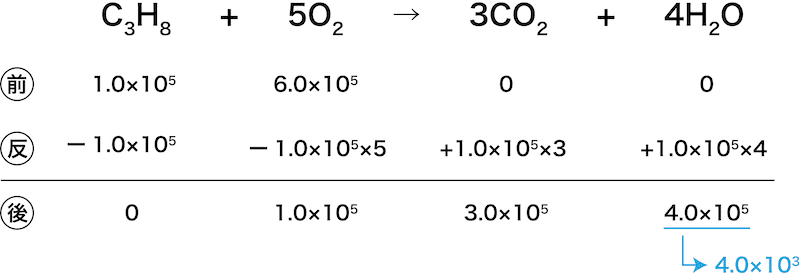
今回は問題文中にH2Oの飽和蒸気圧が4.0×103Paと書いてあるので、計算上4.0×105Paと出たH2Oの分圧は4.0×103Paまで低下させる(はみ出た分は“液化”している)。
次に、分圧を足し合わせることで全圧を求める。
\[ \begin{align}P_{全}&=P_{O_{2}}+P_{\mathrm{CO_{2}}}+P_{\mathrm{H_{2}O}}\\
&=1.0×10^{5}+3.0×10^{5}+4.0×10^{3}\\
&=4.04×10^{5}\\
&≒4.0×10^{5}(\mathrm{Pa})\end{align} \]
演習問題
化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
密閉容器に液体を入れて十分時間が経つと「液体が気体になる量」と「気体が再び液体に戻る量」が一定となり、見かけ上、容器内の気体分子数に変化がなくなる。この状態を【1】という。
解答/解説:タップで表示
解答:【1】気液平衡
密閉容器に液体を入れて十分時間が経つと「液体が気体になる量」と「気体が再び液体に戻る量」が一定となり、見かけ上、容器内の気体分子数に変化がなくなる。この状態を気液平衡という。
気液平衡時、温度と体積が一定であると仮定すると、モル数に変化はないので圧力も一定となる。このときの圧力をこの温度におけるその物質の【1】という。
解答/解説:タップで表示
解答:【1】飽和蒸気圧(蒸気圧)
気液平衡時、温度と体積が一定であると仮定すると、モル数に変化はないので圧力も一定となる。このときの圧力をこの温度におけるその物質の飽和蒸気圧(蒸気圧)という。
体積一定で温度を上げていくと、気体は徐々に蒸発し、気相中に存在する気体のmol数が増える。これに伴い圧力(飽和蒸気圧)が増加する。このときの飽和蒸気圧と温度の関係を表す曲線を【1】という。
解答/解説:タップで表示
解答:【1】蒸気圧曲線
体積一定で温度を上げていくと、気体は徐々に蒸発し、気相中に存在する気体のmol数が増える。これに伴い圧力(飽和蒸気圧)が増加する。このときの飽和蒸気圧と温度の関係を表す曲線を蒸気圧曲線という。














