MENU
アルキン(一般式の作り方・一覧・製法・付加重合・置換反応など)
目次
はじめに
【プロ講師解説】このページでは『アルキン(一般式の作り方・一覧・製法・付加重合・置換反応など)』について解説しています。
アルキンとは
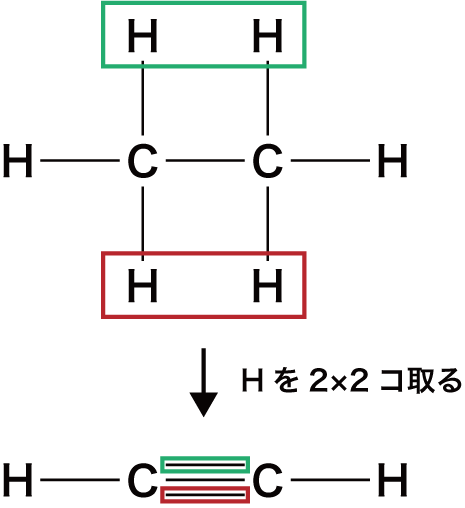
- 一般式CnH2n-2(n≧2)で表される、分子内に炭素炭素三重結合(C≡C)を1個もつ鎖式不飽和炭化水素をアルキンという。
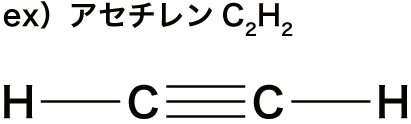
- アルキンはアルカンからH原子を4個とったものと考えることができる。
アルキン一覧
- 代表的なアルキンを次に示す。
| n(炭素数) | 分子式 | 一般名 | 慣用名 |
|---|---|---|---|
| 2 | C2H2 | エチン | アセチレン |
| 3 | C3H4 | プロピン | メチルアセチレン |
| 4 | C4H6 | ブチン | なし |
| 5 | C5H8 | ペンチン | なし |
| 6 | C6H10 | ヘキシン | なし |
- アルカンの一般名はアルカンの語尾「〜アン(ane)」を「〜イン(yne)」にしたものである。
慣用名とはルールに基づかない特殊な名称で、一般に暗記する必要があります。
アルキンの反応①(付加反応)
- アルキンの付加反応はほぼアルケンと一緒である。まだアルケンについて学習していない場合は、先にアルケン(一般式の作り方・一覧・命名法・製法・付加反応など)を一読してから読み進めていこう。
●アルキンの反応①(付加反応)
- Br2の付加
- 水素H2の付加、付加重合
- 塩化水素HClの付加、付加重合
- 酢酸CH3COOHの付加、付加重合
- シアン化水素HCNの付加、付加重合
- 水H2Oの付加、付加重合
❶ Br2の付加
- 臭素Br2のアルキンへの付加では、次のようにアルキンの三重結合のうち一本が切れ、Br-Brの2つのBrが付加する。
\[ \mathrm{CH≡CH \overset{Br_{2}(赤褐色)}{\longrightarrow} CHBr=CHBr(無色)} \]
- 結果として、臭素Br2の赤褐色が消えることになるため、この反応は臭素の脱色を利用した「炭素炭素三重結合(C≡C)の検出反応」として用いられる。
❷ 水素H2の付加、付加重合
- 水素H2のアルキンへの付加では、アルキンの三重結合のうち一本が切れ、H-Hの2つのHが付加する。
- また、さらに残った二重結合のうち一本が切れ、外側に結合を開いて“重合(付加重合)”する。
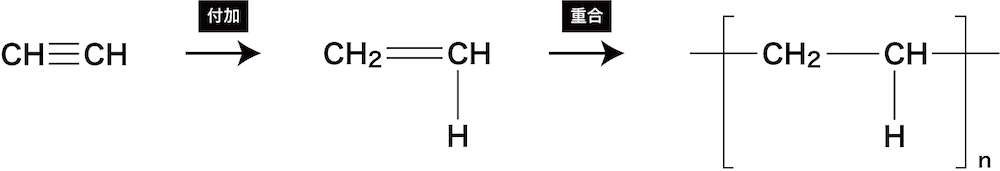
- 重合では無数に同じ部分が繰り返すことを[]とnを使って表している。
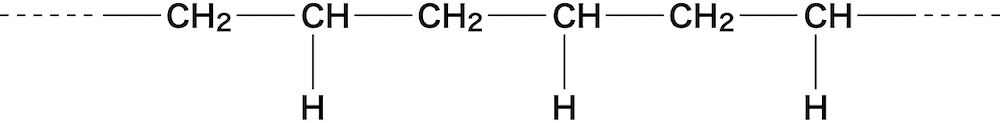
参考:付加重合・共重合(ビニル系・ビニリデン系・テフロン・天然ゴムなど)
❸ 塩化水素HClの付加、付加重合
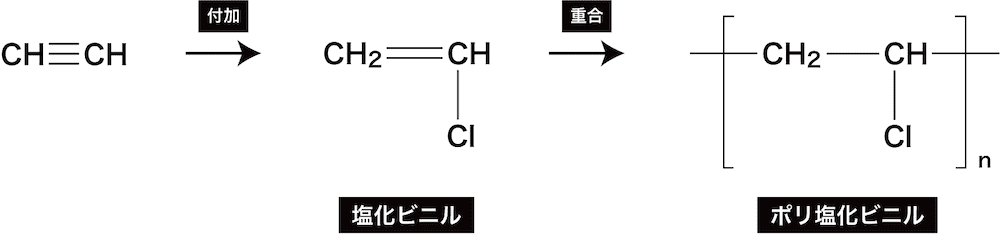
- アセチレンに塩化水素HClを付加させると塩化ビニルが、またその重合によりポリ塩化ビニルが生じる。
❹ 酢酸CH3COOHの付加、付加重合
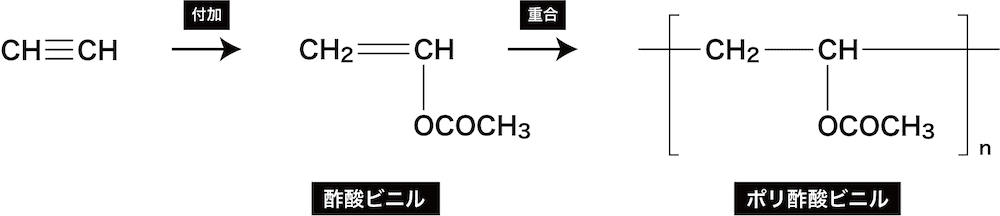
- アセチレンに酢酸CH3COOHを付加させると酢酸ビニルが、またその重合によりポリ酢酸ビニルが生じる。
❺ シアン化水素HCNの付加、付加重合
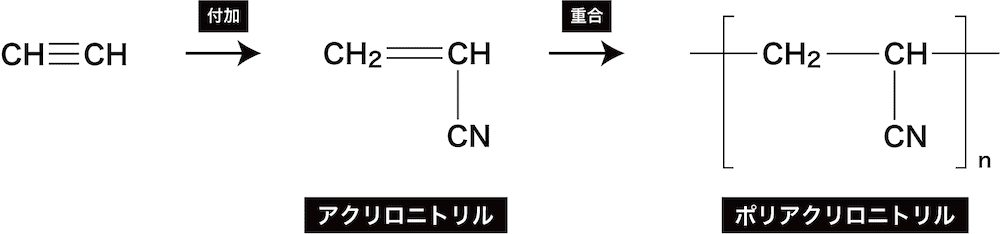
- アセチレンにシアン化水素HCNを付加させるとアクリロニトリルが、またその重合によりポリアクリロニトリルが生じる。
❻ 水H2Oの付加、付加重合
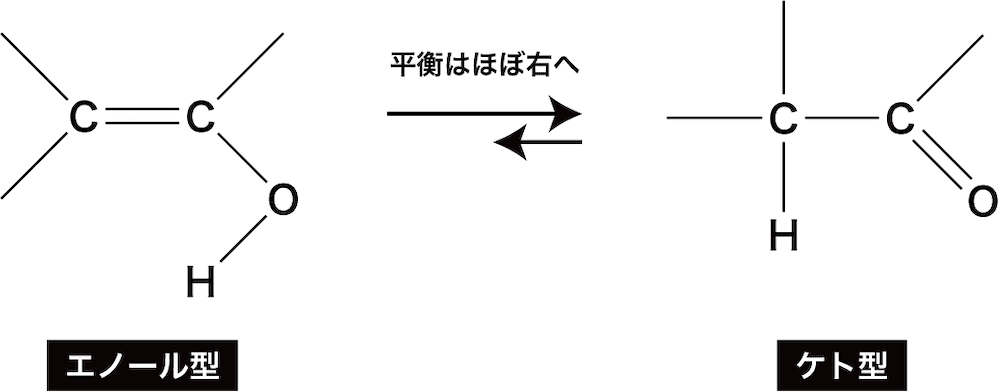
- 水H-OHの付加はこれまで上で紹介してきたようにはならないので注意が必要である。
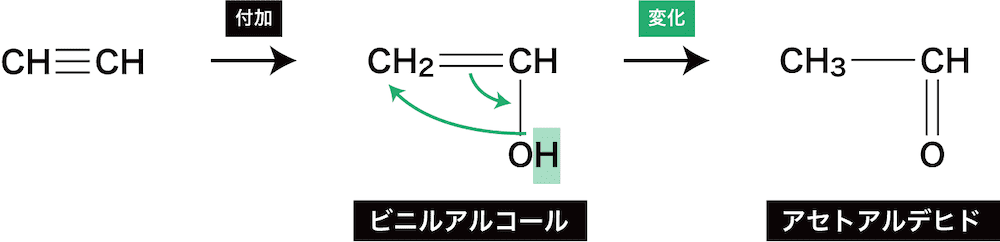
- C=C結合にヒドロキシ基が結合した構造をエノール型の構造といい、この構造は炭素酸素二重結合(C=O)に可逆的に変化する。
- この性質をケトエノール互変異性といい、一般にはエノール型であるビニルアルコールは非常に不安定であるため、より安定なケト型であるアセトアルデヒドが生成する方向に大きく平衡が傾いている。
-C≡C-Hの反応
- R-C≡C-HのようなC≡Cに直接結合しているHはH+として電離しやすいという性質がある。
\[ \mathrm{R-C≡C-H⇆R-C≡C^{-}+H^{+}・・・①} \]
- 塩基性の水溶液中ではH++OHー→H2Oの変化によってH+濃度が減少しているため、①式の平衡が右に移動する。(ルシャトリエの原理)
- 結果、R-C≡Cーのイオンが増加する。このイオンは銀イオンAg+などと難溶性の塩を形成して沈殿する。
- この反応は炭素炭素三重結合(C≡C)の検出反応として用いられている。
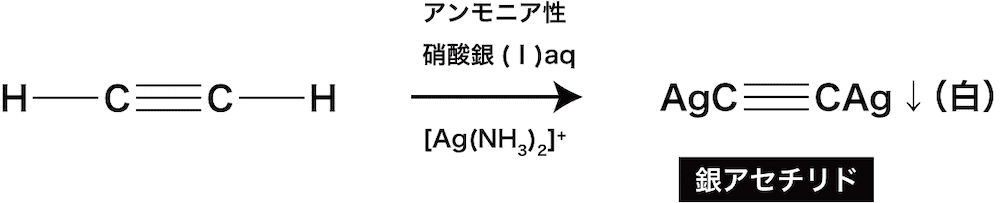
ex1)アルキンにアンモニア性硝酸銀(Ⅰ)水溶液([Ag(NH3)2]+)を加えることによる銀アセチリド白色沈殿の生成
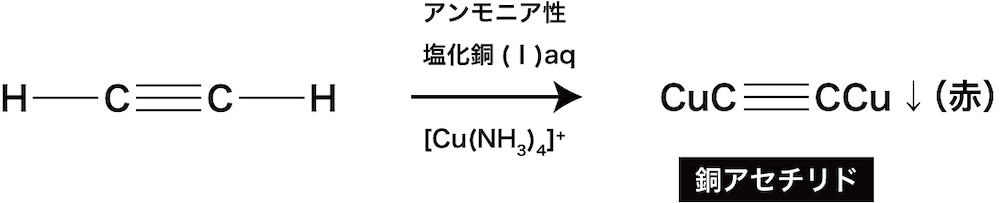
ex2)アルキンにアンモニア性塩化銅(Ⅰ)水溶液([Cu(NH3)4]+)を加えることによる銅(Ⅰ)アセチリド赤色沈殿の生成
アルキン(アセチレン)の製法
- アセチレンを実験室内でつくる際は、炭化カルシウムCaC2(カーバイド)に水H2Oを加える。
\[ \mathrm{CaC_{2} + 2H_{2}O → C_{2}H_{2} + Ca(OH)_{2}} \]
- CaC2はCa2+とーC≡Cーがイオン結合することによって形成されている。
- ーC≡CーはH-C≡C-HからH+が2つ電離したものであるが、H-C≡C-Hは水H-O-Hよりは電離しにくく、より弱い酸なので、水中でーC≡Cーは水からH+を渡されて、アセチレンが遊離する。















