MENU
【硫化亜鉛型構造】イオン結晶の配位数・半径・限界半径比まとめ
目次
はじめに
【プロ講師解説】このページでは『【硫化亜鉛型構造】イオン結晶の配位数・半径・限界半径比まとめ』について解説しています。
硫化亜鉛型構造とは
- 次のような構造をもつイオン結晶を硫化亜鉛型構造(ZnS型構造)という。
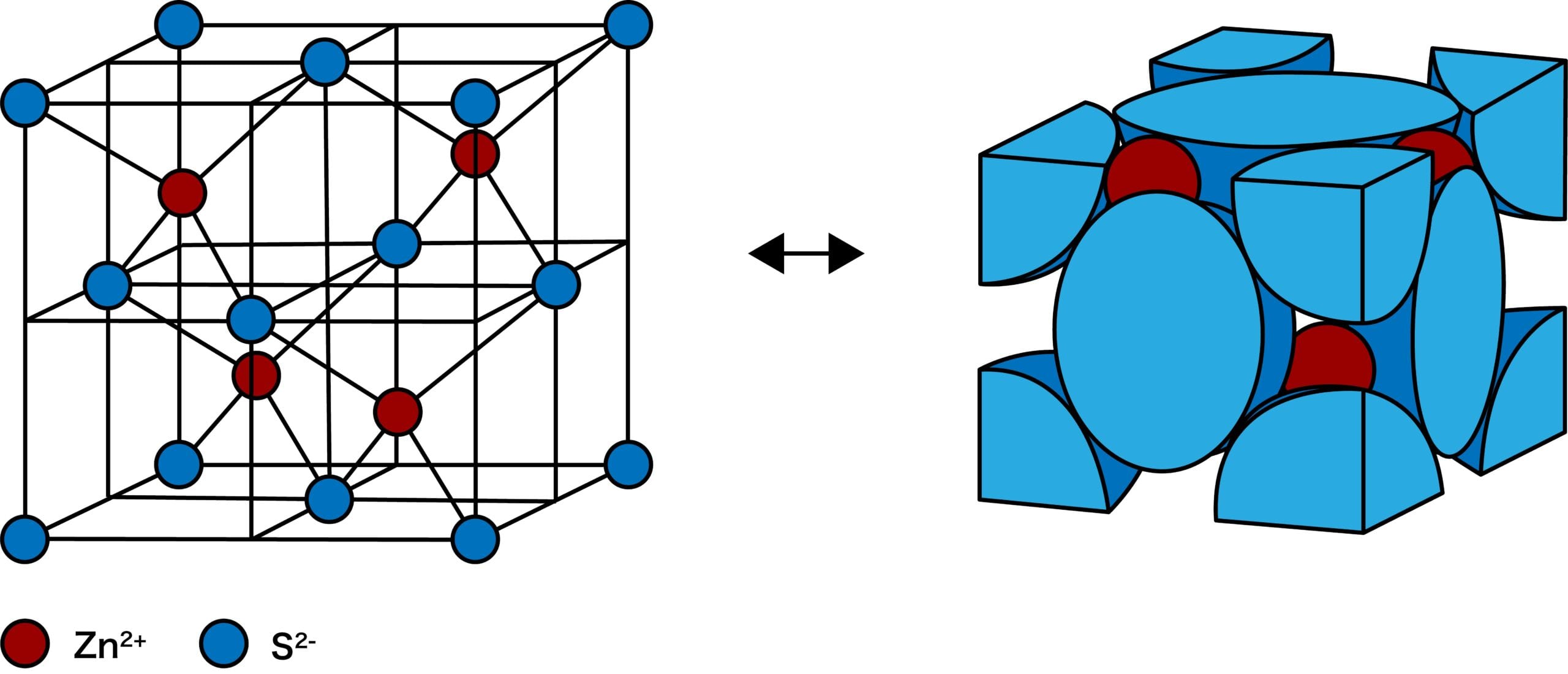
硫化亜鉛型構造に含まれる陽イオン・陰イオンの数
- 硫化亜鉛型構造(ZnS型構造)に含まれる陽イオン、陰イオンの数を数える。
亜鉛イオンZn2+
- まずは、硫化亜鉛型構造(ZnS型構造)に含まれるZn2+を数える。
- 硫化亜鉛型構造(ZnS型構造)の単位格子には丸々1個のZn2+が4個存在する。
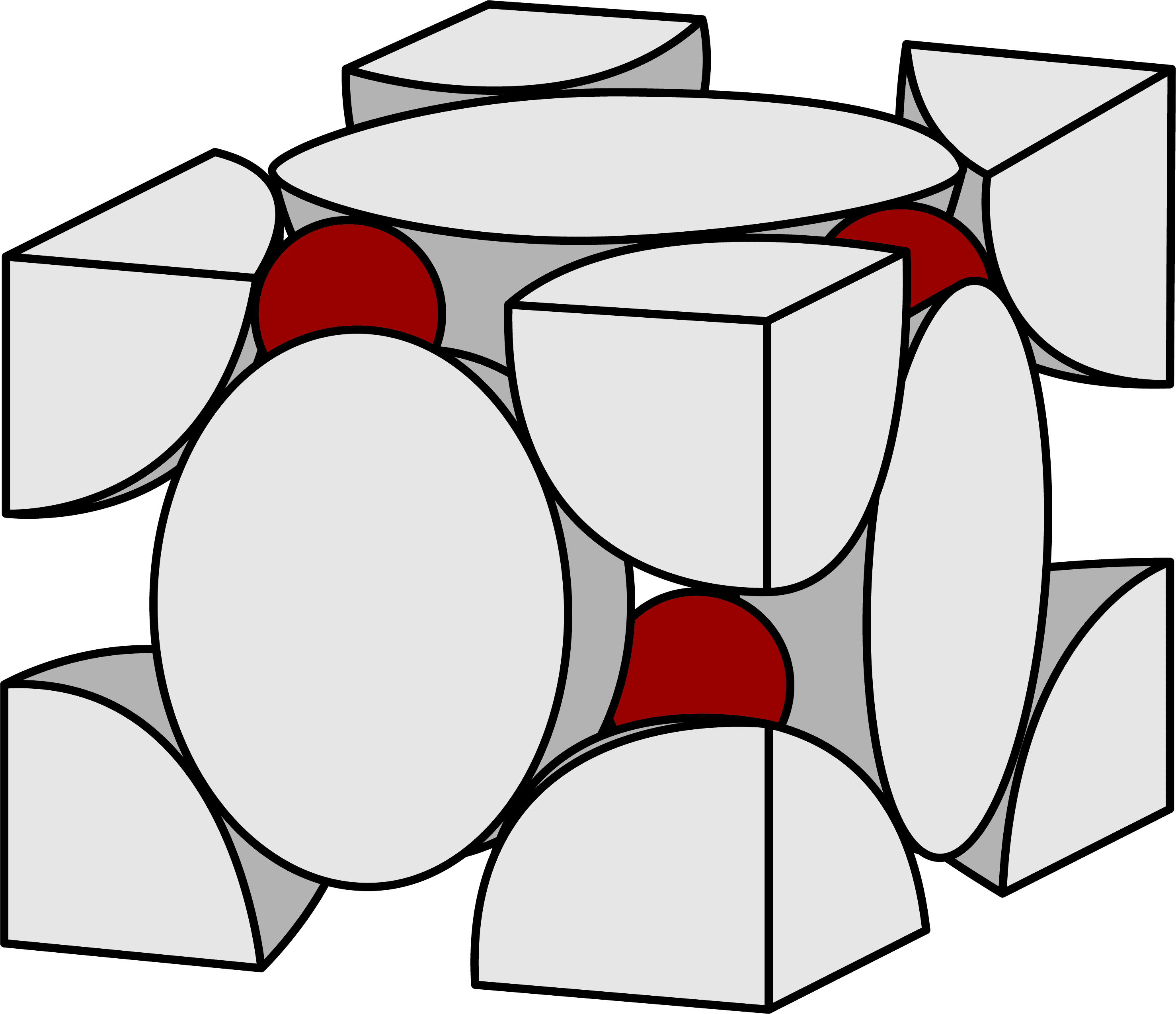
- したがって、硫化亜鉛型構造(ZnS型構造)の単位格子に含まれるZn2+の数は4個である。
S2ーの数
- まずは、硫化亜鉛型構造(ZnS型構造)に含まれるS2ーを数える。
- 硫化亜鉛型構造(ZnS型構造)に含まれるS2ーのうち、格子の各頂点にあるものはS2ーを8分割した状態になっている。
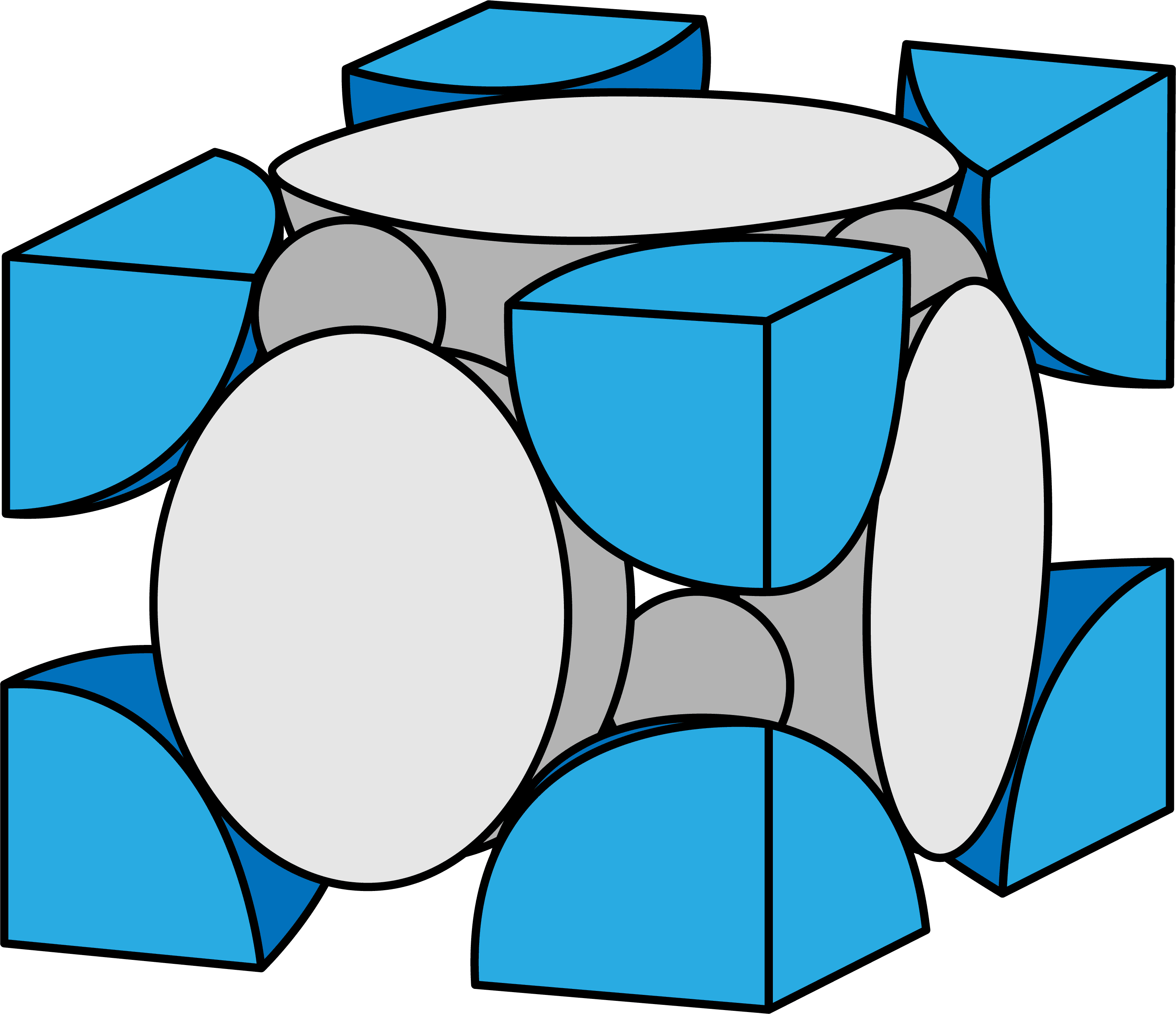
- したがって、8分割(1/8)したものが頂点の数分=8個あるので…
\[
\frac{ 1 }{ 8 }×8=1
\]
- 頂点にあるS2ーの数は合わせて1個である。
- 硫化亜鉛型構造(ZnS型構造)に含まれるS2ーのうち、各“面”の中心にあるものは、S2ーを2分割したものになっている。
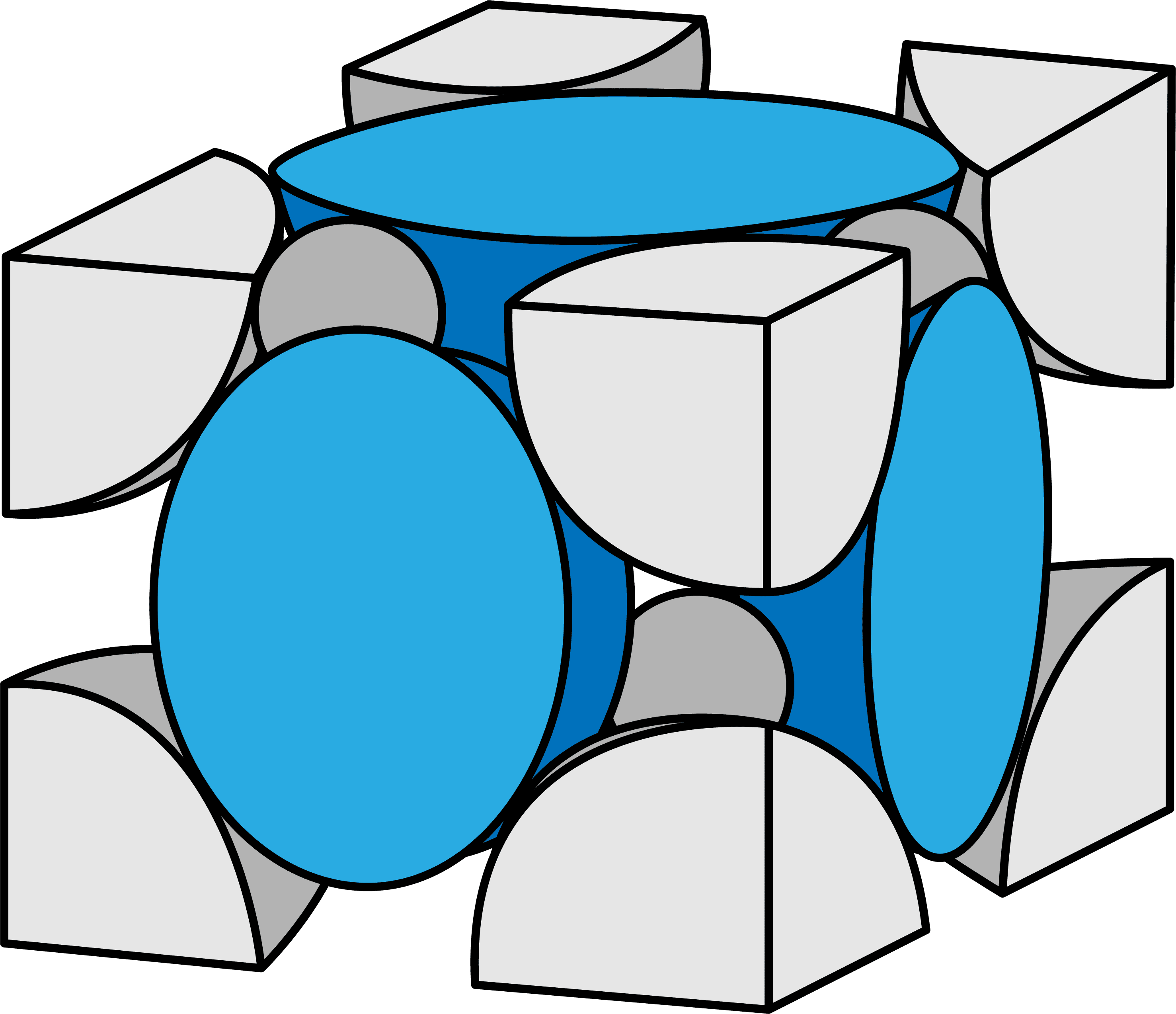
- したがって、2分割(1/2)したものが面の数分=6個あるので…
\[
\frac{ 1 }{ 2 }×6=3
\]
- 面の中心にあるS2ーの数は合わせて3個である。
- 以上より、硫化亜鉛型構造(ZnS型構造)に含まれるS2ーの数は4個である。
\[
1+3=4
\]
硫化亜鉛型構造の配位数
- 硫化亜鉛型構造(ZnS型構造)において、Zn2+は周りの4個のS2ーと接しており、同様にS2ーも周りの4個のZn2+と接している。
- したがって、硫化亜鉛型構造(ZnS型構造)の各イオンの配位数は4である。
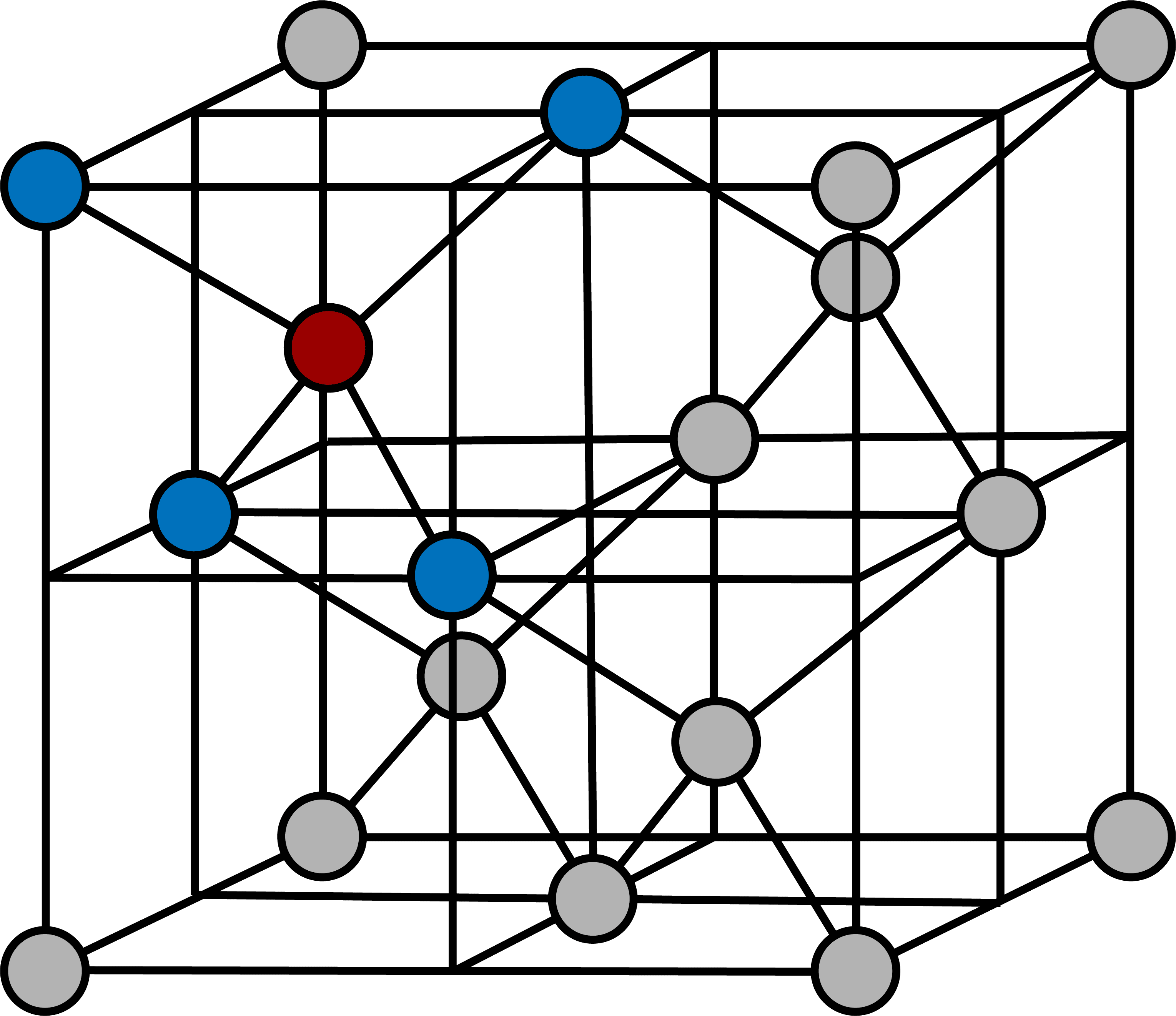
ZnS型構造まとめ
この『【硫化亜鉛型構造】イオン結晶の配位数・半径・限界半径比まとめ』のページで解説した内容をまとめる。
- 硫化亜鉛型構造(ZnS型構造)の単位格子に含まれるZn2+の数は4個である。
- 硫化亜鉛型構造(ZnS型構造)に含まれるS2ーの数は4個である。
- 硫化亜鉛型構造(ZnS型構造)の各イオンの配位数は4である。
- 硫化亜鉛型構造(ZnS型構造)の限界イオン半径比は≦0.41である。
演習問題
【プロ講師解説】化学のグルメでは、高校化学・化学基礎の一問一答問題を公開しています。問題一覧は【スマホで出来る】一問一答(高校化学・化学基礎)でご覧下さい。
問1
硫化亜鉛型構造(ZnS型構造)の単位格子に含まれるZn2+の数は【1】個である。
解答/解説:タップで表示
解答:【1】4
硫化亜鉛型構造(ZnS型構造)の単位格子に含まれるZn2+の数は4個である。
問2
硫化亜鉛型構造(ZnS型構造)に含まれるS2ーの数は【1】個である。
解答/解説:タップで表示
解答:【1】4
硫化亜鉛型構造(ZnS型構造)に含まれるS2ーの数は4個である。
問3
硫化亜鉛型構造(ZnS型構造)の各イオンの配位数は【1】である。
解答/解説:タップで表示
解答:【1】4
硫化亜鉛型構造(ZnS型構造)の各イオンの配位数は4である。
問4
硫化亜鉛型構造(ZnS型構造)の限界イオン半径比は≦【1】である。
解答/解説:タップで表示
解答:【1】0.41
硫化亜鉛型構造(ZnS型構造)の限界イオン半径比は≦0.41である。














