MENU
アルケン(一般式の作り方・一覧・命名法・製法・付加反応など)
はじめに
【プロ講師解説】このページでは『アルケン(一般式の作り方・一覧・命名法・製法・付加反応など)』について解説しています。
アルケンとは
- 一般式CnH2nで表される、炭素炭素二重結合(C=C)を1個もつ鎖式不飽和炭化水素をアルケンという。

- アルケンは「アルカンからHが2個取れて二重結合を形成したもの」と考えることができる。
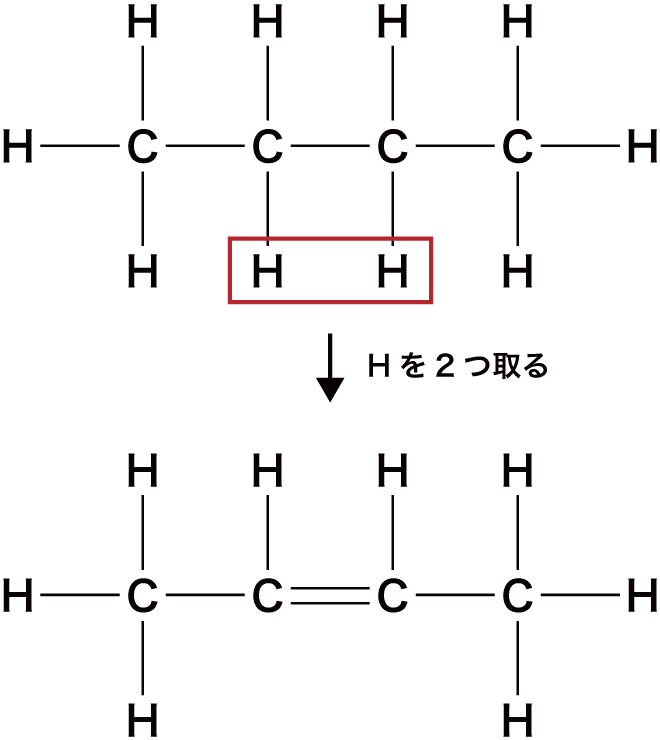
- アルカンからHを2個取っているため、アルケンの一般式はアルカンの一般式であるCnH2n+2からHを2個減らしたCnH2nになる。
- アルカンについて詳しくは次のページを参照のこと。
アルケン一覧
- 代表的なアルケンを次に示す。
| n(炭素数) | 分子式 | 一般名 | 慣用名 |
|---|---|---|---|
| 2 | C2H4 | エテン | エチレン |
| 3 | C3H6 | プロペン | プロピレン |
| 4 | C4H8 | ブテン | なし |
| 5 | C5H10 | ペンテン | なし |
| 6 | C6H12 | ヘキセン | なし |
- アルカンの一般名はアルカンの語尾「〜アン(ane)」を「〜エン(ene)」にしたものである。
慣用名とはルールに基づかない特殊な名称で、一般に暗記する必要があります。
アルケンの命名法
- アルケンの命名は次の手順で行う。
●STEP1
主鎖の炭素C原子の数を数え、ベースとなるアルケン名を決定する。
●STEP2
C=C結合を形成しているCの番号が最も小さくなるようにCに番号をふる。
●STEP3
置換基がある場合は、それが何番目のCについているのかを確認する。
●STEP4
(置換基がついているC番号)-(置換基名)-(二重結合のあるC番号)-(アルケン名)の順で名前をつける。
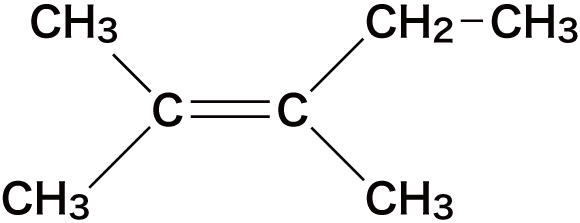
- ここでは次のアルケンを例に命名の手順を確認する。
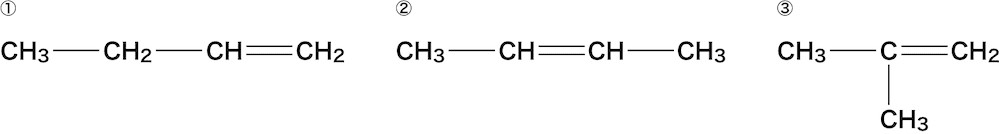
まずは、主鎖(最も長い炭素鎖)の炭素C原子の数を数え、ベースとなるアルケン名を決定する。
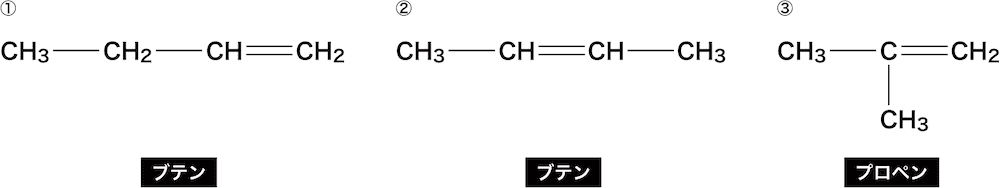
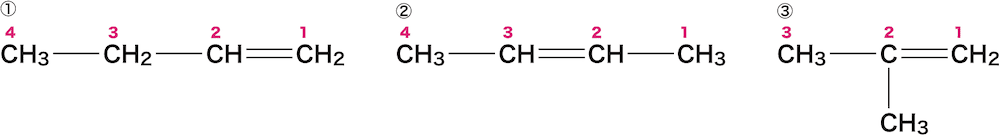
①・②は主鎖の炭素数が4個なので「ブテン」、③は3個なので「プロペン」となる。
次に、C=C結合を形成しているCの番号が最も小さくなるようにCに番号をふる。
次に、置換基がある場合は、それが何番目のCについているのかを確認する。
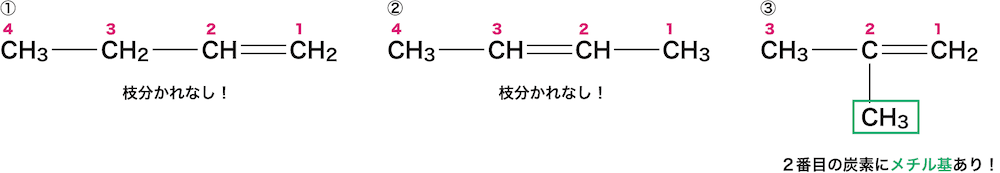
今回の場合、③のアルケンの2番目の炭素にメチル基(-CH3)がついている。
最後に、(置換基がついているC番号)-(置換基名)-(二重結合のあるC番号)-(アルケン名)の順で名前をつける。
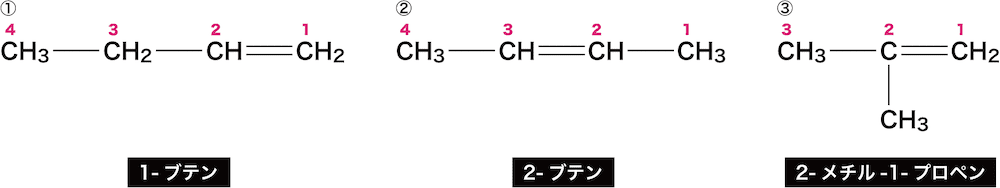
①のアルケンは、1番目と2番目の炭素間に二重結合があるので「1-ブテン(若い方の炭素番号をつける)」、②のアルケンは2番目と3番目の炭素間に二重結合があるので「2-ブテン」、③のアルケンは1番目と2番目の炭素間に二重結合があり、かつ2番目のCにメチル基がくっついているので「2-メチル-1-プロペン」となる。
アルケンの製法
- アルケンはアルコールを脱水することでつくられる。
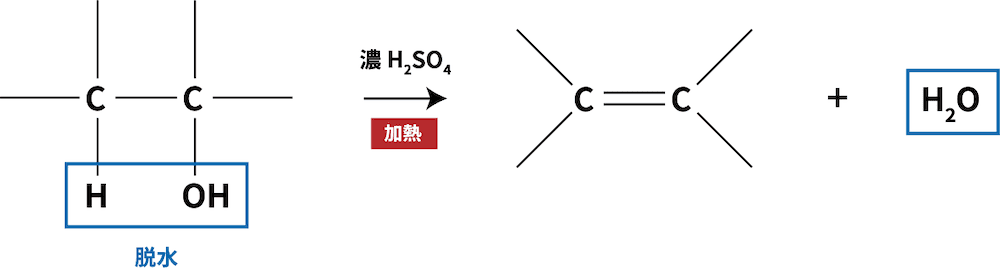
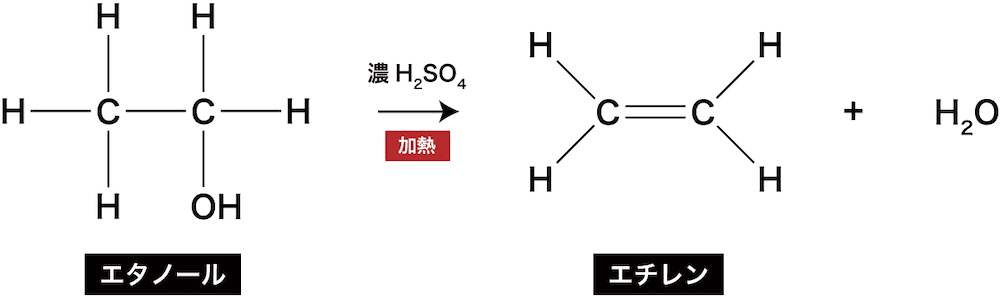
ex)エタノールの脱水によるエチレンの生成反応
- アルコールであるエタノールC2H5OHを脱水すると、エチレンC2H4が生じる。
アルケンの反応①(付加反応)
- アルケンに特徴的な反応として付加反応がある。
- 代表的な4つの付加反応を解説する。
●アルケンの反応①(付加反応)
- ハロゲン化水素HXの付加
- 水H2Oの付加
- 水素H2の付加
- ハロゲンX2の付加
❶ ハロゲン化水素HXの付加
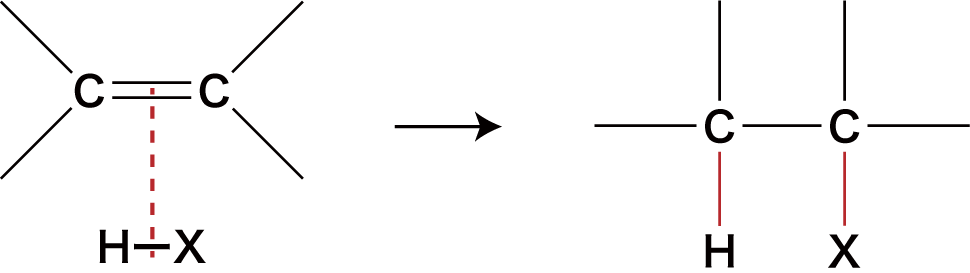
- ハロゲン化水素HXのアルケンへの付加では、次のようにアルケンの二重結合のうち一本が切れ、HXのHとXが付加する。
ハロゲン化水素HXの付加の原理
- アルケンのC=C結合を形成しているπ結合の電子対は、雲のように漂っている。
- 極性の大きなハロゲン化水素分子(ここでは塩化水素HClとする)がπ結合の電子対に接近すると、H+とClーに分かれ、二段階で付加反応が起こる。
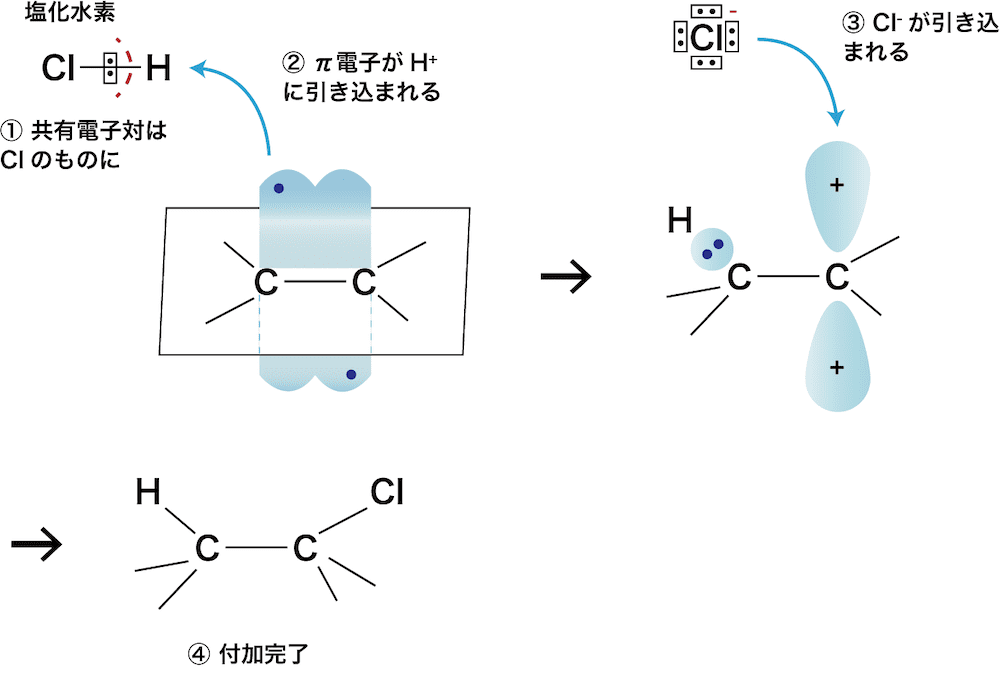
- 塩化水素が酸としてH+を放出し、そのH+をπ結合の電子対が塩基として受け取り、塩化物イオンClーを引きずり込んでいる。
❷ 水H2Oの付加
- 水H2Oのアルケンへの付加では、次のようにアルケンの二重結合のうち一本が切れ、H-OHのHとOHが付加する。
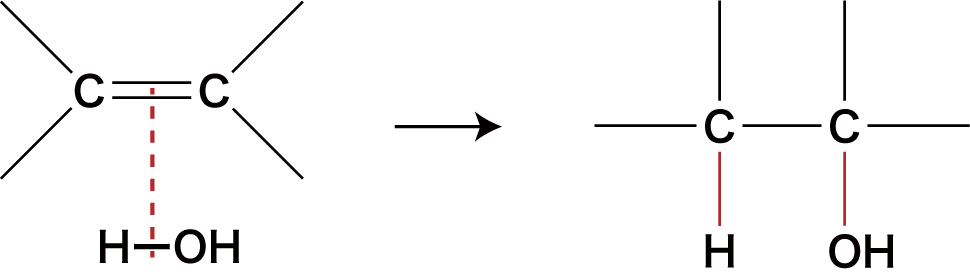
- H2Oの付加には酸触媒である希硫酸やリン酸が必要である。
- また、結果として生成するのはヒドロキシ基(-OH)を1個もつ炭化水素”アルコール”なので、この反応はアルコールの製法とも考えることができる。
参考:アルコール・エーテル(一覧・違い・命名法・製法・反応・性質など)
水H2Oの付加の原理
- 水はハロゲン化水素に比べて電離しにくいため、炭素炭素二重結合(C=C)に水を付加させる場合には酸触媒が必要となる。
- 希硫酸やリン酸のような酸性水溶液では、(水分子H2Oに酸由来のH+が付いてできた)オキソニウムイオンH3O+が存在するため、これが触媒として作用して次のような反応が起こる。
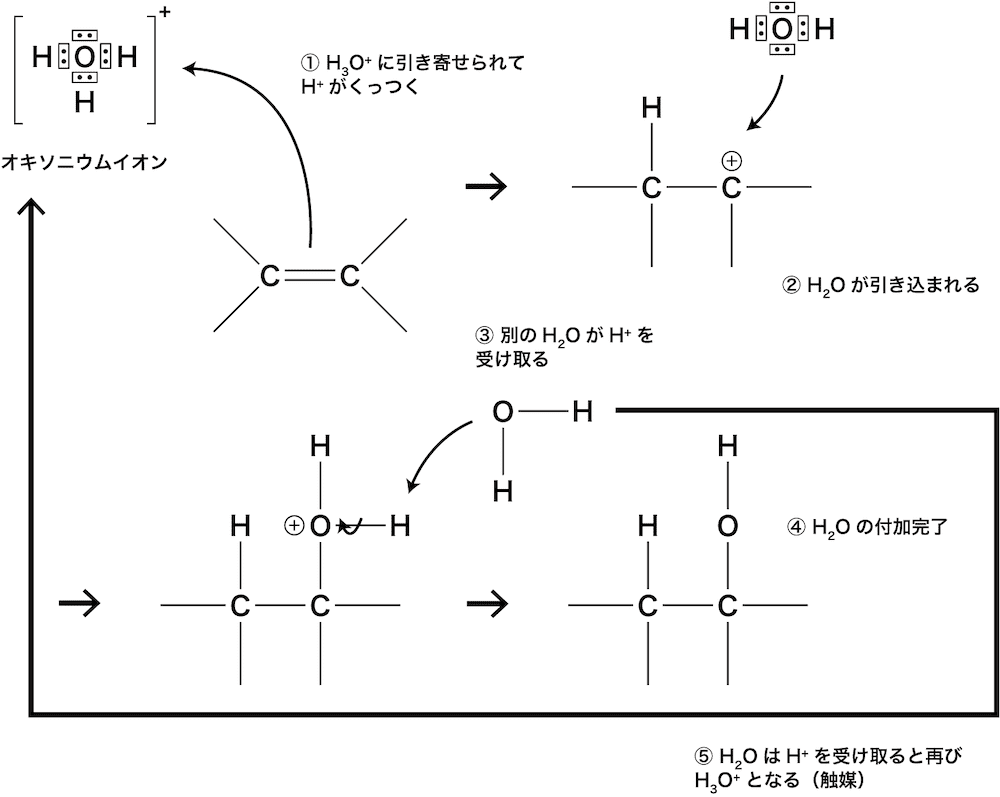
- H3O+は再生するので触媒と考えることができる。
- ちなみに、H3O+のような触媒を使わずにアルケンに水を加えても付加反応が起こることはない。
マルコフニコフ則
- アルケンへのハロゲン化水素HXや水H2Oの付加を考える際、少し注意しなければならないことがある。
- プロピレン(CH3ーCH=CH2)へのH2Oの付加を例に解説する。
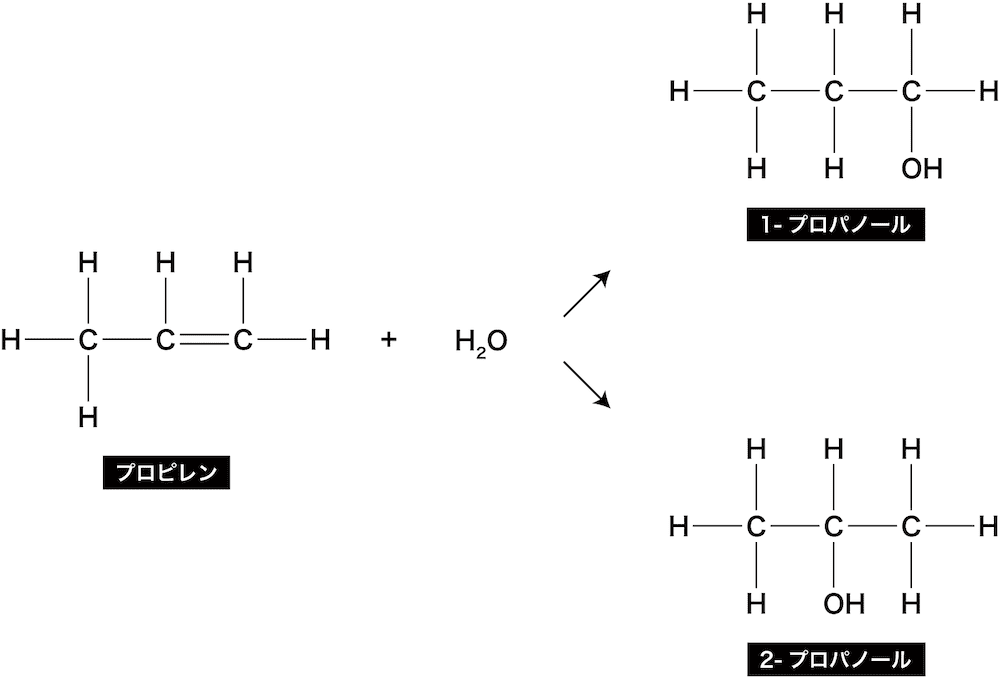
- プロピレンにH2Oが付加すると2種類の物質が生成する。
- 1つはOHが端の炭素に結合した「1-プロパノール」、もう1つはOHが中心の炭素に結合した「2-プロパノール」である。
- しかし、1-プロパノールと2-プロパノールは同じ量、つまり50%ずつできるという訳ではない。
●マルコフニコフ則
Hが多く付いている炭素にHが結合する。
- マルコフニコフ則というルールにより、既にHが多く結合している方の炭素にHが、Hが少ない方の炭素にOHが付く。
- したがって、今回の場合は2-プロパノールができる可能性の方が、1-プロパノールができる可能性よりも高いということになる。
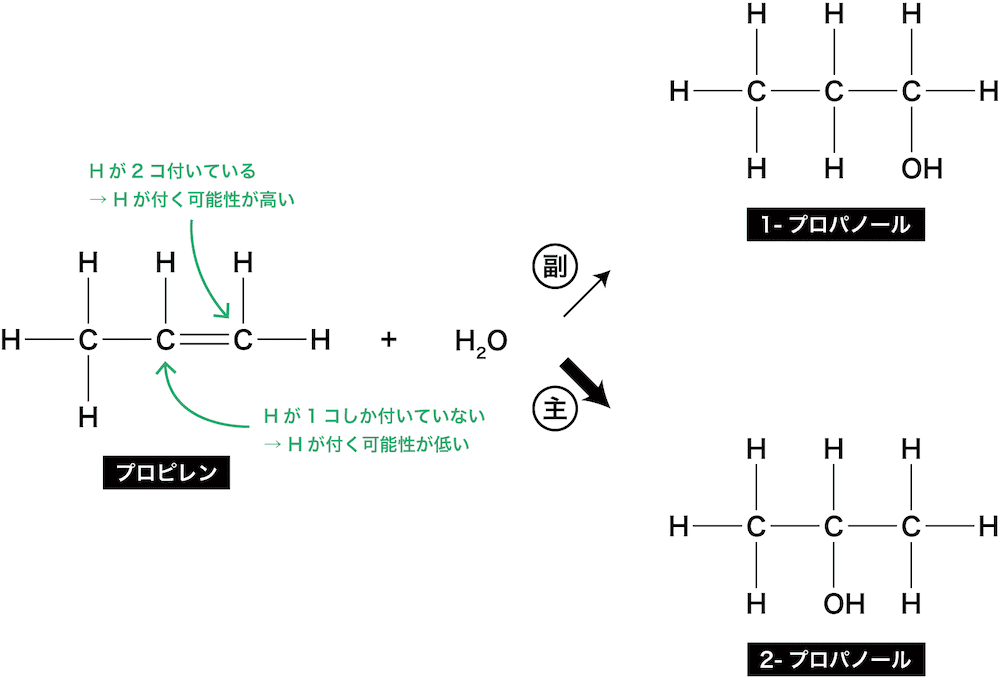
- 結果として、2-プロパノールが主生成物(量が多い生成物)、1-プロパノールが副生成物(量が少ない生成物)となる。
❸ 水素H2の付加
- 水素H2のアルケンへの付加では、次のようにアルケンの二重結合のうち一本が切れ、H-Hの2つのHが付加する。

- この反応では触媒としてニッケルNi・パラジウムPd・白金Ptなどを用いる。
水素H2付加の原理
- ニッケルNi・パラジウムPd・白金Ptなどの金属触媒の表面に接触したH2はH-Hの共有結合が切れた状態で吸着し、付加反応が進行しやすくなる。
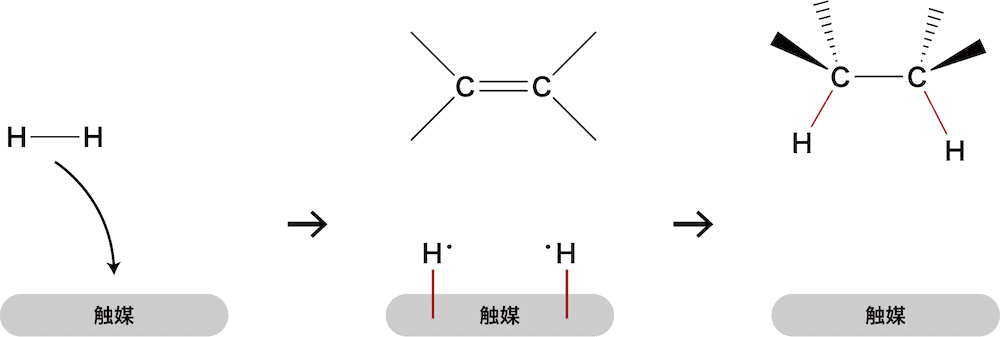
- この反応は、接触還元とよばれている。
❹ ハロゲンX2の付加
- ハロゲンX2のアルケンへの付加では、次のようにアルケンの二重結合のうち一本が切れ、X-Xの2つのXが付加する。
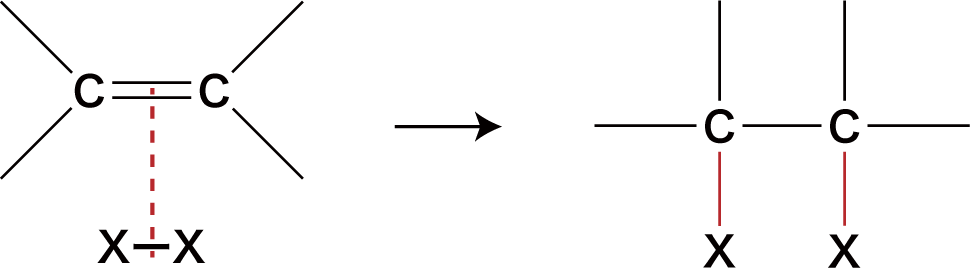
Br2付加によるC=C結合の検出反応
- 酸化剤・還元剤(違い・見分け方・例・一覧など)にあるように、ハロゲンの単体は酸化剤(電子eーを奪うもの)としてはたらく。
\[ \mathrm{X_{2}+2e^{-}→2X^{-}} \]
- π電子を狙い、酸化剤であるX2が攻撃してくるので、付加反応が起こる。
- 無機化学の色まとめ(イオン/化合物(沈殿)/ハロゲンなど)にあるように、Br2の色は赤褐色であり、付加後Br2が無くなるため溶液は無色となる。
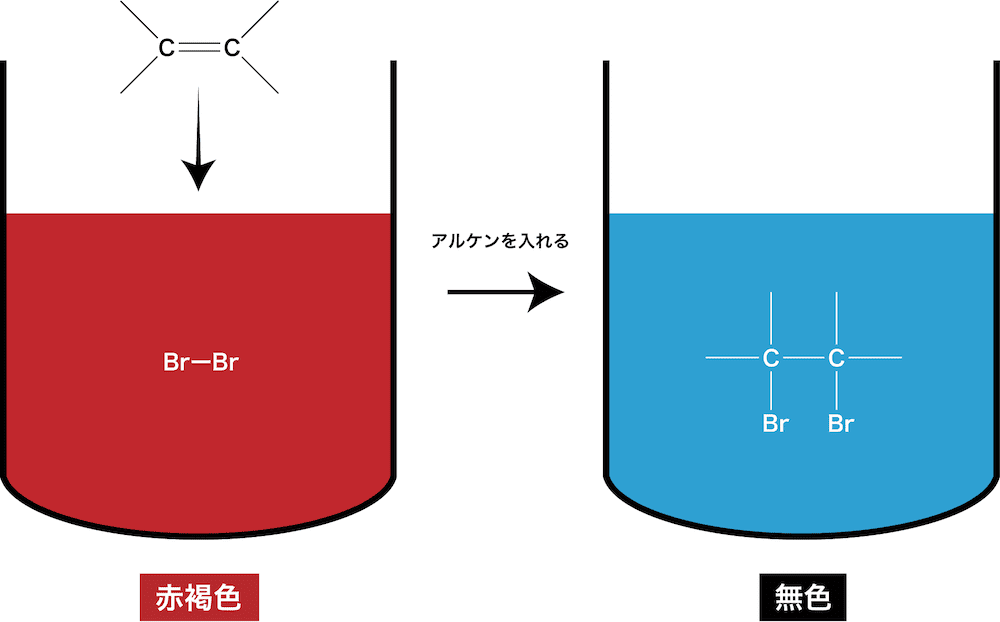
- この反応は色の変化で確認しやすいためC=C結合やC≡C結合の検出反応として用いられる。
- ちなみにこの反応の原理を詳しく図示すると次のようになる(二段階で反応が進む)。
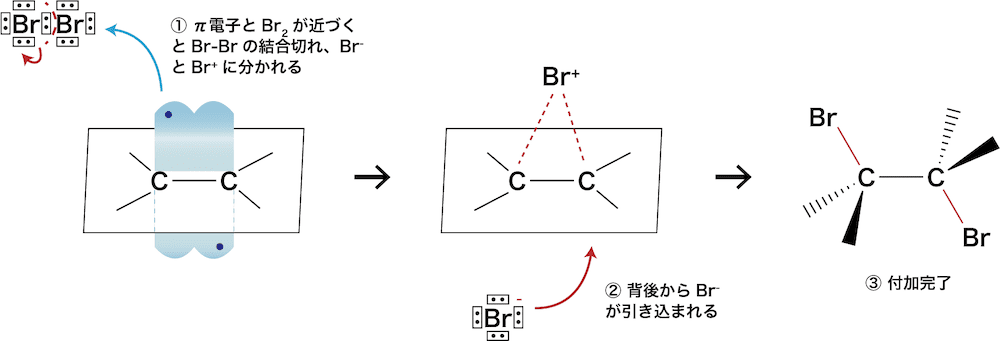
アルケンの反応②(付加重合)
- アルカンは複数の分子が連続して付加反応を繰り返し、分子量の大きな“高分子”となることがある。この反応を付加重合という。
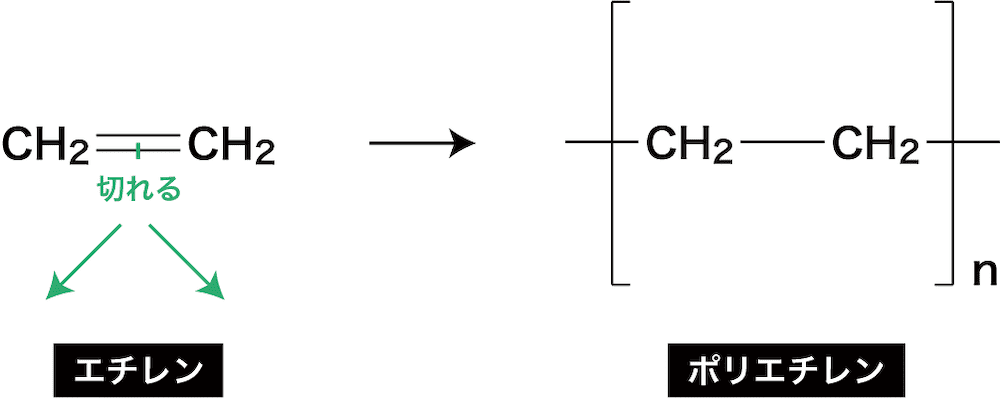
- 二重結合のうち一本を切って、それぞれが外側と結合をつくっている。
- nというのは[]内のものが大量にあることを示しており、この状態になった化合物の名称には“ポリ”を付けることが多い。
アルケンの反応③(酸化開裂反応)
- C=C結合をもつ化合物に強い酸化剤(オゾンO3・過マンガン酸カリウムKMnO4など)を加え、適切な条件下で反応させると、C=C結合が切断され、カルボニル基へと変化する。
- この反応の生成物を見ると、元のアルケンの構造式を導き出すことができる。
- 例として、あるアルケンを強力な酸化剤で酸化したときに次の化合物が得られたとする。
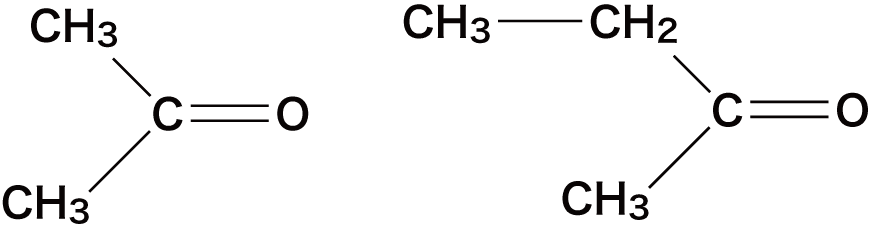
- この場合、元のアルケンは次のように推測することができる。